牦牛与犏牛睾丸支持细胞分离培养及生物学特性比较分析
2021-06-30陈雪梅易川平王明秀钟金城
陈雪梅, 易川平, 罗 辉, 张 鹏, 王明秀, 蔡 欣*, 钟金城*
(1. 西南民族大学 青藏高原动物遗传资源保护与利用四川省、教育部重点实验室,成都610041; 2.西南科技大学生命科学与工程学院,绵阳 621010)
犏牛是牦牛与普通牛的杂交后代,在产肉、产奶、役用能力和肉质等性状方面具有明显的杂种优势,同时对青藏高原恶劣气候环境有很好的适应能力,但犏牛雄性不育极大限制了其在牦牛杂交育种中的有效利用。近年来,犏牛雄性不育是研究的重点,组织学研究发现,犏牛雄性不育主要表现在睾丸组织中精母细胞数量变少、曲细精管中极少见精子和减数分裂受阻[1]。陈会友等[2]综述了DNA甲基化、组蛋白修饰、非编码RNA等与犏牛不育的关系,从分子生物学水平总结了犏牛不育的原因。
精子的发生是生精细胞在睾丸组织曲细精管内一系列复杂的细胞增殖以及分化过程,是一个受高度调控的过程,主要包括精原细胞有丝分裂增殖、精母细胞减数分裂和单倍体精子形成3个阶段[3]。睾丸细胞如生精细胞、支持细胞、间质细胞均参与了精子发生过程[4]。睾丸支持细胞附着于生精小管基膜,其上黏附生精细胞,是与生精细胞唯一直接接触的体细胞,作为生精细胞非常重要的微环境组成存在于精子发生的各个时期,在整个生精周期中具有举足轻重的作用[5]。最新研究发现,组蛋白修饰及甲基转移酶表达在牦牛与犏牛的生殖细胞及睾丸支持细胞中存在明显差异[6],犏牛睾丸中与支持细胞发育及类固醇生成相关基因的低表达[7],提示犏牛睾丸支持细胞存在缺陷,然而,关于牦牛与犏牛睾丸支持细胞的体外培养、增殖特性、相关基因表达等,还鲜有文献报道,此部分的探索有利于进一步揭示犏牛雄性不育的生理机制。饲养层细胞经丝裂霉素C(化学方法)或射线(物理方法)处理后,细胞不能再进行分裂增殖却依然保持着代谢活性,通过分泌生长因子和物理支持可以一定程度模拟细胞增殖的体内环境,广泛应用于干细胞及其他体外培养困难的哺乳动物细胞的培养[8]。睾丸支持细胞采用丝裂霉素C处理后可作为饲养层细胞进行精原干细胞体外培养,可应用于动物繁殖、转基因动物制备、雄性不育治疗、再生医学等领域[9-13]。
为探究牦牛与F1雄性犏牛睾丸支持细胞的差异,本研究分离纯化两个牛种睾丸支持细胞并予以鉴定;筛选不同的培养基,构建更适合的睾丸支持细胞长期体外培养体系;比较两牛种睾丸支持细胞的体外增殖特性和标志、功能基因的表达差异;通过不同浓度丝裂霉素C处理两种牛的支持细胞,评价其针对丝裂霉素C处理的耐受特性。从睾丸支持细胞角度分析犏牛雄性不育的相关原因,为进一步探究犏牛雄性不育提供依据。
1 材料与方法
1.1 试验材料
二氧化碳培养箱(Thermo,美国),倒置荧光显微镜(Zeiss,德国),实时荧光定量PCR仪(Bio-Rad,美国),细胞计数仪(JIMBIO,中国),全功能酶标仪(Bio-Tek,美国),特级胎牛血清(Clark,美国),DMEM/F12培养基(Gibco,美国),DMEM高糖培养基(Gibco,美国),胰蛋白酶(Gibco,美国),碱性磷酸酶染液(索莱宝,中国),油红O染色液(索莱宝,中国),丝裂霉素C(MCE,中国),CCK8试剂(同仁,日本),GATA-4抗体(Santa Cruz,日本)。
1.2 牦牛及犏牛睾丸组织取材及组织冻存
在四川省阿坝州红原县采集24月龄3头健康公麦洼牦牛及3头F1公犏牛的睾丸组织,用含双抗的PBS溶液清洗后,去除睾丸白膜,将其剪至为6 mm3大小的组织块,加入冷冻保护液(10%DMSO+10%胎牛血清+80%完全培养基)浸泡组织块,室温处理5 min后,放入液氮中保存,样本分为牦牛与F1犏牛两个组,每组3个重复,液氮转运至实验室进行后续试验。
1.3 牦牛及犏牛睾丸支持细胞的分离培养
从液氮中取出冻存的睾丸组织约0.5 g,37 ℃水浴处理2 min,待组织融化后用镊子取出,置于复苏液中(DMEM高糖培养基+0.5 mol·L-1蔗糖+20%FBS),37 ℃水浴放置2 min,预热PBS洗涤组织块2~3次, 组织块置于DMEM高糖培养基中,用眼科剪剪碎组织,加入终浓度为1 mg·mL-1的Ⅳ型胶原酶及0.5 μg·mL-1的DNase I,37 ℃震荡水浴消化组织30~40 min,镜下见为单个细胞悬液,加入胎牛血清终止消化,混合细胞悬液吹打均匀后,依次经70 μm与40 μm筛网过滤,收集滤液经300×g4 ℃离心5 min,弃上清,完全培养基重悬细胞,37 ℃, 5% CO2培养,取部分细胞悬液进行台盼蓝染色,自动计数仪计数,计算细胞活率。混合细胞悬液培养24 h差速贴壁后,移去上清液,并加入PBS尽量洗弃悬浮的生精细胞,加入基础培养基饥饿处理24 h, 37 ℃,5% CO2培养,换液加完全培养基,镜下观察记录细胞增殖生长过程。
1.4 睾丸支持细胞的鉴定
1.4.1 碱性磷酸酶染色(ALP染色)鉴定贴壁细胞碱性磷酸酶特性 取经分离培养传代至第三代的贴壁细胞,弃去培养基,沿壁缓慢加入PBS清洗细胞2次,再加入ALP固定液固定3 min,PBS清洗2次, 加入ALP孵育液,避光孵育20 min,PBS清洗2次,加入核固红染色液复染3 min,PBS清洗2次,显微成像记录结果。
1.4.2 油红O染色鉴定睾丸支持细胞内脂滴分布 取经分离培养传代至第三代的贴壁细胞,弃去培养基,用PBS洗两次,加ORO Fixative固定液固定20~30 min。弃固定液,用蒸馏水洗2次。加入60%异丙醇浸洗5 min,弃去60%异丙醇后加入新配制好的ORO Stain,浸染10~20 min。弃染色液,水洗2~5次,加入Mayer苏木素染色液,复染核1~2 min。弃染液后水洗2~5次。加入ORO Buffer 1 min,弃去,加入蒸馏水覆盖细胞并在显微镜下观察。
1.4.3 GATA-4免疫荧光染色鉴定支持细胞标志蛋白 取2.0×104个第3代细胞接种至12孔板,待细胞融合度达80%左右时弃培养基,PBS洗3次弃去,加入4%多聚甲醛室温固定20 min,PBS洗3次, 加入PBS配制的0.5% Triton X-100处理20 min, PBS洗3次,3%BSA封闭30 min,加300 μL GATA-4 抗体(1∶150),4 ℃孵育过夜,PBS洗3次, 加入终浓度为5 μg·mL-1的DAPI染色5 min, PBS洗3次,显微成像记录结果。
1.4.4 RT-PCR检测鉴定支持细胞是否有间质细胞、生精细胞污染 取经分离培养传至第三代的贴壁细胞,经TRIzol法提取总RNA,TaKaRa逆转录试剂盒反转录合成cDNA, PCR扩增SOX9、3β-羟类固醇脱氢酶7(3β-hydroxy-steroid-dehydrogenase 7,3β-HSD7)、DEAD盒解旋酶4(DEAD-box helicase 4,DDX4),扩增引物序列见表1。扩增体系为20 μL, 引物加入终浓度为300 nmol·L-1,cDNA模板加入1 μL。Bio-Rad仪检测程序: 95 ℃, 3 min,(95 ℃ 10 s, 60 ℃ 1 min) 循环35次。PCR产物经1.5%琼脂糖凝胶电泳,成像。
1.5 睾丸支持细胞增殖曲线测定
分别取第三代牦牛与犏牛睾丸支持细胞,经细胞计数仪计数后,按每孔100 μL完全培养基接种7.5×103个细胞至96孔板中,分别采用DMEM高糖与DMEM/F12培养基进行适宜培养基的比较,37 ℃,5% CO2培养,接种培养后第2~6天,每间隔24 h进行一次CCK8检测,每孔加入10 μL CCK8试剂,反应1.5 h后检测OD450 nm值,每天记录支持细胞增殖活性变化数据。
1.6 睾丸支持细胞相关标志物基因表达检测
采用逆转录实时荧光定量PCR的方法检测相关标志物的转录表达情况,取第三代牦牛与犏牛支持细胞,采用TRIzol法提取细胞总RNA,加入1 mL TRIzol室温裂解支持细胞 5 min,加入200 μL氯仿,震荡混匀,室温放置2 min,4 ℃,12 000×g离心15 min,取上清置于新EP管中,记录体积,加入等体积异丙醇,4 ℃,12 000×g离心10 min,弃上清液,加入1 mL 75% DEPC乙醇洗涤沉淀,4 ℃,7 500×g离心5 min,室温放置干燥RNA沉淀,加入50 μL 无 RNase水溶解RNA。取1 μg总RNA进行逆转录,采用TaKaRa逆转录试剂盒,参考试剂说明书操作,使用基因的特异上、下游检测引物进行基因转录水平的检测,包括GATA结合蛋白4(GATA binding protein 4,GATA-4)、SOX9、WT1、干细胞因子(stem cell facor,SCF)、GDNF、骨形态发生蛋白4(bone morphogenetic protein-4,BMP4)、CXCL12、成纤维细胞生长因子2(fibroblast growth factor 2,FGF2)、Ets差异基因5(Ets variant gene 5,ETV5)、白细胞介素1α(interleukin-1α,IL-1a)、白细胞介素6(interleukin-6,IL-6)、TGF-β1、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、Fas细胞表面死亡受体(Fas cell surface death receptor,Fas)、Fas基因配体(Fas ligand,FasL)、EGF,引物序列信息见表1。体系为20 μL,引物加入终浓度为400 nmol·L-1,cDNA模板加入1 μL。Bio-Rad CFX96 Real-time PCR仪检测程序: 95 ℃,1 min, (95 ℃ 10 s, 58 ℃ 20 s,72 ℃ 15 s)循环40次;循环结束后从65 ℃ 到95 ℃,每5 s上升0.5 ℃取荧光值绘制熔解曲线,确定扩增产物的特异性。

表1 牦牛和犏牛睾丸支持细胞相关基因表达qPCR检测引物
1.7 牦牛、犏牛睾丸支持细胞丝裂霉素C药物耐受性检测
取两种牛的第3代睾丸支持细胞接种至六孔板,待细胞长至95%融合度,分别加入0.4、0.8、1.2 μL 丝裂霉素C(原液浓度为10 mmol·L-1),处理24 h后换液,分别培养1周、2周后记录细胞生长状态。
1.8 数据统计与分析
用GraphPad Prism对所有数据进行统计学处理。RT-qPCR定量结果采用△△Ct法进行分析,每组试验重复3次以上,采用t检验进行显著性分析,P<0.01 表示差异极显著,P<0.05表示差异显著。
2 结 果
2.1 牦牛与犏牛睾丸组织酶消化后支持细胞的分离培养
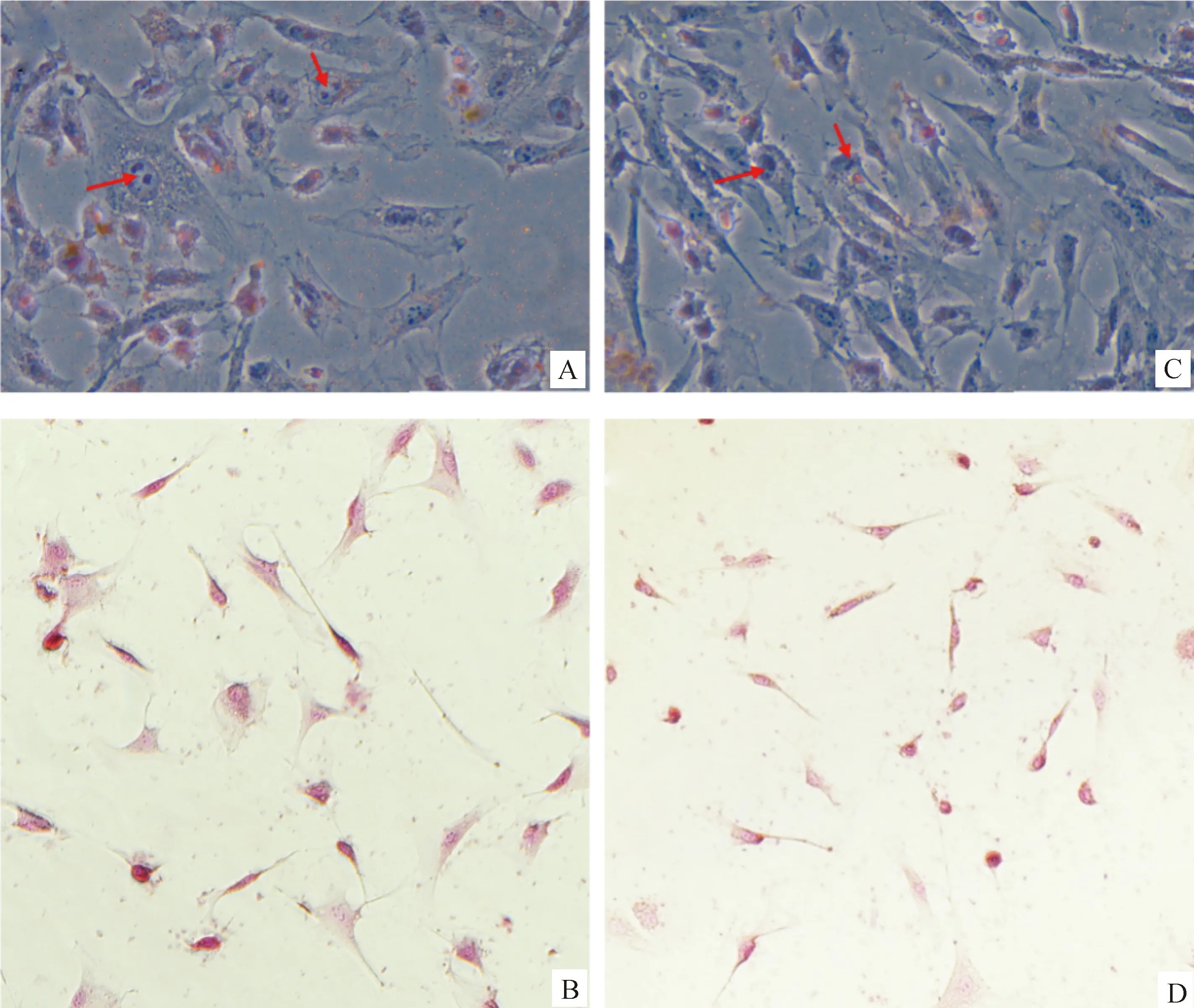
采用混合酶消化法获得单个细胞悬液,台盼蓝染色与全自动细胞计数仪计数结果见表2,可见最初从牦牛睾丸组织分离出的细胞数目及活率均大于犏牛(图1),为排除细胞碎片等杂质,计数粒径范围为9~30 μm。细胞混合液经24 h差速贴壁,贴壁细胞有清晰的细胞轮廓,呈现多边形或长梭形,可见牦牛组织所得贴壁细胞的数目远多于犏牛组织,两者细胞形态相似(图2A、B)。移去上清液及上清中的生精细胞,饥饿处理24 h后,再次加入完全培养基继续培养24 h(图2C、D),再次移去上清及上清中残留的生精细胞,加入完全培养基培养24 h后,培养体系中仅剩余极少量悬浮的生精细胞,同时可以发现,经饥饿处理与反复差速贴壁后获得的F1雄性犏牛贴壁细胞的数量及增殖速度低于牦牛(图2E、F)。
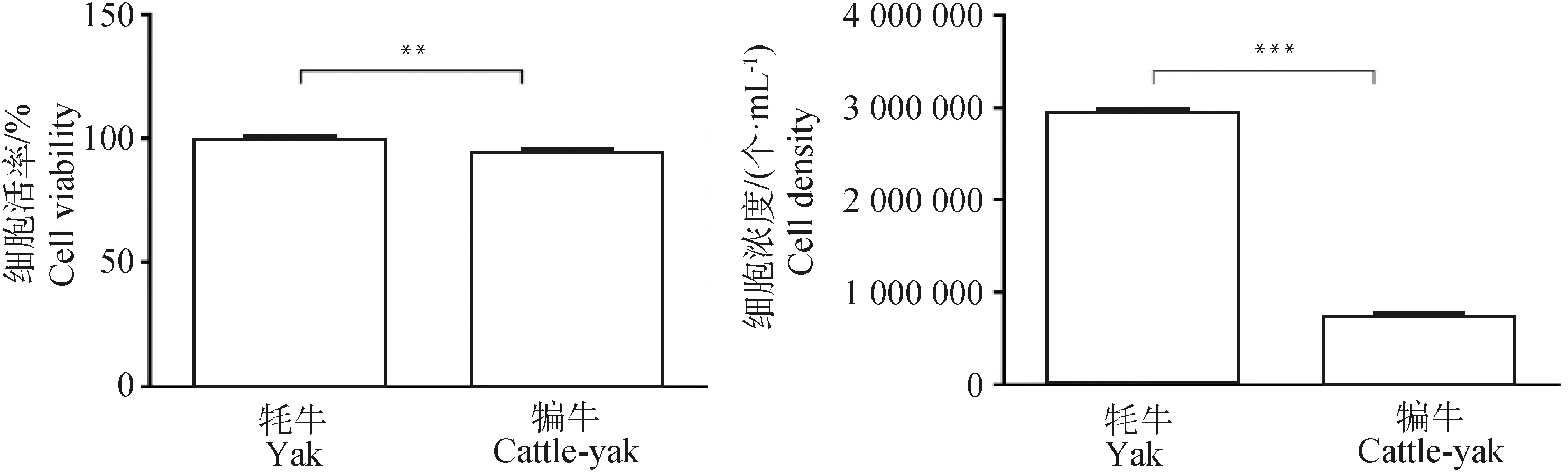
*.P<0.05; **. P<0.01; ***.P<0.001。下同

A和B分别为牦牛和犏牛睾丸组织经24 h培养后的混合细胞原液; C和D分别为经24 h饥饿处理,再培养24 h的牦牛和犏牛混合细胞组分; E和F分别为更换培养上清,再培养24 h的牦牛和犏牛混合细胞组分

表2 细胞计数及活率检测
2.2 牦牛与犏牛睾丸支持细胞的鉴定
将分离纯化的贴壁细胞经胰酶消化传代,取第3代细胞进行碱性磷酸酶染色、油红O染色及GATA-4免疫荧光染色,结果如图3所示,源自牦牛和犏牛的贴壁细胞油红O染色均可见粉红或橙色脂滴及支持细胞特有的双极小体(图3A、B),碱性磷酸酶染色结果显示,细胞质未上色而细胞核均为红色,所以碱性磷酸酶结果均为阴性(图3C、D),同时取第3代贴壁细胞并通过免疫荧光染色检测发现,支持细胞标志蛋白GATA-4在两牛种支持细胞均有明显表达,绿色为GATA-4特异性着色,蓝色为细胞核,浅蓝色为合并图像(图4A~F)。同时取第3代贴壁细胞进行SOX9、3β-HSD7、DDX4基因转录水平的检测发现,PCR产物电泳结果显示睾丸间质细胞表达标志物3β-HSD7、生殖细胞表达标志物DDX4等在贴壁细胞中基本无表达,SOX9作为睾丸支持细胞特异标志物表达(图5)。
A和B分别为牦牛和犏牛睾丸支持细胞油红O染色,蓝色为苏木素染核,红色箭头为支持细胞特有双极小体(400×);C和D分别为牦牛和犏牛睾丸支持细胞碱性磷酸酶染色,红色为甲基红染核(100×)
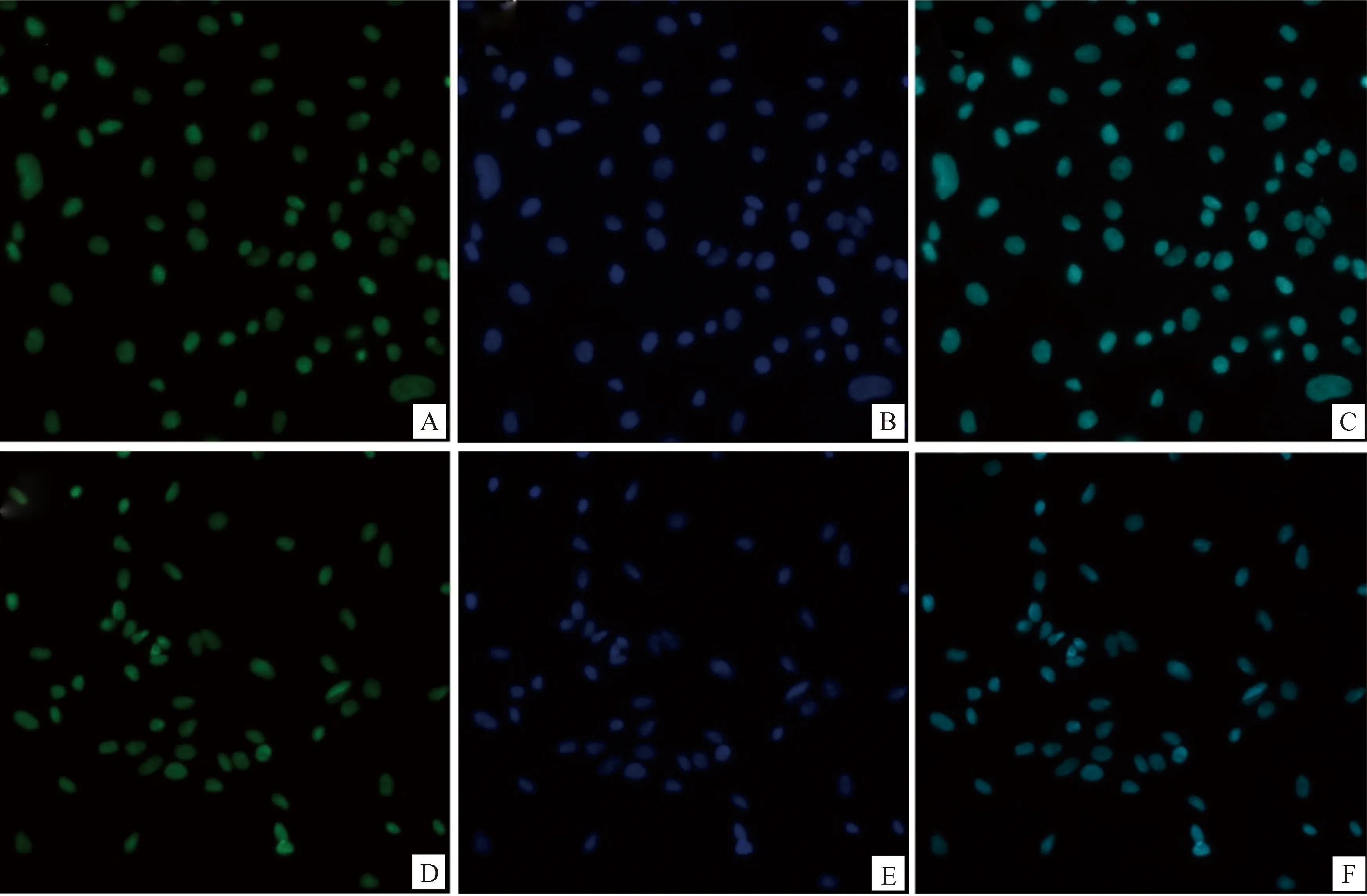
A、B、C为牦牛睾丸支持细胞,D、E、F为犏牛睾丸支持细胞,其中绿色为GATA-4特异性结合位点,蓝色为细胞核,浅蓝色为合并图像
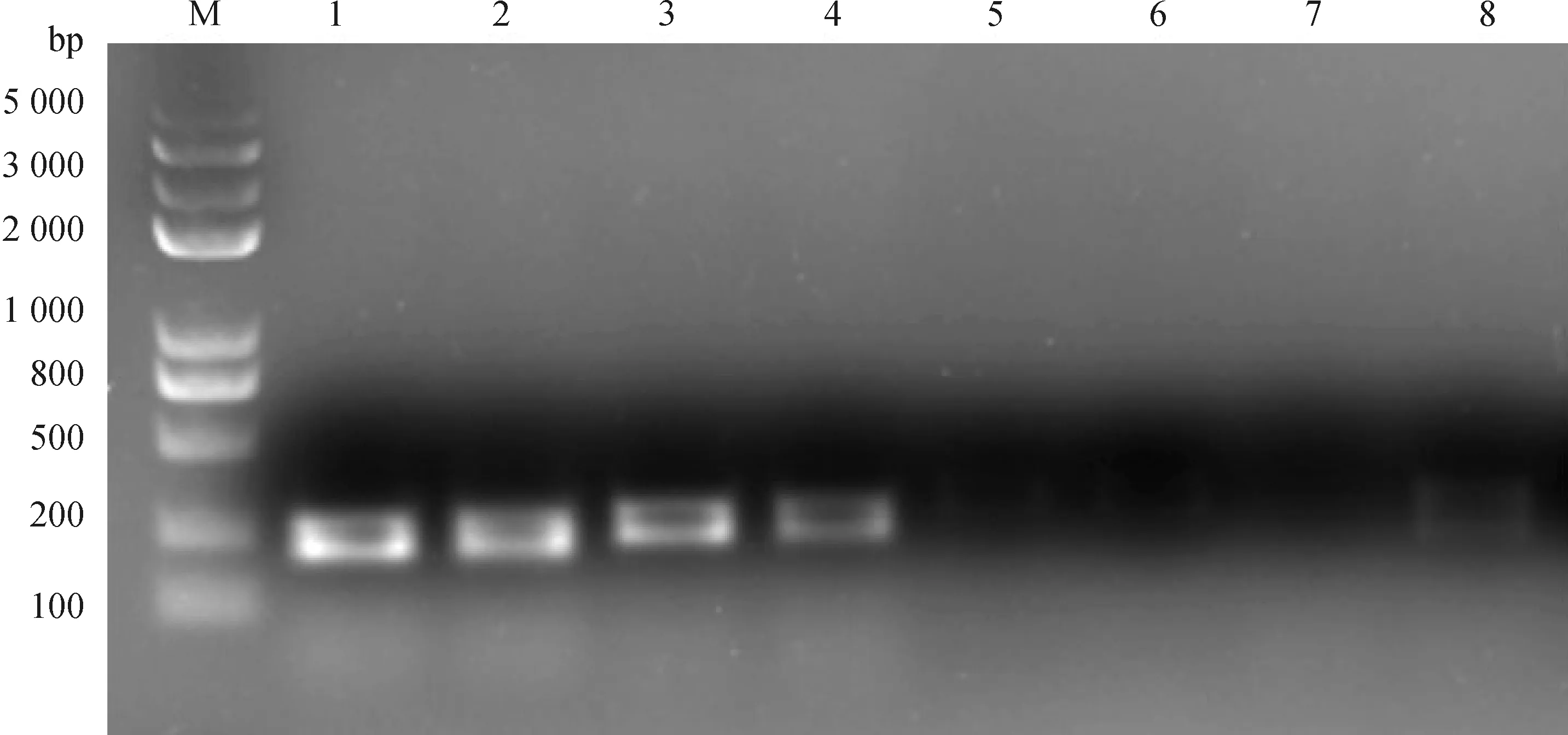
M. DNA相对分子质量标准;1、2. 牦牛与犏牛分离纯化贴壁细胞β-actin基因RT-PCR扩增结果;3、4. 牦牛与犏牛分离纯化贴壁细胞SOX9基因RT-PCR扩增结果;5、6. 牦牛与犏牛分离纯化贴壁细胞3β-HSD7基因RT-PCR扩增结果;7、8. 牦牛与犏牛分离纯化贴壁细胞DDX4基因RT-PCR扩增结果
2.3 牦牛与犏牛睾丸支持细胞的体外增殖
为摸索更为适合的培养基,分别采用DMEM高糖与DMEM/F12培养基进行牦牛与犏牛睾丸支持细胞的培养,利用CCK8方法检测细胞活性,绘制增殖曲线,如图6所示,整体细胞增殖曲线呈现S型,无论采用DMEM高糖培养基还是DMEM/F12培养,牦牛睾丸支持细胞的增殖速率及活性远高于犏牛(图6A、B);采用DMEM高糖培养基培养两牛种的睾丸支持细胞在细胞活性及增殖特性方面均优于DMEM/F12培养基(图6C、D)。
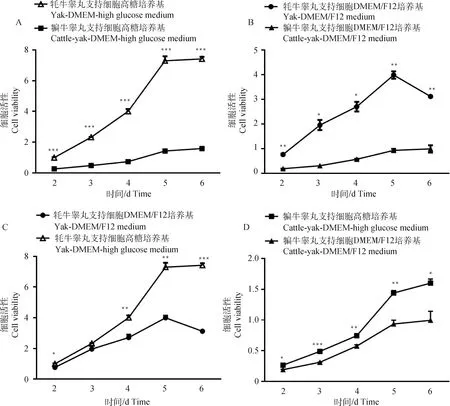
A. 采用DMEM高糖培养基培养牦牛与犏牛支持细胞的增殖曲线;B. 采用DMEM/F12培养基培养牦牛与犏牛支持细胞的增殖曲线;C. 分别采用DMEM高糖与DMEM/F12培养基培养牦牛睾丸支持细胞的增殖曲线;D. 分别采用DMEM高糖与DMEM/F12培养基培养犏牛睾丸支持细胞的增殖曲线
2.4 牦牛与犏牛睾丸支持细胞相关基因表达水平检测
采用RT-qPCR方法检测第三代睾丸支持细胞的特异标志、免疫豁免和促精原干细胞增殖分化相关基因的表达,发现GATA-4、SCF、BMP4、FGF2、ETV5、IL-1a、IL-6、TNF-α、Fas和FasL在两牛种中的表达量无明显差异;而GDNF、CXCL12、TGF-β1、SOX9和WT1基因在两牛种中的表达存在明显差异,与牦牛比较,GDNF在犏牛睾丸支持细胞中下调了3.4倍(P<0.05),CXCL12上调了3.6倍(P<0.05),TGF-β1下调了2.9倍(P<0.05),SOX9下调了25.9倍(P<0.01),WT1下调了38.7倍(P<0.01)(图7)。

图7 牦牛与犏牛睾丸支持细胞相关基因表达检测
2.5 丝裂霉素C处理牦牛与犏牛支持细胞
加入不同浓度丝裂霉素C,分别处理牦牛与犏牛的睾丸支持细胞,比较牦牛与犏牛睾丸支持细胞对丝裂霉素药物的耐受性发现,加入丝裂霉素C,牦牛与犏牛睾丸支持细胞的形态均发生变化,胞质有白色空泡,细胞核质不明显,但牦牛睾丸支持细胞整体存活数目、胞质空泡情况优于犏牛,随着培养时间的延长,细胞存活状态差异越大(图8A~P)。加入0.8 μL 丝裂霉素C(原液浓度10 mmol·L-1)为较优浓度,培养2周后细胞密度未增加,细胞未明显死亡。

从左到右,丝裂霉素C加入量分别为0、0.4、0.8、1.2 μL。A~D. 4种浓度丝裂霉素C处理牦牛睾丸支持细胞7 d后成像;E~H. 4种浓度丝裂霉素C处理犏牛睾丸支持细胞7 d后成像;I~L. 4种浓度丝裂霉素C处理牦牛睾丸支持细胞14 d后成像;M~P. 4种浓度丝裂霉素C处理犏牛睾丸支持细胞14 d后成像
3 讨 论
睾丸支持细胞又称Sertoli细胞,是最重要的生殖相关细胞,是唯一与生精细胞直接接触的体细胞,其在维护睾丸生精环境、保证生精能力方面发挥着重要作用[14]。本试验通过混合酶消化、差速贴壁及饥饿处理分离纯化牦牛与犏牛的睾丸支持细胞,睾丸组织经混合酶消化后,得到睾丸细胞的混合组分,此时进行细胞计数及台盼蓝染色检测细胞活率,发现使用等量的睾丸组织,牦牛睾丸组织消化所获得的细胞量及细胞活率均高于犏牛。混合细胞经差速贴壁及饥饿处理后,细胞呈现多边形或梭形,贴壁生长,与文献报导的羊[15-16]、猪[17-18]、马[19]等种属来源的细胞形态一致。引用文献[15-17, 19-20]中的油红O染色、GATA-4特异标志物的免疫荧光、碱性磷酸酶染色、RT-PCR对支持细胞纯度进行鉴定,发现ALP染色呈现阴性,排除管周细胞的污染[15],油红O染色阳性,GATA-4染色阳性,通过RT-PCR产物电泳结果,发现几乎未检测到间质细胞标志物3β-HSD[21-23]的表达,可进一步确认,所获得的贴壁细胞大部分为睾丸支持细胞。本研究结果显示,使用DMEM高糖培养基更有利于牦牛或犏牛睾丸支持细胞的增殖,DMEM高糖培养基葡萄糖含量高,更适用于培养代谢旺盛的细胞,睾丸支持细胞增殖能力强,按1∶3传代约2 d即可达到95%以上融合度,因此,使用DMEM高糖培养基可能更有利于牦牛或犏牛睾丸支持细胞的增殖。
本研究对比了牦牛与犏牛睾丸支持细胞体外培养条件下的增殖特性及基因表达的差异,CCK8检测显示,牦牛与犏牛支持细胞增殖曲线呈现S型,细胞活性均在培养第5天到达最高,这与已报导的山羊[16]与和田羊[15]的增殖特性相似,同时,无论采用DMEM高糖培养基还是DMEM/F12培养基,犏牛睾丸支持细胞体外增殖的能力及活性远低于牦牛。本研究对两牛种睾丸支持细胞的基因转录水平进行了研究,包括睾丸支持细胞特异标志物基因如GATA-4、SOX9、WT1;睾丸的局部免疫功能调节基因如IL-1a、IL-6、TNF-α、Fas、FasL;分泌蛋白因子调控生精过程相关基因如SCF、BMP4、FGF2、ETV5、GDNF、CXCL12、TGF-β1等[4, 14, 24-26]。发现GDNF、CXCL12、TGF-β1、SOX9和WT1基因在两牛种中的表达存在明显差异。其中,GDNF是维持精原干细胞自我更新和增殖的最重要因子,Aponte等[27]在进行小牛精原干细胞的培养试验中发现,相比其它生长因子,在添加GDNF的培养体系中,A型精原细胞的数量增加最为显著[11],在猪的精原干细胞体外长期培养中[28],也有同样的结论。犏牛睾丸支持细胞低表达GDNF,可能造成精原干细胞的自我更新及增殖受阻,进而出现文献[29]中所述的F1代雄性犏牛睾丸组织中仅有少量精原细胞,无精母细胞和精子细胞等现象。SOX9主要功能体现在调控睾丸支持细胞分化、调控睾丸发育、维持睾丸正常功能,可为发育中的精子提供保护和营养[30],SOX9在犏牛睾丸支持细胞低表达,也是导致犏牛睾丸体积小、发育缺陷的可能原因之一。TGF-β除参与睾丸免疫豁免作用外[24, 26],还可作为细胞增殖的调节因子,调节支持细胞的增殖[31]。本研究也发现,TGF-β1在增殖能力更弱的犏牛睾丸支持细胞中低表达。这些重要基因转录水平的差异也进一步提示了犏牛睾丸支持细胞基因表达转录水平存在缺陷,这也可能是犏牛雄性不育的重要原因之一。
饲养层细胞概念于1955年提出,可为目的细胞生存提供物理空间支持[32],分泌目的细胞所需生长因子[33],睾丸支持细胞也是一种常见的饲养层细胞,广泛应用于精原干细胞的培养[26, 28, 34],睾丸支持细胞经过丝裂霉素C处理后可作为饲养层细胞。当使用同种浓度丝裂霉素C分别处理牦牛与犏牛支持细胞时,发现犏牛支持细胞对药物处理更为敏感,相较于牦牛支持细胞,犏牛支持细胞的细胞形态变化明显,贴壁细胞数目减少,胞质空泡严重,也证明了犏牛睾丸支持细胞的耐受特性不及牦牛,推测牦牛睾丸支持细胞更加适合作为饲养层细胞进行精原干细胞的体外培养。精原干细胞是生精上皮中唯一可复制的多能二倍体细胞,它能将遗传信息传递给后代,是精子发生的基础[35],通过适当的体外培养环境诱导精原干细胞分化,可使其进入减数分裂不同时期,相关的研究在猪[36]、山羊[37]、小鼠[35, 38]等物种中已开展[39],这也是将来研究犏牛雄性不育的一个重要方向。
4 结 论
本研究建立了牦牛与犏牛睾丸支持细胞分离纯化与体外培养方案,经细胞形态及标志基因检测鉴定,成功分离得到牦牛和犏牛睾丸支持细胞;两牛种睾丸支持细胞虽然具有相似的形态特征,但犏牛支持细胞体外增殖能力较差,促睾丸生精细胞发育等关键基因表达丰度较低,对丝裂霉素C耐受特性差,提示犏牛睾丸支持细胞在上述方面的缺陷可能是导致犏牛雄性不育的原因之一。
