异性孪生母牛的可育性鉴别和利用进展
2021-06-30邱清华欧阳克蕙苏华维曹兵海
邱清华,欧阳克蕙,苏华维,曹兵海
(1. 江西农业大学动物科学技术学院 江西省动物营养重点实验室 营养饲料开发工程研究中心 动物营养与饲料安全创新团队,南昌 330045; 2. 中国农业大学动物科技学院 动物营养学国家重点实验室,北京 100193)
异性孪生雌性不育是异卵双胎或多胎后代中雌性个体不具备生育能力的现象[1],在奶牛和肉牛的双胎中比较常见,其后代对应的雌性个体称为异性孪生不育母牛。在过去的几十年里,牛的双胎率不断提高并有逐步增加的趋势,目前在肉牛中为1%左右,荷斯坦奶牛约为5%,部分牧场可高达10%[2-5];据Del Río等[6]报道,荷斯坦异性孪生占双胎比例高达44%,由此推算产生的异性孪生母牛数量也将增加。然而,异性孪生母牛中约有90%不具备繁殖能力,仅有10%左右能正常繁育下一代[7-9]。不育的母牛不但无法繁育下一代和产乳,也不能用于母牛群体遗传性能的改良,对于奶牛养殖业的经济价值不大;然而,若将这部分母牛当作肉牛进行饲养育肥,对于肉牛育肥场而言,能以低价获取育肥牛源;对于奶牛场而言,可以降低单一出售牛奶受市场奶价波动的影响。此外,若能在早期快速、准确地将可育的异性孪生母犊鉴别出来,则可以在出生时甚至胎儿期就做出是否留养用作为后备母牛的决定,这可以在一定程度上减少全部淘汰带来的母牛资源浪费和盲目留养带来后期饲养成本增加的问题。基于以上事实背景,本文重点从异性孪生母牛的可育性鉴别和不育母牛的利用两大方面对国内外近些年的研究做总结和讨论,以期为国内奶牛和肉牛牧场的异性孪生母牛利用和科研开发提供思路。
1 异性孪生母牛不育的形成机理
目前,异性孪生母牛不育的形成机理主要有激素学说和嵌合学说两种解释。激素学说认为,异卵双胎在妊娠2周至30 d雌雄胎儿间绒毛膜发生吻合,性腺发育更早的雄性胎儿分泌的激素(主要是睾酮和抗缪勒氏激素(anti-mullerian hormone, AMH))通过血管吻合支抑制雌性胎儿性腺的正常发育,导致性腺的异常甚至转变[10]。这个学说在近些年的研究中得到部分印证,例如在5岁异性孪生不育母牛中观察到支持细胞持续分泌AMH、间质细胞分泌雄激素,同时也发现体内存在表达AMH和雄激素的细胞和卵巢卵泡膜细胞[11];此外,在雄性激素环境中雌性胎儿的阔韧带(子宫外侧边缘至骨盆壁)发育受到抑制[12],AMH可以介导睾丸的形成[13]。但是激素学说无法解释采用激素无法诱导产生异性孪生不育母牛所有特性的事实[14],也没有证据表明雄激素能使卵巢转变为睾丸,雄激素也不能使副中肾管退化,而副中肾管的退化是异性孪生不育母牛内生殖解剖结构特点之一[15]。
细胞学说认为,雌雄胎儿通过吻合的血管完成细胞系的融合,雌性胎儿体内同时含有XX和XY两种性腺细胞系,形成XX/XY嵌合体[16];同时,包括造血干细胞在内的血液成分在雌雄胎儿间不断交换,形成血细胞嵌合体[17],进而抑制雌性个体后续生殖系统的发育。但是,细胞学说无法解释Szczerbal等[18]报道的5头异性孪生不育母牛体内既不含有异常的染色体核型(60、XX/60、XY),也不含有Y染色体上的特异性基因。
近些年的观点认为,异性孪生母牛不育并不是简单的激素抑制或细胞嵌合导致的,而是细胞(造血干细胞)嵌合和激素(AMH和睾酮)抑制共同作用影响雌性个体性腺的正常发育[7]。但是,两者是如何协调作用来调控性腺的异常发育,目前尚无报道。
2 异性孪生母牛可育性鉴别方法
从异性孪生不育母牛可能的形成机理出发,目前已经开发出一系列的鉴别方法。这些方法是建立在正常单生母牛和异性孪生不育母牛在形态学、内分泌学、免疫学以及细胞分子学上的差异,主要依据异性孪生不育母牛的雄性化形态和内分泌激素异常、XX/XY嵌合体。目前已经开发出临床检查、免疫反应、激素检测、细胞分系和分子检测等鉴别方法,各类鉴别方法列于表1。
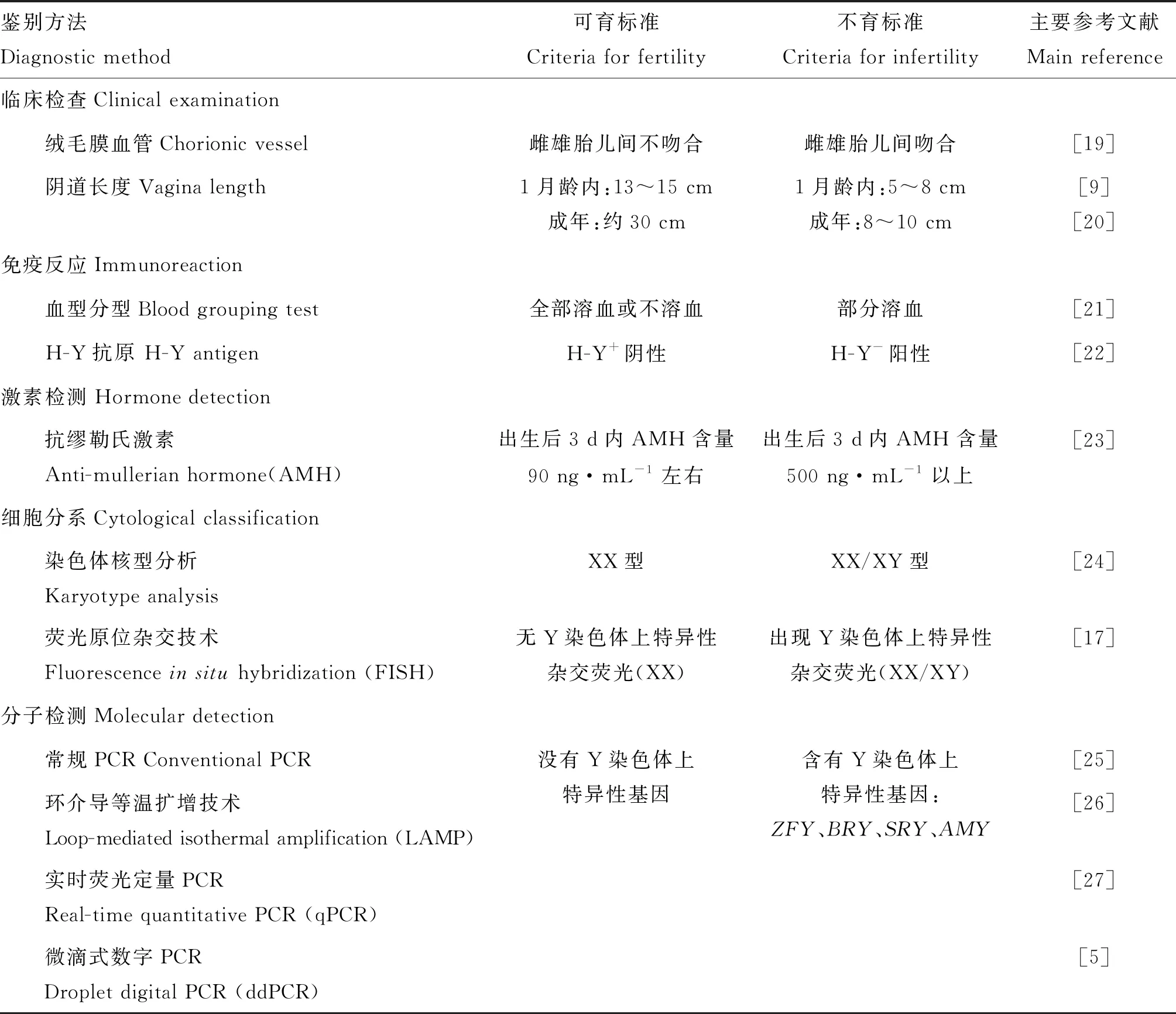
表1 异性孪生母牛可育性鉴别方法
2.1 临床检查
绒毛膜血管是否吻合是临床检查的第一步。不管是激素学说还是嵌合学说,造成异性孪生母牛不育的前提是绒毛膜血管要吻合。因此,若在母牛分娩时雌雄胎儿间的绒毛膜血管吻合,则孪生的母牛判为不育;如果雌雄胎儿间的绒毛膜血管分开,那么该雌性个体鉴别为可育[19]。但是,采用这种方法鉴别的准确度不高,因为导致不育的前提是血管吻合要发生在雌性胎儿的性别分化前[14],在这之后发生吻合引起不育的可能性很低。此外,在妊娠期可能存在雄性胎儿在出生前死亡的情况,这容易忽视双胎和绒毛膜血管是否吻合的检查[18]。
阴道长度测定是临床鉴别中最常用的方法。阴道发育是雌性生殖系统发育的重要组成部分;异性孪生母牛由于在胎儿期性腺发育受到抑制,阴道发育不完全,阴道长度偏短是典型的特征[1],也是容易在体外操作完成的检测指标。出生1个月内正常母犊的阴道长度在13~15 cm,而不育母犊的阴道长度只有5~8 cm;成年正常母牛的阴道长度约为30 cm,而异性孪生不育母牛的阴道长度只有8~10 cm[1, 9]。邵陶祺[20]报道,淘汰出生时阴道长度低于8 cm的异性孪生母犊,其鉴别准确性可达87%。然而,这种方法在实际应用过程中虽然简单易操作,也会出现少部分异性孪生母犊出生时阴道长度高于8 cm但仍不育的情况[20, 26]。这种方法的准确性还需要通过大样本数据来检验,因为阴道长度的测定结果受到测量物形态、操作人员和犊牛月龄的影响,而至今仍没有统一的测量工具和阴道长度随月龄动态变化的数据。
2.2 免疫反应
免疫反应主要有血型分型和H-Y抗原两种,都是基于血管吻合后血细胞或抗原发生交换的理论。一般而言,异卵双胎个体间的血型不一致,当雌雄胎盘间的血管发生吻合后,雌性胎儿就有两种红细胞和两种红细胞抗原。将特定的血型标记物加入到待测样本中后,若待测样本发生了血管吻合则只会出现部分的溶血;而当待测样本没有发生血管吻合时,则要么不发生溶血要么全部溶血[21]。然而,这种方法在应用过程中往往不能得到准确的结果,限制因素包括对溶血程度的判读以及溶血与否和红细胞的处理相关[10]。此外,该方法仅适用于红细胞表面抗原已经成熟(通常为1月龄以上)母牛的鉴别[21],这使得血型分型法无法用于异性孪生母牛的早期鉴别。
组织相容性抗原Y(histocompatibility antigen Y, H-Y)之前被认为是雄性哺乳动物细胞表面特有的蛋白质,由睾丸组织分泌[28]。Wachtel等[22]发现,卵巢细胞暴露于雄性或者异性孪生不育雌性胎儿血清后表现为H-Y+阳性,而暴露在正常雌性胎儿中则为H-Y-阴性。因此,理论上若待测样品的H-Y抗原为阳性,则可判定该异性孪生母牛为不育;若为阴性,则可判定为可育。然而,H-Y抗原只是睾丸形成过程中支持细胞分泌的产物,并不能决定睾丸是否能够形成[28]。Qiu等[27]报道,正常雌性个体血清中也能检测到H-Y抗原的存在,且与异性孪生可育和不育母牛间均没有显著差异。在人类女性的研究中发现,在XX/XY嵌合和XX真两性个体体内均能检测到H-Y抗原的存在,血液中H-Y抗原的存在不会抑制卵巢的发育[29]。以上理论和实践应用上的数据表明,采用H-Y抗原定性或者定量的方法并不能很好地鉴别异性孪生母牛的可育性。
2.3 激素测定
异性孪生不育母牛的性腺发育不良,主要表现为卵巢萎缩、阴道和子宫发育不全及不同程度的雄性化[10]。成年异性孪生不育母牛日常行为也与雄性类似,表现出好斗的特性[11]。从激素学说中的胎儿期发生激素渗透,结合异常的性腺发育和日常行为,推测内分泌激素应该和同月龄正常母牛有差异。Libera和Szczerbal[30]在临床案例中报道,异性孪生不育母牛的孕酮(小于0.2 ng·mL-1)水平低于正常母牛。然而,Rota等[23]的研究发现,正常雄性个体3月龄 前血浆睾酮含量与同月龄正常雌性个体、异性孪生不育母牛之间并没有显著差异,只在5月龄后(大于1 ng·mL-1)含量高于后两者(低于0.4 ng·mL-1),而正常母牛和异性孪生不育母牛从出生到10月龄均没有表现出显著差异;此外,正常母牛和异性孪生不育母牛在性成熟前的孕酮含量相似(均低于0.4 ng·mL-1)。因此,睾酮和孕酮含量并不能用于早期鉴定,两者的含量可以作为诊断的辅助指标。异性孪生不育母牛血浆中AMH在出生前3 d的含量(大于500 ng·mL-1)高于正常母牛(约90 ng·mL-1),而在第9天以后,两者在AMH含量上并无显著差异[23]。在山羊中的研究中也发现,AMH含量容易受到年龄的影响,成年异性孪生不育山羊血清中AMH含量(0.2 ng·mL-1)与正常雄性类似,低于正常雌性(0.6 ng·mL-1)的含量[31]。由此看来,AMH可用于早期鉴别,但时间仅限于出生后3 d内。然而,由于激素的测定方法和试剂标准很难一致,采用激素法鉴别时无法准确将激素浓度区分值定量;即使是采用同一生理时期的正常母牛作对照,采用多大的浓度值差异作为可育性的界限判定仍是难题。
2.4 细胞分系
雌雄个体在胎儿期血管吻合后发生细胞系的交换,体内含有XX和XY两种细胞系,这种嵌合的特性不会随着年龄消失[10]。通过培养待测母牛体组织的白细胞,鉴定中期细胞的核型,若同时存在XX和XY两种细胞系则为不育,只存在XX这一种细胞系则是可育的。在细胞培养的过程中,并不是所有类型的细胞都能用作鉴别,对13月龄异性孪生不育母牛的淋巴细胞培养后发现了60, XX和60, XY两种细胞系,而在成纤维细胞中却只发现60, XX这一种细胞系[30]。染色体核型鉴别的准确性较高,但由于嵌合程度不一样,对于XY细胞数小于1%的个体很难准确检出[26]。为了提高准确度就要提高样本数量,要达到95%和99%的置信度,所需的最少细胞中期数量分别为26和168[24],这无疑增加了时间和人力成本。同时,依赖于细胞培养这项技术对样品和操作的高要求[10],例如无菌、运输储存温度和保存时间,这在一定程度上限制了染色体核型检测在异性孪生母牛可育性鉴别中的广泛应用。
二十世纪八十年代末发展起来的荧光原位杂交技术(fluorescenceinsituhybridization, FISH)解决了染色体核型分析所需劳动力和时间成本高的问题。Sohn等[17]对异性孪生母牛血液的中期和间期淋巴细胞采用牛Y染色体上特异性的DNA探针进行荧光原位杂交,结果发现,杂交结果与染色体核型分析得出的XY与XX细胞比例非常相似,说明该DNA探针(包含Y染色体上特异性的BC1.2序列)的FISH能用于异性孪生母牛的快速和准确鉴别。与染色体核型分析相比,FISH由于使用的是特异性的探针并且是根据荧光信号来判断结果,其结果受人为主观判断的影响较小,检测速度和重复性也较高。然而,采用FISH进行鉴别的一个很突出的问题是探针的选择,这关系到检测结果的可信度,而哪些特异性的染色体序列可以用作FISH的探针仍是需要解决的问题[17]。
2.5 分子诊断
聚合酶链式反应(polymerase chain reaction, PCR)技术的快速发展给性别鉴定带来深远影响的同时,也为异性孪生母牛可育性的鉴别提供了思路。通过检测样本组织中是否含有Y染色体上的特异性基因或者片段,可以达到鉴定可育性的目的。目前围绕这一原理,检测的Y染色体上特异性基因主要包括锌指蛋白Y(ZFY[25])、釉原蛋白Y(AMY[32])、牛Y染色体区域基因(BRY[33])和Y染色体性别决定基因(SRY[15, 34])。应用的技术包括常规PCR[33]、环介导等温扩增技术(loop-mediated isothermal amplification, LAMP)[26]、实时荧光定量核酸扩增技术(real-time quantitative PCR, QPCR)[27, 35]以及微滴式数字PCR(droplet digital PCR, ddPCR)[5],实现了对Y染色体特定片段或基因的定性分析到定量检测。
最早应用在异性孪生母牛可育性鉴别的分子技术是常规PCR。提取全血中的DNA后,采用PCR技术对Y染色体上的特异性基因(目标基因BRY)和内标基因(微卫星1.709)进行扩增,若样本扩增后同时出现目标基因和内标基因产物的条带,则判定为不育;若只出现内标基因条带,则鉴定为可育。该方法的鉴别灵敏度为2.5%XY细胞,并可利用在4 ℃ 保存1个月以上的样本进行检测[33]。然而,Qiu等[27]的研究发现,常规PCR在鉴定低嵌合程度异性孪生母牛可育性的过程中容易出现假阴性,仅凭有无目标条带判断的准确性仍需大样本来检验。
LAMP是本世纪初开发出的一种恒温扩增核酸方法,扩增后的特异性DNA产物呈白色沉淀,可通过浑浊度来检测[36];该技术无需特殊试剂和专门仪器设备,后续产物也不需要通过电泳来识别,常用于动物胚胎的性别鉴定,目前已开发出便于生产上使用的试剂盒[37]。Hirayama等[26]采用氢氧化钠碱处理异性孪生母牛外周血的方法获取DNA后,在63 ℃ 恒温扩增35 min后即可进行浑浊度测量,若浑浊度高于0.20,则判定为嵌合体不育;而当浑浊度低于0.20时,则是非嵌合体的可育;与染色体核型分析和PCR鉴别方法对比后发现,这3种方法的鉴别结果是一致的,LAMP在检测灵敏度(0.01%的XY白细胞)和操作便捷性(全过程1 h内完成)上分别优于染色体核型分析和常规PCR[26, 37]。
qPCR是在PCR反应体系中加入探针或者荧光染料,借助荧光信号实现反应过程的实时监控和连续性分析,不仅可以对样品进行定性分析,还可以实现相对定量和绝对定量。Artigas等[35]采用qPCR扩增牛BRY4基因,获得特异性的荧光曲线,并通过待测样本是否含有该特征荧光曲线来判断不育和可育。Qiu等[27]采用qPCR扩增Y染色体上的特异性基因SRY实现了对异性孪生母牛体内SRY基因含量的相对定量,该方法在特定仪器上可直接读取,简单易操作且灵敏度高(0.09%),解决了Mcniel等[32]在使用常规PCR遇到的无法检测出XY细胞数低于0.2%的难题。
ddPCR是第三代PCR,在扩增前将样品进行微滴化处理并在扩增后对微滴直接检测,该方法突破了传统扩增技术无法检测低丰度的局限性,相较于qPCR采用阈值和校准曲线,ddPCR可以实现对样品含量的直接定量[5]。目前,该项技术已经用于猪[38]和牛[5]异性孪生雌性个体可育性的鉴定。采用ddPCR技术对牛AMX和AMY扩增试验发现,该方法可检测到低至3%的细胞系;该方法快速可靠,成本约为细胞检测的1/4[5]。
以上鉴别方法中,没有一种能兼具准确性和低成本。笔者推荐的检测程序是外部临床检查(简单成本低)与分子检测(准确性高)结合,即根据出生时绒毛膜血管是否吻合和阴道长度进行初步筛选,对于不确定的个体,采集血液返回实验室进行分子水平上的进一步诊断。
3 异性孪生不育母牛的利用
3.1 种用或育肥
经过鉴别认定为可育的母牛可以留养当作后备母牛饲养,但可育母牛的繁殖性能和生产性能以及后代特性仍缺乏数据;鉴定为不可育的异性孪生母牛可直接淘汰或者当作肉牛饲养。目前,探究不可育异性孪生母牛育肥特性的研究较少。He等[39]对异性孪生不育母牛在营养物质消化和代谢上的研究发现,补充长链脂肪酸钙盐可以提高营养物质的表观消化率和血浆胆固醇及低密度脂蛋白胆固醇浓度并减少氮留存,补充苜蓿会对瘤胃发酵和部分瘤胃微生物的组成造成影响。国外研究表明,异性孪生不育母牛在生长和胴体性能上类似甚至优于单生和双生正常母牛,例如,育肥全期的日增重与正常双生牛没有显著差异(843 g·d-1vs.838 g·d-1),而初生重(37.6 kg)高于正常双生牛(35.2 kg),大理石花纹评分(6.30vs.5.47)和牛肉产量等级(2.57vs.2.17)均高于正常双生牛[40]。Parker等[41]的研究发现,异性孪生不育母牛和同性孪生母牛的生长性能和胴体特性类似,但在大理石花纹评分上前者有高于后者的趋势。虽然在各个生长育肥阶段单生牛的活体重、干物质采食量和每公斤增重成本要高于双胎牛,但是在增长速度上两者并无显著差异[42]。
3.2 动物模型
3.2.1 器官移植 异性孪生是一种独特的自然联体共生,异性孪生母牛的存在为繁殖生物学、移植生物学和自身免疫疾病的耐受性提供了研究模型[43]。自1945年Owen[44]发现异性孪生公牛和母牛间的血管吻合并且存在红细胞嵌合后,采用造血干细胞嵌合诱导产生获得性免疫耐受能力的思路就应用在器官移植中。目前,已广泛应用在实体器官移植上的耐受性有操作耐受性和删除耐受性,前者是在没有产生嵌合的情况能稳定产生1年以上的免疫抑制耐受性,后者为需要持续的供体造血细胞作为抗原来源的耐受性[45]。异性孪生母牛嵌合性提供的是删除耐受性的思路,然而,在人主要组织相容性复合体中诱导产生持续的嵌合很困难,主要是因为要想通过嵌合诱导耐受性不仅需要多血统血液同时嵌合和长期的外周调节机制,还存在着器官的特异性,目前表现为肾和肺可行,但心的移植耐受不可行[46]。为此,Oura等[46]提出,通过瞬时混合的嵌合方法来诱导产生耐受性,该方法最大的优点是不会诱发移植物抗宿主病。利用异性孪生这种体内耐受性还可以通过囊胚互补实现完整器官在受体内的生成,这要求供体多能干细胞在胚胎植入前就迁移到受体宿主内,利用嵌合体强大的生成能力发育成供体的目标器官[47]。
3.2.2 性腺发育 异性孪生胎儿血管吻合后同时在相同或者类似激素水平刺激下发育,这种自然状态下的激素-神经-性腺发育调控系统可以作为研究脑调控性别分化的动物模型[48-49]。Graïc等[49]的研究发现,异性孪生不育母牛下丘脑视交叉上核比雄性大32.5%,而加压素和含有催产素的神经核介于正常雄性和雌性之间,这说明雄性激素对大脑的发育在胎儿期就存在组织效应。目前,Corain等[48]已开发出计量分析小脑细胞形态的方法,并将该方法应用于正常公牛和母牛及异性孪生母牛来研究性别二态性。Montelli等[50]报道,与同年龄的公牛相比,异性孪生不育母牛小脑中的颗粒细胞形态值更大。Rizzo等[51]发现,α-甲胎蛋白不与睾酮结合,可直接跨越血脑屏障影响下丘脑的发育和调节,进而影响性别分化。这部分研究表明,异性孪生母牛性腺异常发育是激素和神经综合调控的结果,可以将异性孪生母牛作为研究激素通过神经影响性腺发育机理的动物模型。
3.2.3 双胎输血综合征 双胎输血综合征是人类多胎妊娠中一个极具挑战的临床问题,在单绒毛膜双羊膜囊妊娠中的发病率为10%~20%,出现该问题如果不加以治疗,死亡率高达80%~100%[52-54]。该症状是由于胎盘血管吻合后胎儿间血流发展不平衡导致其中一个胎儿的血液过多地流向了另外一个胎儿,造成器官衰竭甚至死亡[1,55-56]。而在异性孪生母牛中,雌雄胎儿间的血流在血管吻合的情况下依然发展平衡。在人类的异性双胎中,含有46, XX/46, XY嵌合体的女性个体却没有表现出像异性孪生不育母牛那样的异常性腺器官和不育性[57]。以上现象说明,牛和人的双胎间发生血管吻合后带来的致病效应不一样,这可能是血管吻合类型、时间和强度不同所导致的,对异性孪生母牛血管吻合机制的深入研究有助于为双胎输血综合征的预防和治疗提供思路。
4 未来研究方向与展望
异性孪生母牛可育性的鉴别方法逐步准确、高效和早期化,这与高速发展的细胞分子技术和对异性孪生这种现象的认识不断加强密切相关。从最初的临床经验检查到细胞培养和内分泌激素检测,再到二十世纪末的分子扩增以及二十一世纪新发展起来的分子杂交及新一代扩增技术,见证了鉴别过程中的经验判断、定性分析和定量检测的发展,同时也推动着人们对这一现象认识的加深和应用。笔者认为,在今后,有3大有潜力的研究方向。
一是异性孪生不育母牛激素水平和嵌合程度以及雄性化程度的关联性分析。围绕目前较为成熟的激素学说和嵌合学说,仍存在需要进一步解释的问题。Remnant等[11]在成年母牛中发现黄体但没有可见的卵泡或卵母细胞,AMH的存在会影响子宫的正常发育和卵泡的形成;同时,本世纪初已有理论提出,异常严重程度与雌雄胎儿间的血管吻合程度、暴露在激素中的起始时间和持续时间相关[12],但是激素通过怎样的调节机制导致了雌性个体不同程度的雄性化,以及通过激素调控后的雄性化与细胞学说中的嵌合程度之间的关联性仍需要进一步明晰。许多报道发现,异性孪生母牛的嵌合比例从0%到96%不等[5, 58],并且迁移过去的细胞异常频率增加[58]。Ciotola等[59]在探究染色体脆性的试验中也发现,异性孪生不育母牛的非整倍性细胞比例和染色单体断裂均显著高于单生正常的公牛或者母牛,Kochneva等[58]在异性孪生母牛中也观察到了类似的X染色体脆性增强现象。然而,XX/XY比例和雄性化程度无关[7],这使得通过细胞手段检测的染色体嵌合比例和分子手段检测的基因嵌合率都不能与雄性化直接关联起来。
二是从嵌合组织和嵌合时间结合细胞分子学以及内分泌学认识嵌合的本质。Young和Kirkpatrick[60]的研究发现,血液淋巴细胞嵌合的特性不会随着年龄改变,雌雄胎儿间嵌合关联性与嵌合程度相关:当交换比例高于45%时,雌雄胎儿间的嵌合比例呈显著负相关;而当交换比例小于45%时,雌雄胎儿间嵌合比例没有显著相关性。Biswas等[61]在四胞胎(组成为3雌性和1雄性)中发现,胎儿间均存在嵌合且嵌合的比例(均低于15%)类似,这说明嵌合比例与胎儿中的性别组成相关。异性孪生母牛的嵌合只发生在局部组织,并不是全身性的嵌合,目前在牛的血液[13]和鼻黏膜[62]中均能检测到XX/XY嵌合体的存在,在毛囊和皮肤中却无法检测到嵌合体[13, 60]。Torres等[63]的研究发现,异性孪生胎儿在胚胎发育过程中,基因交换会发生在生殖结节。以上研究均是针对特定组织在特定生理时期得出的嵌合特性,同一组织在不同时间或者不同组织在同一时间的嵌合特性目前仍不清楚。因此,有必要比较不同组织在不同时期的嵌合程度,来确定能用于早期快速准确鉴别的组织,同时也可以结合细胞和分子手段进一步认识嵌合的本质和可能的途径。
三是异性孪生可育母牛可以作为免疫耐受性研究的动物模型。异性孪生母牛中仍有5%~15%具备繁殖能力,Qiu等[27]报道了2头异性孪生可育母牛体内仍有较低的SRY含量,嵌合程度和繁殖能力之间的关联性仍需要深入探究。此外,这部分可育母牛具有的免疫耐受性预示着机体内有一套强大的抵御机制,揭示可育的这部分异性孪生母牛的耐受机制有助于人体免疫移植和双胎输血综合征的预防和治疗。
