电化学脱嵌法盐湖提锂电极反应动力学研究
2021-06-30徐文华刘冬福何利华刘旭恒赵中伟
徐文华,刘冬福,何利华,刘旭恒,赵中伟
(中南大学冶金与环境学院,湖南长沙410083)
引 言
近年来,随着新能源汽车领域和储能行业的快速发展,锂的需求量激增[1-3]。碳酸锂作为一种重要的锂盐产品,已被广泛应用于新能源汽车领域[4-5]。目前,碳酸锂主要来自矿石提锂与盐湖提锂。相比于矿石提锂,盐湖卤水中的锂储量巨大(占世界总锂储量的65%)[6-8]。从盐湖卤水中提锂不仅避免了矿物浸出提锂过程中大量试剂的消耗,而且在成本上具有更大的优势,盐湖提锂将成为锂盐生产的主要方向[9]。
镁锂分离是盐湖提锂过程中一个主要的技术难题。我国锂资源储量居世界第三(其中80%赋存于盐湖卤水中),但我国大多数盐湖卤水都是高镁锂比卤水,难以高效开发。针对高镁锂比盐湖卤水提锂的难题,研究人员开发了吸附法[10-13]、电渗析法[14-16]、纳滤法[17-18]、萃取法[19-20]等多种工艺技术。吸附法所用吸附材料主要有氧化铝系吸附剂、锰系离子筛以及钛系离子筛。其中,铝系吸附剂主要利用吸附材料对LiCl分子的特异性吸附实现锂的提取,锰系离子筛以及钛系离子筛则利用二者的离子筛效应实现锂离子的选择性吸附。但目前吸附法仍然面临造粒后吸附容量偏低,部分离子筛材料在酸解吸过程中存在材料溶损的问题。
针对吸附法存在的问题,本文提出了一种基于“摇椅式”锂离子电池工作原理的提锂新方法——电化学脱嵌法[21-27]。该技术以富锂态的锂电材料为阳极,以欠锂态的锂电材料为阴极,构筑了“富锂态电极材料(阳极)│支持电解质│阴离子膜│卤水│欠锂态电极材料(阴极)”电化学脱嵌法盐湖提锂新体系。磷酸铁锂在LiCl、NaCl、KCl和MgCl2溶液中的循环伏安结果表明,离子半径较小的Na+,Mg2+可嵌入磷酸铁锂中,离子半径较大的K+则不嵌入磷酸铁锂。通过合理控制电位,可实现高镁锂比盐湖卤水中锂与杂质离子(K+,Na+和Mg2+)的分离。循环性能测试表明,50周期循环后材料的吸附容量保持在初始容量的83%。同时一些研究人员探索了磷酸铁锂从地热卤水(Li 25.78 mg/L)和海水(Li 0.18 mg/L)中进行提锂的可行性[28-29]。实验表明,地热卤水中锂的回收率可以达到90.65%,而海水中的锂钠分离系数则高达1.8×104,以上结果证明磷酸铁锂材料对锂具有优异的选择性。继磷酸铁锂材料成功用于盐湖提锂之后,研究人员开始着力开发可用于卤水提锂的其他先进电极材料及其组合系统。其中,锂离子扩散系数更大的LiMn2O4引起了研究人员的广泛关注。Yuan等[30]研究了LiMn2O4/Li1-xMn2O4体系从盐湖卤水中提锂的行为,相关结果表明,该体系锂镁分离系数可达70,能有效实现卤水中锂镁的分离。Yu等[31]对提锂过程中Li、Na、K、Ca、Mg的行为进行了相关研究,证明了在0.3~1.2 V的电位范围内无杂质离子嵌入锰酸锂材料中,通过控制电位成功实现了锂的选择性嵌入。
目前,大量的电化学脱嵌法盐湖提锂研究主要集中在不同电极材料在卤水提锂过程中的应用效果。即对电化学脱嵌法提锂过程中所涉及的电极材料对锂的吸附性能、竞争阳离子在提锂体系中的吸附行为、材料的循环稳定性等方面进行了研究。这些研究虽然拓展了电化学脱嵌法从卤水中回收锂的相关知识,但是却未探明提锂过程中的速控步骤。而对实际生产过程而言,新技术提锂速率的快慢直接关系到实际过程的生产效率和成本。因此,对该过程进行反应动力学研究,确定反应过程的限制步骤,并就限制环节做针对性的改善,对提高生产效率、降低生产成本等具有重要研究价值。
鉴于此,本文通过考察槽电压、反应温度、电解液锂浓度以及吸附材料涂覆密度等主要因素对提锂速率的影响,以相关动力学模型对提锂结果进行拟合,分析找到提锂过程的控制步骤,为如何加快反应速度提供理论指导。
1 实验材料和方法
1.1 实验材料与实验过程
1.1.1 原料 本实验所用LiFePO4为自行合成,除N-甲基吡咯烷酮(NMP,99.9%,Aladdin),导电炭黑(Super P,Timal),聚偏二氟乙烯(PVDF,Solef 5130,America)外,其 他 试 剂(LiCl、Li2CO3、NH4H2PO4、Fe2O3、C6H12O6·H2O)均为国药集团生产的分析纯试剂。
1.1.2 LiFePO4的合成 按化学计量比称取Li2CO3、NH4H2PO4、Fe2O3倒入行星式磨机,同时加入Li2CO3质量60%的C6H12O6·H2O作为碳源,加入乙醇充分研磨6 h,将混合均匀的浆料置于真空烘箱中,并于90℃干燥12 h;将烘干所得前体置于瓷舟中,并在氩气保护气氛下用管式炉进行两段处理:第一段400℃处理2 h,第二段650℃煅烧10 h,煅烧后即得LiFePO4产品。
1.1.3 LiFePO4电极的制备 将LiFePO4、PVDF和导电炭黑按质量比8∶1∶1混合,并以N-甲基吡咯烷酮为溶剂,充分研磨调浆后均匀涂覆在集流体上(浆料涂覆面积1 cm×1 cm),然后于真空干燥箱中保持90℃干燥12 h。
1.1.4 FePO4电极的制备 以制备好的LiFePO4电极为阳极,泡沫镍为阴极,1.0 mol/LNaCl为支持电解质,在1.0 V直流电压下电解脱锂直至电流低于2 mA/g。
1.1.5 分析检测 元素含量和电极形貌分别采用电感耦合等离子体光谱仪(ICP-OES,Thermo Scientific iCAP-7200)和扫描电子显微镜(SEM,JEOL JSM-6490LV)进行检测;直流电源采用CT2001A(武汉市蓝电电子股份有限公司)。
1.2 实验装置示意图及动力学模型
本次动力学模拟所用的电化学提锂装置简图如图1(a)所示,制备的LiFePO4电极表面SEM形貌如图1(b)所示。从图1(b)可以看出,在电极材料表面分布有1μm宽度的微裂纹。这些微裂纹主要是浆料烘干过程中溶剂(N-甲基吡咯烷酮)的挥发所致,裂纹的产生会在一定程度上降低电极的强度,严重时会使得电极在长时间循环过程中脱落。但在本次动力学研究中,所用电极无须长时间循环使用,在实验过程中未出现涂层脱落问题,因此本实验过程中产生的一些微小裂纹不影响实验的研究。

图1 电化学提锂装置简图(a),电极表面形貌(b)Fig.1 Sketch of the lithiumextraction process(a),SEM image of the electrode(b)
根据电极材料涂覆层的紧密程度以及溶液往电极的传质效果,假定存在图2所示两种反应情形:(1)溶液在电极内的扩散较快,电极内部各处离子浓度基本保持不变,以球形近似表示磷酸铁锂颗粒,则提锂反应可采用收缩核模型的球形模型进行描述[图2(a)];(2)溶液在电极内部的扩散较慢,电极反应从电极表面依次反应到电极内部,则提锂反应可采用收缩核模型的平板模型进行描述[图2(b)]。对于两种模型均存在以下两种情况:(1)电化学反应速率远快于溶液在电极内部的扩散速率,反应容易受外扩散控制;(2)溶液在电极涂覆层内部的扩散速率远大于化学反应的速率,则反应可能受颗粒内扩散控制或化学反应控制。因此,在未知溶液传质效果的前提下,这两种情况都有可能发生,球形收缩核模型和平板收缩核模型的具体模型方程式如表1所示[32-34]。
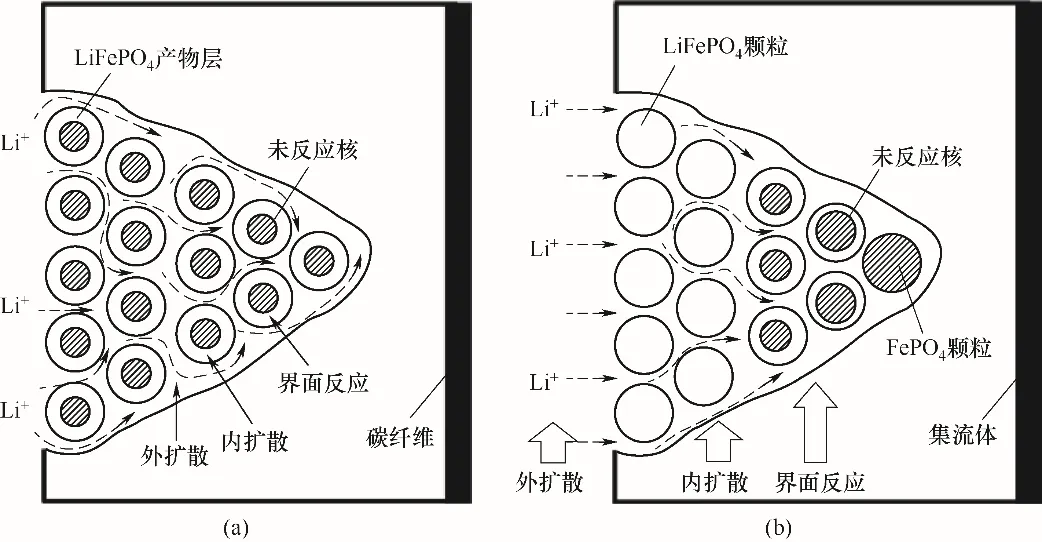
图2 球形收缩核模型(a),平板收缩核模型(b)Fig.2 Spherical shrinking nucleus model(a),flat shrinking nucleus model(b)

表1 动力学反应模型及动力学方程Table 1 Kinetic reaction models and kinetic equations
2 结果与讨论
2.1 槽电压对提锂过程的影响
图3所示为电极涂覆密度为27 mg/cm2、反应温度为30℃、电解液的锂浓度为0.4 mol/L时,不同槽电压对锂吸附容量的影响。从图3可知,随着槽电压的升高,电极材料对锂的吸附速率及吸附容量均有所提升。当槽电压为0.04 V时,25 h材料对锂的吸附容量为27 mg/g。当槽电压升高至0.06 V时,仅电解13 h锂的吸附容量就可以达到32 mg/g;继续升高电压至0.1 V时,8 h后吸附容量就达到34 mg/g。由此可知,在确保杂质阳离子的竞争能力不大的情况下,适当提高槽电压有利于加快反应速度。

图3 槽电压对锂吸附容量的影响Fig.3 Effect of cell voltage on the lithium adsorption capacity
利用表1所列动力学方程对图3结果进行拟合,所得拟合结果如图4所示。对比四种拟合结果可以看出,随着槽电压的升高,采用化学反应控制进行拟合[图4(a)、(c)]所得结果的相关性越来越低,而采用内扩散控制进行拟合[图4(b)、(d)]所得结果的相关性越来越高,说明随着槽电压的升高,提锂反应的控制步骤逐渐由化学反应控制向内扩散控制转变。
通过对比拟合结果可知,当槽电压低于0.06 V时,采用球形收缩核模型化学反应控制[图4(a)]拟合效果较好(R2≥0.99),而当电压高于0.06 V时,采用平板收缩核模型内扩散控制[图4(d)]拟合较好。这主要是因为槽压对化学反应速率有很大影响,槽压较低时,化学反应速率较慢,溶液中的Li+可以及时补充电极内部消耗的锂,反应受化学反应控制;而当电压进一步升高时,反应速率加快,未反应颗粒界面的Li+被迅速消耗,以至于本体溶液中的锂不能及时补充电极内部消耗的锂,反应受内扩散控制。

图4 不同槽电压条件下电化学提锂动力学方程的拟合曲线Fig.4 Fitting curves of variouskinetic equations under different cell voltage
基于以上所得实验结果,确定槽电压为0.1 V进行后续相关实验,此时反应控制步骤为内扩散控制。为了进一步提升化学反应速度,关键是提升锂离子在电极材料内部的扩散。根据表1所列平板收缩核模型内扩散控制的方程可知,有效的改进措施有:(1)提高Li+的扩散系数D1(升温);(2)提高溶液锂浓度C0;(3)减小涂覆材料厚度l0。后面将针对温度、锂浓度及涂覆材料厚度对提锂过程进行探究。
2.2 温度对锂吸附容量的影响
图5所示槽电压为0.1 V、溶液锂浓度为0.4 mol/L、电极涂覆密度为22 mg/cm2时,不同温度对锂吸附容量的影响。由图5可知,随着温度的升高,电极材料对锂的吸附容量和吸附速率均有显著提高。10℃时反应5.5 h的吸附容量仅有25 mg/g;而50℃条件下,3 h锂的吸附容量就达到32 mg/g。
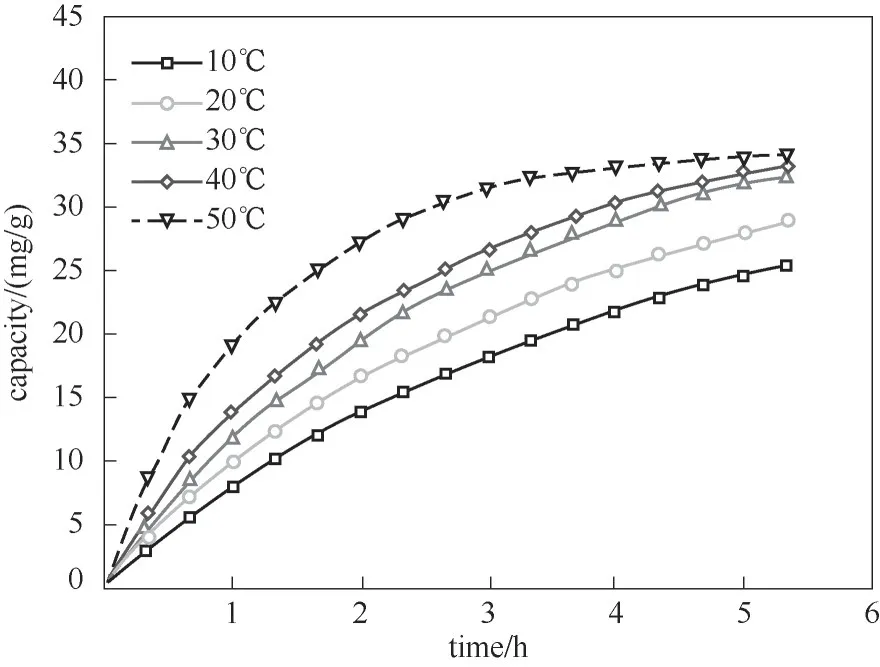
图5 温度对锂吸附容量的影响Fig.5 Effect of temperature on the lithiumadsorption capacity
利用表1所列动力学方程对图5结果进行拟合,所得拟合结果如图6所示。由图6可知,随着温度的升高,采用化学反应控制动力学方程拟合的结果越来越差[图6(a)、(c)],而采用内扩散控制动力学方程拟合的结果则越来越好[图6(b)、(d)]。这说明温度越高,Li+离子的扩散速率相比于化学反应的速率也越来越慢,整个提锂速率受限于Li+的内扩散。

图6 不同温度条件下电化学提锂动力学方程的拟合曲线Fig.6 Fitting curves of various kinetic equations under different reaction temperature
另外,采用平板收缩核模型内扩散控制动力学方程拟合的结果要优于球形收缩核模型内扩散控制动力学方程拟合的结果,说明溶液往电极内部的扩散速度缓慢,电极内部各层的溶液并不能采用同一浓度处理。
2.3 锂浓度对锂吸附容量的影响
图7所示为槽电压0.1 V、温度30℃、电极材料涂覆密度为27 mg/cm2时不同锂浓度对吸附容量的影响。由图7可知,锂浓度升高时,吸附速率明显加快。当锂浓度为0.1 mol/L时,8 h锂的吸附容量为26.8 mg/g,而当锂浓度增加到0.6 mol/L时,3.33 h锂的吸附容量就已经达到26.2 mg/g。

图7 锂浓度对锂吸附容量的影响Fig.7 Effect of lithiumconcentration on the lithium adsorption capacity
同理,利用表1所列相关动力学方程对图7所示结果进行拟合,所得拟合结果如图8所示。由图8可知,不同锂浓度条件下拟合所得动力学方程同样符合平板收缩核模型内扩散控制,其相关系数R2>0.99。上述结果表明,在实验锂浓度范围内,提锂过程的速控步骤为Li+在电极材料中的内扩散。
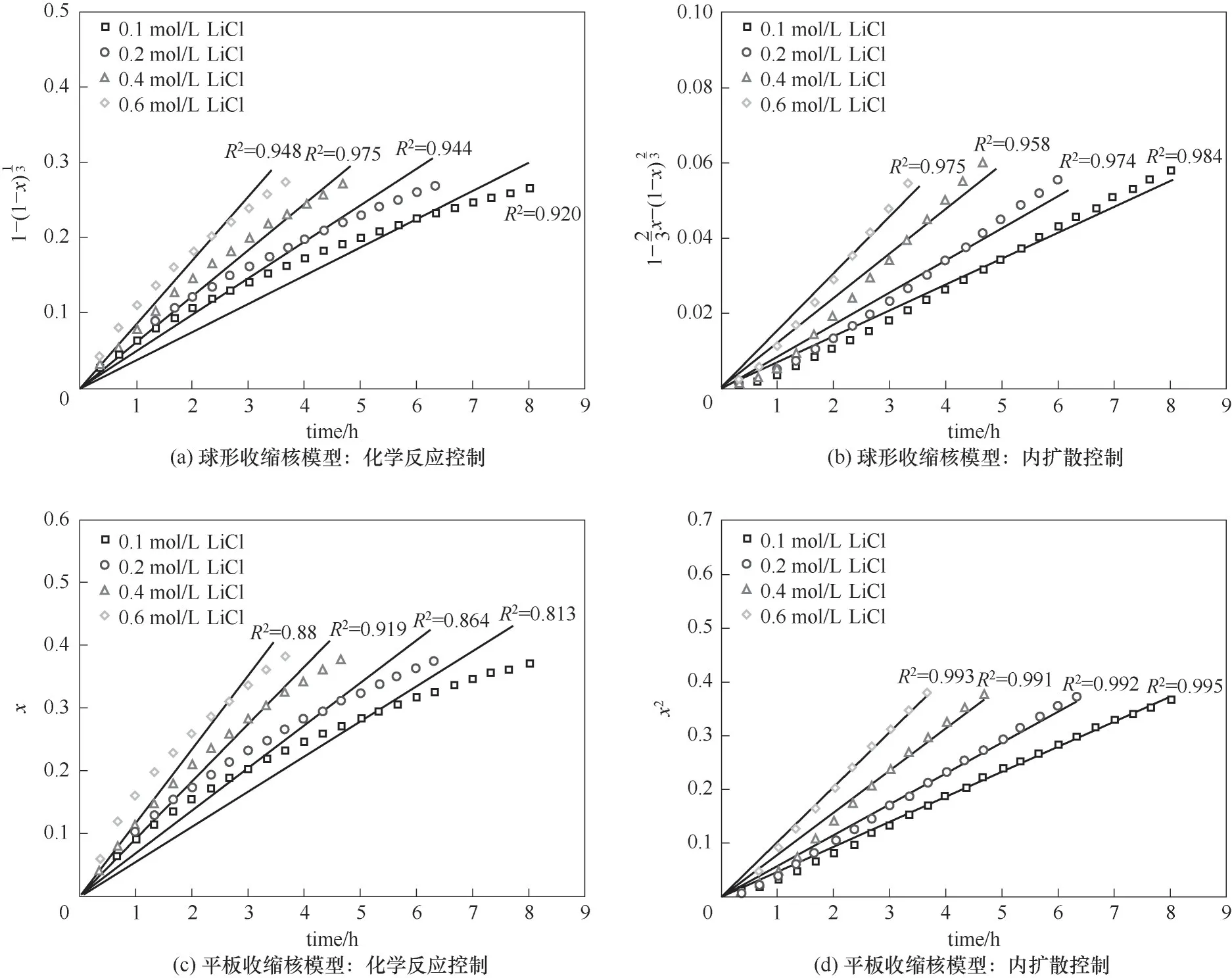
图8 不同锂浓度条件下电化学提锂动力学方程的拟合曲线Fig.8 Fitting curves of various kinetic equations under different lithium concentration
需要指出的是,我国大部分地区的原始卤水中的锂浓度范围为0.1~1.5 g/L,摊晒后所得盐湖老卤中的锂浓度范围为0.2~5 g/L,本次实验所取锂浓度范围基本涵盖了卤水锂浓度的范围。因此,采用本工艺进行锂的提取,其速控步骤仍然是平板收缩核模型内扩散控制。
2.4 电极材料涂覆密度对锂吸附容量的影响
图9所示为槽电压0.1 V,温度30℃,溶液锂浓度为0.4 mol/L,不同涂覆密度对吸附容量的影响。由图9可知,增大涂覆密度会导致吸附时长的增加,对吸附容量的大小无明显影响。当涂覆密度为16 mg/cm2时,3.33 h锂的吸附容量可达33.3 mg/g,而当涂覆密度增加到30 mg/cm2时,吸附容量达33.1 mg/g需耗时7.33 h。以上结果表明,当涂覆的电极材料较厚时,提锂过程很可能是由电极表面逐渐反应到电极内部,电极材料越厚,反应所需时间越长,这与平板收缩核模型非常吻合。

图9 电极材料涂覆密度对锂吸附容量的影响Fig.9 Effect of coating density of electrode materials on the lithiumadsorption capacity
利用表1的相关动力学方程对图9所得结果进行拟合,拟合效果如图10所示。由图10可知,拟合结果符合内扩散控制动力学方程,同时,当涂覆密度较低时(16 mg/cm2),采用球形收缩核模型内扩散控制拟合比平板收缩核模型内扩散控制拟合效果更好,而当涂覆密度进一步增大时,采用平板收缩核模型内扩散控制的拟合效果更优。

图10 不同电极材料涂覆密度下电化学提锂动力学方程的拟合曲线Fig.10 Fitting curves of various kinetic equations under different coating density
尽管采用较小的涂覆密度的电极进行工作可以更快地完成吸附过程,但是过低的涂覆密度会造成电极电流密度的下降。因此,提高单位面积产能的关键之一就是提高锂离子在电极材料内部的传质。
综上,不同温度、锂浓度以及涂覆密度下拟合所得动力学方程见表2。

表2 不同温度、锂浓度和涂覆密度下所得动力学方程Table 2 Kinetic equations under different temperature,Li+concentration and coating density
2.5 动力学方程的建立
综上可知,适当提高槽电压可以加快反应速率,同时使提锂过程由球形收缩核模型化学反应控制向平板收缩核模型内扩散控制转变。尽管在不同槽电压和电极材料涂覆密度条件下,提锂过程的控制步骤会有所不同,但是在综合考虑电化学反应速率和单位面积生产能力的前提下,采用高电压、高涂覆密度进行电化学提锂是较为理想的。在这一条件下,提锂过程主要受平板收缩核模型内扩散控制。

另外,表1所示的平板收缩核模型内扩散控制动力学方程是在理想模型和理想状态条件下推导得到的。对于真实提锂过程,需要对该方程进行一定的修正,以满足真实提锂速率曲线。从上述研究可知,当槽电压固定时影响提锂反应速率的因素主要有反应物浓度(溶液中Li+)、反应温度和涂覆密度。其中,“电极材料的涂覆密度”虽然不是常规意义的反应物,但是作为影响反应速率的重要参数,具有与“反应物浓度”类似的作用。为了确定电极材料的涂覆密度对反应速率的影响程度,在此引入电极材料的涂覆密度的依赖系数m,其为反应速率对电极表面吸附材料涂覆密度的“反应级数”,是无量纲常数,其物理意义与浓度反应级数n相同。因此,将表1所述平板收缩核模型内扩散控制动力学方程修正为式(1)所示的动力学方程:
结合表1所示平板收缩核模型内扩散控制动力学方程(x2=K5t)以及表2所得拟合动力学方程可确定式(1)中的n、m、E和B值。

由图11可知,当槽电压为0.1 V,电极材料涂覆密度大于20 mg/cm2时,电化学提锂反应受内扩散控制,即Li+在电极涂覆层内部的传质限制了反应的进行。由图11可求得反应的表观活化能为18.9 kJ/mol,Li+浓度的反应级数n为0.382,反应速率对涂覆密度的依赖系数m为-1.46,综合频率因子B为2.53×104,电化学提锂反应的动力学方程为:

图11 动力学参数修正图:电化学提锂过程的Arrhenius图(a);综合速率常数lg K5与锂离子浓度lg C Li的关系(b);综合速率常数lg K5与电极材料涂覆密度lgαLiFePO4的关系(c);x2与 exp(-1.89×104/8.314 T)t的关系(d)Fig.11 The correction diagrams of kinetic parameters:Arrheniusdiagram of electrochemical lithium extraction reaction(a);The relationship between comprehensive rate constant lg K5 and lithiumconcentration lg C Li(b);The relationship between comprehensive rate constant lg K5 and coating density lgαLiFePO4(c);The relationship between x2 and exp(-1.89×104/8.314 T)t(d)

3 结 论
本文考察了不同条件下的提锂速率,并对提锂过程进行了反应动力学研究。在此基础上,阐明了提锂反应的动力学限制步骤,为后续提高提锂反应速率提供了理论支撑。主要结论如下。
(1)反应动力学研究表明:当槽电压较低时,反应受化学反应控制;当槽电压较高时则受内扩散控制,槽电压在此之间属混合控制。当电极材料涂覆密度较小时,反应受内扩散控制,涂覆密度较大时则受内扩散控制。
(2)当槽电压为0.1 V,电极材料涂覆厚度大于20 mg/cm2时,电化学提锂反应受内扩散控制,即Li+在电极涂覆层内部的传质限制了反应的进行。计算所得提锂反应的表观活化能为18.9 kJ/mol,Li+浓度的反应级数为0.382,涂覆密度的依赖系数-1.46,浓度、涂覆密度和温度的综合频率因子为2.53×104所建立的提锂反应动力学方程为:

(3)当提锂反应受化学反应控制时,可通过对磷酸铁锂进行碳包覆和采用导电性更好的碳材料做导电剂,提高电荷转移的能力。当提锂反应受内扩散控制时,提高单位面积产能的关键之一就是提高锂离子在电极材料内部的传质。
符号说明
B——综合频率因子
C0——溶液锂浓度,mol/L
D1——Li+在水溶液中的扩散系数,m2/s
D2——Li+在固体产物层中的扩散系数,m2/s
E——反应表观活化能,kJ/mol
K1~K5——表观速率常数
k——化学反应速率常数,m
l0——电极初始厚度
m——电极涂覆密度的依赖系数
n——锂离子浓度反应级数
R——气体常数,J/(mol·K)
r0——磷酸铁锂颗粒初始半径,m
T——热力学温度,K
t——反应时间,h
x——吸附率(实际吸附容量与理论吸附容量的比值)
αLiFePO4——电极材料的涂覆密度,mg/cm2
β——Li+在产物层的扩散通量与固体颗粒的消耗量的比例系数
γ——Li+在产物层的扩散通量与固体颗粒的消耗量的比例系数
ρ——磷酸铁锂颗粒密度,g/cm3
