砜胺体系吸收有机硫的热力学及动力学探讨
2021-06-28刘可杨超越杨安叶辉刘琴
刘可 杨超越 杨安 叶辉 刘琴
1.中国石油西南油气田公司天然气研究院 2.中国石油西南油气田公司川西北气矿 3.中国石油遂宁天然气净化有限公司
近年来,随着国家清洁能源战略的稳步推进,我国对商品天然气的气质要求越来越严格,并于2018年11月发布了GB 17820-2018《天然气》标准,其中,对于商品天然气中总硫质量浓度的要求由GB 17820-2012《天然气》中规定的≤200 mg/m3降至≤20 mg/m3,给天然气生产企业带来了一定的压力[1-2]。就川渝地区而言,部分天然气净化厂原料气中有机硫质量浓度超过30 mg/m3,使用现有的MDEA类溶剂脱硫难以达到总硫质量浓度≤20 mg/m3的要求,必须将溶剂更改为物理-化学溶剂体系,以提高对有机硫的脱除率[3-5]。
虽然物理-化学溶剂体系已较为成熟,国内外也有多套天然气处理装置采用该体系,但这些装置在设计建造时均未针对如此严格的总硫含量要求,无需考虑有机硫深度脱除问题[6]。因此,不管是溶剂开发商还是设计单位,均对天然气中低浓度有机硫的深度脱除缺乏经验。中国石油西南油气田公司在气质达标改造过程中也出现过采用物理化学溶剂后有机硫脱除率不理想的问题,由于国内外可参考的文献很少,鲜有类似的应用案例,只能通过室内理论研究结合现场工艺调整的方法推进整改工作。以下重点阐述在整改过程中对于有机硫吸收动力学方面积累的一些新的认识。
1 砜胺溶液脱除有机硫的机理
砜胺溶液由环丁砜、醇胺和水组成,因此,同时兼具物理溶剂法和化学溶剂法的优势和特点。
砜胺法溶液中醇胺和其他活性组分对有机硫酸性组分的吸收主要为化学吸收;砜胺溶液吸收有机硫酸性组分是物理溶解与化学吸收作用的总和,具有良好的脱有机硫能力。
砜胺溶液对H2S的吸收主要是其中胺液对H2S的吸收。MDEA脱除H2S属于弱酸弱碱中和反应,是一种快速的质子反应,反应速度很快,属于化学吸收控制的吸收过程。
在我国天然气净化厂中,原料气中的有机硫主要以羰基硫(COS)和甲硫醇(CH3SH)为主,部分净化厂还含有少量乙硫醇、正丙硫醇、异丙硫醇及二硫化碳(CS2)等。本节重点考察砜胺溶液对有机硫(COS和硫醇)的脱除机理。
1.1 COS脱除机理
根据脱除过程本质上的不同,可将砜胺溶液对COS的溶解脱除作用区分为物理溶解、化学吸收和催化水解反应后再吸收[7]。
1.1.1物理溶解
COS在水中的溶解度较低,主要靠环丁砜对COS进行物理溶解,其气液相基本符合亨利定律。
1.1.2化学吸收
COS的分子结构与CO2类似,与伯醇胺和仲醇胺直接反应的机理遵从类似CO2的反应机理,碱性较强的伯胺和仲胺能与COS反应生成相应的硫代氨基甲酸盐,基于生成两性离子的反应式如下:
伯胺:2RNH2+COS=RNHCOS-+RNH3+
(Ⅰ)
仲胺:2R2NH+COS=R2NCOS-+R2NH2+
(Ⅱ)
对于叔胺而言,分子中不存在可供直接反应的活泼H原子,只能在水分子参与的条件下进行反应,总反应式见式(Ⅲ)。
R3N+COS+H2O=R3NH++HCOOS-
(Ⅲ)
胺液对COS的吸收是一个因有反应而获得增强的气液传质过程。因此,在整个过程中包含了物理性的传质及化学反应两个步骤。当然,这两个步骤不是孤立进行的,传质为化学反应的发生提供了条件,而化学反应又反过来加速了传质过程。但对于COS在吸收过程中化学反应和物理溶解各自所占的比例,目前还主要停留在定性解释上,缺乏定量数据的支撑。
1.1.3催化水解反应后再吸收
COS的分子结构为线性分子,可以在高温下或催化剂存在的情况下水解。反应方程式见式(Ⅳ)。
COS+H2O=H2S+CO2
(Ⅳ)
当COS水解为H2S和CO2后容易脱除,但低温下COS水解反应的速率较慢,在25 ℃下的拟一级反应速率常数仅为0.001 1 s-1。
1.2 硫醇脱除机理
Bedell S A 等[8]认为硫醇在混合溶剂中的溶解过程可以用图1表示。由图1可知,硫醇的溶解是由物理溶解和化学溶解两部分组成的。物理溶解量与温度、压力有关;化学溶解量等于硫醇在胺液中形成的硫醇盐(RS-)的溶解量。

1.2.1物理溶解
硫醇在物理溶剂中的溶解度取决于体系的亨利常数,亨利常数越小,则溶解度越大。表1列举了CH3SH在醇胺及砜胺溶液中的亨利常数,可见加入30%(w)环丁砜后的砜胺溶液,亨利常数比MDEA水溶液明显降低,说明环丁砜可大幅提高溶液对CH3SH的物理溶解。此外,从第2组和第5组数据可以看出,当酸性气体存在时,体系的亨利常数明显升高,这说明吸收了H2S和CO2后,会导致溶剂对CH3SH的吸收性能下降。

表1 CH3SH溶解于醇胺及砜胺水溶液的亨利常数(40 ℃)
1.2.2化学吸收
Rahman M A[9]探讨了硫醇与醇胺可能的反应方式,结果表明,醇胺分子很难与硫醇分子发生离子反应,两种分子之间可能形成一种Lewis酸碱加合物。以MEA为例,加合反应式见式(Ⅴ)。
Bedell S A等[8]认为,硫醇化合物也能与醇胺发生化学反应形成相应的硫醇盐而溶解于溶液中,反应式见式(Ⅵ)~式(Ⅷ)。
R3N+RSH↔R3NH+RS-
(Ⅵ)
R2NH+RSH↔R2NH2+RS-
(Ⅶ)
RNH2+RSH↔RNH3+RS-
(Ⅷ)
但由于硫醇化合物的酸性比COS还弱,反应速率更低,且醇胺化合物对硫醇分子的化学溶解性随溶剂中酸性组分负荷的增加而迅速下降,当醇胺的酸性组分负荷大于0.1 mol 酸气/mol 醇胺时,醇胺水溶液对硫醇的化学溶解度迅速降至占物理溶解度的约10%。对于含CO2、有机硫的原料天然气净化工艺,溶剂中酸性组分负荷明显大于0.1 mol 酸气/mol 醇胺,因此,原料气中的硫醇化合物主要依靠物理溶解进行脱除,但醇胺化合物对硫醇的物理溶解性同样较低。由于一般的醇胺化合物对硫醇分子的化学溶解性和物理溶解性均不理想,因此,总体脱除率不高,且随着硫醇分子碳数的增加,硫醇化合物的酸性降低,脱除率显著下降。故在砜胺溶剂体系中,硫醇的脱除主要靠环丁砜对其的物理溶解。
2 有机硫在物理化学溶剂体系的气液平衡
有机硫在物理化学溶剂体系中的吸收实际上是一个气液平衡问题,达到平衡时的气相浓度即为净化气中有机硫含量的最低值。中国石油西南油气田公司天然气研究院通过室内实验测定了CH3SH和COS在甲基二乙醇胺-环丁砜类的物理-化学溶剂体系中的气液平衡数据,见图2~图3。
根据平衡溶解度数据可以对天然气净化厂的气液平衡状态进行估算。在吸收压力为6.0 MPa、气液比为700的条件下,原料气中每100 mg/m3的有机硫被完全吸收后,液相中的溶解度增加0.07 g/L。在40 ℃下,气相CH3SH分压小于0.01 kPa,相对于6 MPa的总压而言,CH3SH摩尔分数仅约1×10-6。COS气相平衡分压稍高,但也不超过3×10-6。因此,从平衡角度分析,采用物理-化学溶剂体系吸收有机硫,可达到95%以上的脱除率。但事实表明,包括安岳天然气净化厂、中国石油西南油气田公司天然气净化总厂引进分厂和渠县分厂在内的多个天然气净化厂的物理化学溶剂实际有机硫脱除率远未达到此水平。其原因是在脱硫吸收塔中有限的气液接触时间内,整个体系未达到气液平衡状态,有机硫脱除率并非完全受气液平衡的控制,而是在较大程度上受到动力学的控制。

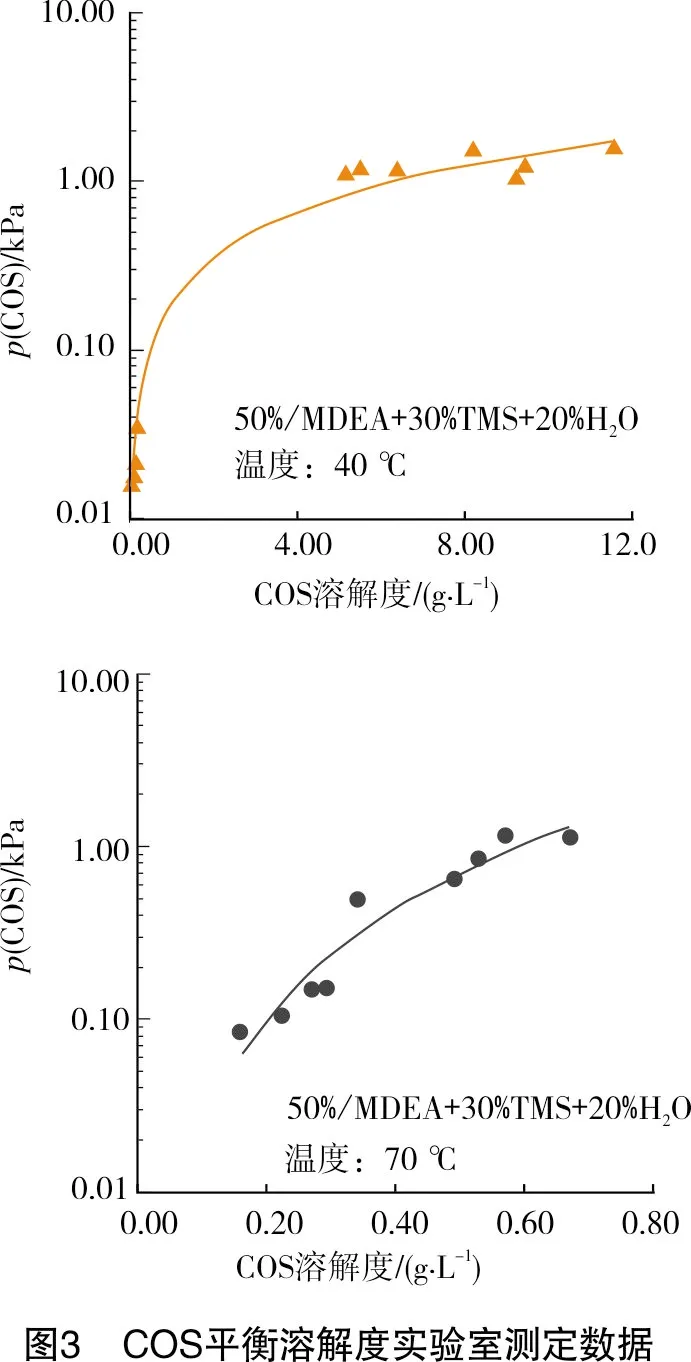
另外,从数据中也可以看出,高温下CH3SH和COS的亨利常数增大数10倍,这也是有机硫能够在再生塔中高温低压的条件下进行有效解吸的原因。
3 气液接触时间对有机硫脱除效果的影响
众所周知,动力学在宏观上表现为反应/吸收速率的快慢。对于快反应而言,在极短的时间内就能达到平衡,脱除率主要受平衡控制,例如H2S在MDEA水溶液中的吸收。但对于慢反应而言,达到平衡需要相当长的反应时间,具体表现为脱除率随着接触时间的增长逐渐提高。一般情况下,由于吸收塔中的气液接触时间较为有限,往往难以达到平衡状态。因此,脱除率主要受动力学的控制。
为了验证这一假设,在室内实验装置上,通过改变吸收塔填料高度和原料气处理量控制气液接触时间,考察气液接触时间对有机硫(CH3SH和COS各约50%)脱除率的影响,结果如图4所示。

当气液接触时间从约50 s增加到380 s,有机硫脱除率从略高于40%大幅提升至>90%。相比之下,H2S脱除率并没有明显变化,在气液接触时间为50 s时,H2S脱除较为完全。这也充分说明相比H2S而言,有机硫在物理-化学溶剂体系中的吸收速率慢得多,对气液接触时间的要求明显高于H2S吸收。因此,动力学控制是有机硫吸收的主要制约因素。
同样,我们针对安岳天然气净化厂脱硫装置采用砜胺溶剂的现场运行数据也进行了较为全面的分析,其中关于有机硫脱除率和接触时间的关系如下。
图5为现场装置的COS脱除率/接触时间和接触时间的关系。从图5中可以看出,接触时间和COS脱除率/接触时间存在很明确的关联性。随着接触时间的增大,脱除率增加幅度(单位时间的增加率)下降,说明吸收速率和待吸收组分的浓度呈正相关关系,这也符合慢反应的吸收原理,从而证明COS的吸收确实是受动力学控制。

对图5的曲线进行拟合,得到接触时间和COS脱除率的关系式,见式(1)。
RtCOS=28.729 21×t0.285 76(R2=0.897 62)
(1)
式中:Rtcos表示COS随时间变化的脱除率,%;t为接触时间,s;R2为方差;该拟合关系式在5 得到此关系式后,在已知气液接触时间的前提下,可以计算出任一时间的COS脱除率。但必须说明的是,这类拟合式只能针对特定的装置进行预测,而并非基于严格机理的普适性计算公式。 同样,研究了安岳天然气净化厂CH3SH的脱除率/接触时间与接触时间的关系,见图6。与COS不同,CH3SH并未表现出很强的关联性,这可能是由于现场工艺参数波动、取样干扰、分析误差等因素对微量硫醇的影响较大,也可能是因为在CH3SH的吸收过程中,物理溶解的权重较大,而物理溶解受到塔内流动状态的影响更为明显,无法显示出明显的规律性。但从整体情况来看,随着接触时间的增加,脱除率/接触时间仍呈下降趋势,也就是说,CH3SH的吸收仍受动力学控制。由于二者的吸收机理有所不同,对COS而言,化学反应占主导因素,添加促水解反应活化剂,可以大幅度提高COS的脱除率。而对于CH3SH而言,吸收主要以物理溶解为主,低浓度下化学反应较难发生,促进水解的活化剂亦不能使CH3SH发生水解反应,其作用仅是提高溶液体系碱性,对于CH3SH化学反应速率的提升幅度极为有限。因此,仅添加促水解活化剂,无法实现对CH3SH的深度脱除。 在物理化学溶剂体系中,有机硫吸收为动力学控制的慢反应,可以按照慢反应的动力学特征建立有机硫吸收的基本模型。 由于原料气中的有机硫摩尔分数为10-6级,对应液相中有机硫含量也极低,因此,可假设其平衡符合亨利定律,由式(2)表示。 y=mx (2) 式中:y为气相摩尔组成;m为亨利系数;x为液相摩尔分数。三者均无量纲。 将其代入填料塔传质单元数计算式,得到式(3)。 (3) 式中:A=L/mG为吸收因子,L和G分别为液相和气相摩尔流量,kmol/s。假设新鲜贫液中有机硫浓度为0,即x2=0,则式(3)可进行简化,得到式(4)。 (4) 填料塔高度H为: H=HOGNOG (5) 其中传质单元高度HOG为: (6) 式中:H为填料塔高度,m;HOG为传质单元高度,m;ky为气膜传质系数,kmol/(m2·s);a为填料的有效比表面积,m2/m3。 由以上各式得到 (7) 由于有机硫的吸收为慢反应,根据Onda经验式,此类反应的Ky正比于G0.7,见式(8)。 Ky=kG0.7 (8) 将其代入式(7),整理得到: (9) 根据式(9),在已知填料的比表面积a、填料高度H、气相流率G、液相流率L的条件下,可根据实验数据回归出速率因子k和亨利系数m。同样,也可根据入口有机硫摩尔分数y1预测出口有机硫摩尔分数y2。 表2中列入了MDEA水溶液(文献值)和砜胺溶剂(回归值)的速率因子k和亨利系数m[10]。 表2 MDEA和砜胺溶剂的速率因子k和亨利系数m 由表2中数据可知,砜胺体系吸收有机硫的速率因子比MDEA高,但提高幅度并不大。而亨利系数相比MDEA水溶液有明显降低,说明在平衡状态下,与MDEA溶剂相比,砜胺溶剂的有机硫脱除率大幅提高,但由于速率因子相差不大,吸收速率并未明显加快,故需要较长的气液接触时间以达到平衡,从而可提高有机硫脱除率。 有机硫脱除率η可根据式(10)计算。 (10) 考虑温度、压力、填料高度等因素,结合气体状态方程,可以根据摩尔流量G计算出气液接触时间。有机硫脱除率和气液接触时间的关系如图7所示。从图7可以看出,MDEA水溶液即使在气液接触时间>250 s时,有机硫脱除率仍不超过30%,这是由其本身的热力学和动力学性质决定的。若将脱除率对接触时间t求导可发现,随着接触时间的增加,有机硫脱除率不可能无限提高,而是趋于某一极限,该极限就是溶剂的有机硫脱除率上限,由亨利系数m和速率因子k共同决定,而砜胺体系的上限远高于MDEA水溶液,但必须达到较长的气液接触时间才能实现较高的有机硫脱除率。 需要说明的是,在本计算模型中,热力学和动力学对有机硫脱除率均起到决定性作用,这与第2节中“物理化学溶剂体系的有机硫脱除率主要受动力学控制”的结论并不矛盾。第2节的结论基于宏观上的气液平衡,在较短的时间内无法达到气液平衡时,脱除率主要受动力学控制。而本节在推导过程中,气液平衡规律作用在微观状态上,亨利系数越小,气液传质界面上的推动力越大,进而会影响传质速率,而并非指整个系统达到气液平衡状态。另外,本计算模型是根据基本原理推导的最简单的模型形式,对大多数影响条件做了简化处理,并且没有考虑酸气负荷、液相流态、气体间相互作用等影响,直接用于计算实验数据时存在一定的偏差。但其表现出来的规律性是符合实际的,也是严格按照动力学原理进行推导的,具有一定的说服力。对于现场装置的模拟计算,需要进一步优化,充分考虑多种因素的影响,同时借助数学方法和计算机的运算能力,并通过现场数据对关键参数进行修正,才能建立更加准确的计算模型。 (1)有机硫在砜胺体系的吸收既包括物理吸收,又包括化学吸收。对于天然气中常见的有机硫化合物,在CH3SH的吸收过程中,以物理吸收为主,兼有化学吸收;而对于COS,则以化学吸收为主。 (2)有机硫在砜胺体系的吸收主要受动力学控制,符合慢反应的特征,对气液接触时间有较高要求,短时间内无法达到气液平衡状态。 (3)对这类体系可建立基于吸收动力学的计算模型,通过实验数据对亨利系数m和速率因子k进行回归后,可用于预测有机硫脱除率。根据模型计算结果,物理化学溶剂对于有机硫的脱除率上限明显高于MDEA水溶液,且脱除率和气液接触时间呈正相关关系,与实际运行数据的规律相吻合。
4 基于动力学控制的有机硫吸收模型


5 结论
