白星花金龟幼虫肠道中纤维素降解菌的筛选及其全基因组分析
2021-06-28黄婉秋石冬冬蔡红英于大力孟昆杨培龙
黄婉秋, 石冬冬, 蔡红英,2, 于大力, 孟昆, 杨培龙,2*
(1.中国农业科学院饲料研究所, 农业农村部饲料生物技术重点实验室, 北京 100081;2.生物饲料开发国家工程研究中心, 北京 100081)
木质纤维素是生物量的主要组分,主要由纤维素、半纤维素和木质素组成。木质纤维素降解以后能够生成还原糖,这些还原糖再进一步发酵能够生成乙醇、丁醇等有机燃料。充分利用木质纤维素为再生清洁能源提供了一个优化的途径。纤维素的生物降解是一系列酶联合作用的结果,主要有外切-β-1,4-葡聚糖酶(exo-β-1,4-glucanase,CBHs,EC 3.2.1.91)、β-葡萄糖苷酶(β-glucosidase,BG,EC 3.2.1.21)和内切-β-1,4-葡聚糖酶(endo-β-1,4-glucanase,EG,EC 3.2.1.4)。在自然界中,许多昆虫具有完整、复杂的木质纤维素消化降解系统,被看作是高效的生物能源转化器,有着很大的应用价值。这些昆虫之所以能消化和利用大量的木质纤维素,是因为其消化系统及其微生物存在各类木质纤维素酶以及非催化性蛋白,在肠道特定的理化环境条件下,促使其能够高效降解和转化纤维素、半纤维素、甚至木质素这类高聚合度的大分子结构[1]。
白星花金龟(Protaetiabrevitarsis)属于鞘翅目(Coleoptera)、花金龟科(Cetoniidae),是一种全国性分布的农业害虫,其幼虫为腐食性,以植物根部、杂草等为食。但有研究者基于白星花金龟幼虫的腐食性模拟自然界秸秆等的腐烂状况,发现白星花金龟幼虫能够有效的降解玉米秸秆、小麦秸秆和花生壳;且在其肠道中发现了丰富的与纤维素降解相关的微生物[2-3]。田小燕等[4]利用宏基因组测序分析了白星花金龟幼虫肠道细菌的多样性,通过细菌群落功能挖掘,发现其后肠含有丰富的纤维素降解酶。
本研究以富含纤维素的菌糠系统饲喂白星花金龟幼虫,从其中、后肠中筛选出能够特异、高效降解纤维素的菌株,并对高效菌株进行基因组分析,确定与纤维素降解相关的基因,推测其降解酶及协同方式,也为筛选优质酶、构建纤维素降解工程菌提供依据。
1 材料与方法
1.1 试验材料
1.1.1供试昆虫 白星花金龟由中国农业科学院河北廊坊基地提供,取1龄幼虫50只,分装于33 cm×23 cm×20 cm大小的避光箱中,用菌糠饲喂,温度控制在28 ℃左右,每隔3 d清理一次箱中虫粪,将幼虫喂养至3龄,解剖取其中、后肠道。
1.1.2主要试剂和仪器 羧甲基纤维素钠(CMC-Na),北京博奥拓达科技有限公司;木聚糖,梯希爱(上海)化成工业发展有限公司;刚果红,国药集团化学试剂有限公司。
SHTI150C智能型恒温恒湿箱,北京东联哈尔仪器制造有限公司;YXQ-LS-100A立式压力蒸汽灭菌器,上海博讯实业有限公司;IS-RDS3叠加式恒温振荡器,美国精骐有限公司;CT15RE离心机,日本日立有限公司;T100 PCR仪,美国伯乐公司;1530-00636酶标仪,赛默飞世尔科技(中国)有限公司BSC-1600 ⅡA2生物安全柜,江苏苏净集团有限公司;MS-01H磁力搅拌器,美国精骐有限公司。
1.1.3培养基 菌糠:棉籽壳60%、玉米芯25%、麦麸12%、石灰2%、石膏1%。
肠原液筛选培养基:蛋白胨10 g、NaCl 5 g、酵母膏0.5 g、刚果红0.05 g、羧甲基纤维素钠(CMC-Na)5 g、MnSO4·5H2O 0.02 g、MgSO4·7H2O 0.4 g、ZnSO4·7H2O 0.01 g、CuSO4·5H2O 0.01 g、FeSO4·7H2O 0.1 g、CaCl2·2H2O 0.1 g、K2HPO40.5 g、琼脂20 g、蒸馏水1 000 mL。
LB培养基:胰化蛋白胨10 g、酵母提取物5 g、NaCl 10 g、蒸馏水1 000 mL,pH 7。
羧甲基纤维素钠培养基:CMC-Na 5 g、明胶2 g、刚果红0.05 g、MgSO4·7H2O 0.25 g、K2HPO40.5 g、琼脂20 g、蒸馏水1 000 mL,pH 7。
木聚糖培养基:木聚糖5 g、明胶2 g、刚果红0.05 g、MgSO4·7H2O 0.25 g、K2HPO40.5 g、琼脂20 g、蒸馏水1 000 mL,pH 7。
滤纸条培养基:牛肉膏1.5 g、蛋白胨1.0 g、CaCO32.0 g、Whatman No.1滤纸条1 cm×6 cm、蒸馏水1 000 mL。
产酶培养基:CMC-Na 10 g、(NH4)2SO44 g、KH2PO41 g、MgSO4·7H2O 0.5 g、蛋白胨5 g、牛肉膏5 g、蒸馏水1 000 mL,pH 7。
1.2 样品处理和菌株筛选
1.2.1样品处理 取菌糠喂养的3龄幼虫7只,禁食2 d后用无菌水冲洗干净虫体表面,再用75%酒精浸泡虫体3 min,最后用无菌水冲洗浸泡。在无菌条件下,将虫体表面剪开,取出完整中、后肠道,将7只幼虫的肠道混合在一起,研磨匀浆,用0.9%生理盐水进行稀释,一共设置9个稀释梯度10-1~10-9,选取每个梯度的稀释液各100 μL涂布于肠原液筛选培养基上,每个梯度重复三次,置于28 ℃恒温培养箱中,倒置培养。
1.2.2羧甲基纤维素钠琼脂平板筛选 挑取在肠原液培养基上生长的单菌株至LB培养基上划线分离,再将纯化的菌株分别接种至羧甲基纤维素钠培养基和木聚糖培养基,置于28 ℃恒温培养箱中,倒置培养3 d。观察菌株生长情况,记录水解圈大小与菌落直径。
1.2.3滤纸降解实验 将水解圈较大的纯菌落接种至LB液体培养基,培养至对数期后按照3%接种量转接至滤纸条培养基中,置于28 ℃恒温摇床,200 r·min-1振荡培养,同时设置不加菌液的滤纸条培养基作为对照组,每个处理3个重复。观察滤纸降解情况,筛选出优势菌株。
1.3 菌种分类分析
提取每株细菌菌株的基因组DNA为模板,选用细菌16S rRNA通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)进行扩增,PCR反应体系(50 μL):2×Pfu DNA polymerase 25 μL,正反向引物各2 μL,模板DNA 2 μL,ddH2O 19 μL。反应条件:95 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,共30个循环;然后72 ℃延伸10 min,4 ℃终止反应。反应结束后用1%琼脂糖凝胶电泳检测PCR产物。PCR产物经诺唯赞FastPure Gel DNA Extraction Mini Kit胶回收试剂盒回收后送北京博迈德基因工程技术有限公司测序。测序结果通过NCBI(https://blast.ncbi.nlm.nih.gov)进行BLASTn比对分析。以筛选出的优势菌株16S rRNA基因序列及比对结果中相似度较高的16S rRNA基因序列为材料,使用Mega 6.0生物信息学软件构建系统进化树,确定菌株所属类别。
1.4 CMC酶活测定
将菌株接种至产酶培养基中,于28 ℃恒温摇床180 r·min-1培养。取不同时期菌液离心后的上清,使用二硝基水杨酸(DNS)法测定酶活,反应体系为100 μL酶液,900 μL 1%(质量体积百分比)的CMC-Na底物。底物在反应温度预热3 min后,加入酶液反应10 min,然后加入1.5 mL DNS终止反应,沸水煮5 min,置于冰上冷却,用酶标仪在540 nm波长下测定OD值。同时设置一组对照,在加入酶液前先加入1.5 mL DNS终止反应。酶活定义:每分钟分解底物生成1 μmol还原糖所需的酶量,用U·mL-1表示。
1.5 全基因组测序和分析
将h9菌株送至金唯智生物科技有限公司进行denovo全基因组测序分析。基于组装结果进行编码基因预测及rRNA、tRNA、其他ncRNA的预测,然后对预测出的基因进行COG、CAZy等数据库的功能注释分析。
2 结果与分析
2.1 纤维素降解菌的筛选
解剖获得的昆虫肠道样品在肠原液筛选培养基上进行肠道菌分离,根据刚果红染色降解圈的大小来判断菌株对纤维素的降解能力。结果表明,从肠原液培养基中初步筛选分离出90株能够产生水解圈的菌株,分别属于假单胞菌、芽孢杆菌、纤维单胞菌等属。结合滤纸条降解结果筛选到5株降解菌(表1和图1),菌株h15可对纤维素和木聚糖产生较大的水解圈;菌株h3和H4可对纤维素和木聚糖产生水解圈,同时也有一定的滤纸降解能力,它们在第14 d时可呈现滤纸膨胀、边缘略有降解的状态。菌株h9无木聚糖水解圈,但其纤维素水解圈及滤纸降解的综合效果最好,且菌株h9对滤纸条的降解随时间逐渐加强,在第7 d时可将滤纸彻底崩解成糊状。
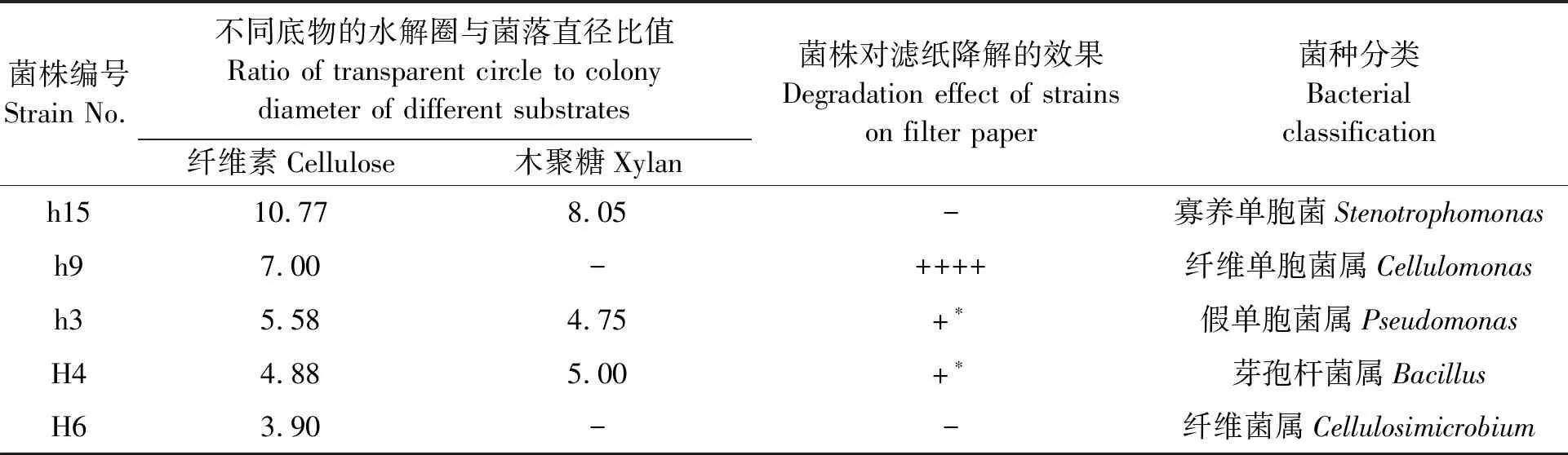
表1 降解菌筛选结果Table 1 Selection result of strain
2.2 菌株分类分析
综合水解圈和滤纸降解试验,发现菌株h9的纤维降解效果最好,因此,对其进行了深入分析。将菌株h9的16S rRNA基因序列在NCBI上使用BLASTn序列比对分析,选取结果中相似度最高的菌属作为材料,利用MEGA 6.0构建系统发育树。由图2可知,菌株h9的16S rRNA基因序列与纤维单胞菌属(Cellulomonas)的多个菌株具有较高的同源性,序列一致性超过98.9%。其中,与登录号为NR 114320.1的波斯纤维单胞菌CellulomonaspersicaJCM18111序列相似度为99.86%,序列比对覆盖率达100%,因此,将菌株h9命名为Cellulomonassp. h9。
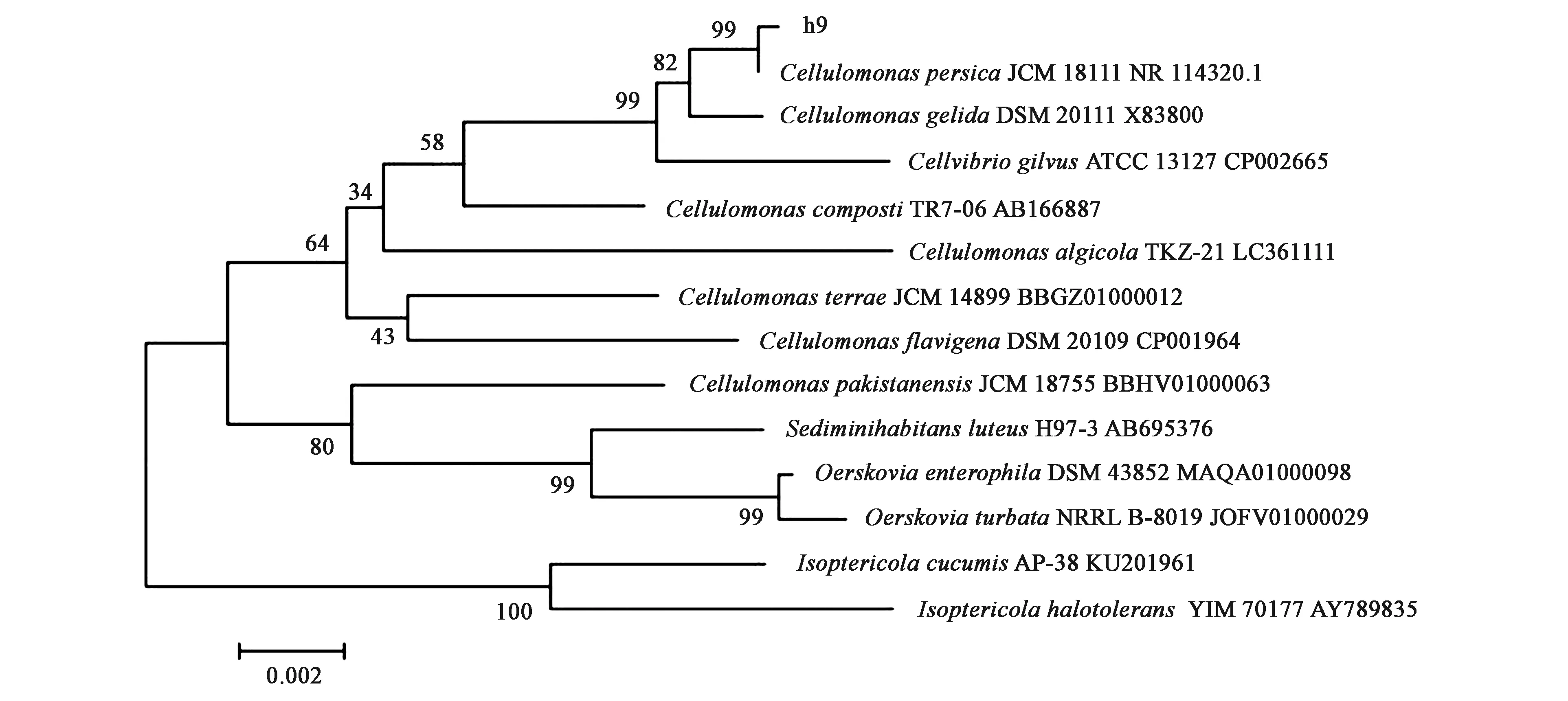
图2 基于16S rRNA序列同源性的h9菌株的系统发育树Fig.2 Phylogenetic tree of h9 strain based on 16S rRNA sequence homology
2.3 Cellulomonas sp. h9菌株的生长与产酶特性
2.3.1h9生长曲线 菌株h9在产酶培养基中的菌体密度变化趋势如图3所示,在28 ℃、培养基pH 7条件下,培养24 h后进入快速生长期,培养至96 h时,菌体生长达到平台稳定期。

图3 菌株h9在产酶培养基中的生长曲线Fig.3 Growth curve of strain h9 in enzyme production medium
2.3.2菌株h9酶活性的变化 在以CMC-Na为碳源培养的过程中,菌株h9的CMC酶活变化如图4所示。可以看出,培养基初始阶段酶活较低,在120 h左右时,CMC酶活达到最大值0.19 U·mL-1,且pH 7条件下的酶活高于pH 4,50 ℃条件下的酶活高于30 ℃。推测菌株h9产酶为中性纤维素或碱性纤维素酶。

图4 菌株h9的CMC酶活性Fig.4 CMC enzyme activity of strain h9
2.4 全基因组测序及基因注释
为了解菌株h9的纤维素降解相关基因,对菌株的基因组denovo进行了测序,组装后得到该菌株的基因组,全长3 784 732 bp,GC含量较高,为73.53%,基因组共包含3 433个基因,其中编码基因3 352个(97.64%),非编码RNA 81个(13个rRNA、45个tRNA、23个其他ncRNA)。
通过COG数据库(cluster of orthologous groups of proteins)比对,将编码基因进行功能分类,如图5所示,注释到的蛋白分布于22个COG的条目中,维持生命基本功能的相关基因在功能基因中占比较大。一共注释到2 590个功能基因,其中转录相关基因有247个(9.54%),碳水化合物运输和代谢(G)功能的基因有238个(9.19%),次生代谢产物生物合成、运输和分解代谢(Q)功能的基因共有128个(4.94%),细胞内物质转运、分泌和膜泡运输(U)功能的基因有42个(1.62%),氨基酸转运与代谢的基因212个(8.19%)。
2.5 纤维降解相关基因分析
根据CAZy(carbohydrate-active enZYmes database)数据库分析,首先注释了糖脂代谢相关的基因,包括糖苷水解酶(glycoside hydrolases,GHs)161个(26.44%),糖基转移酶(glycosyl transferases,GTs)195个(32.02%),多糖裂合酶(polysaccharide lyases,PLs)4个(0.66%),糖脂酶(carbohydrate esterases,CEs)32个(5.25%),辅助功能的酶(auxiliary activities,AAs)13个(2.13%)等(图6)。

注:A—RNA转录和加工;B—染色质结构和动力学;C—能源生产和转换;D—细胞周期控制、细胞分离、染色体分区;E—氨基酸运输和代谢;F—核苷酸运输和代谢;G—碳水化合物运输和代谢;I—脂质运输和代谢;J—翻译、核糖体结构和合成;K—转录;L—复制、重组和修复;M—细胞壁/膜/外膜合成;N—细胞运动;O—转译后修饰、蛋白质周转、分子伴侣;P—无机离子运输和代谢;Q—次级代谢产物的合成、运输和分解代谢;R—通用功能预测;S—未知功能;T—信号转导机制;U—胞内运输、分析和膜泡运输;V—防御机制。Note: A—RNA processing and modification; B—Chromatin structure and dynamics; C—Energy production and conversion; D—Cell cycle control, cell division, chromosome partitioning; E—Amino acid transport metabolism; F—Nucleotide transport and metabolism; G—Carbodydrate transport and metabolism; H—Coenzyme transpore metabolism; I—Lipid transport metabolism; J—Translation, ribosomal structure and biogenesis; K—Transcription; L—Replication, modification, protein turnover, chaperones; P—Inorganic ion transport and metabolism; Q—Secondary metabolites, biosynthesis, transport and catabolism; R—General function prediction only; S—Function unknown; T—Signal transduction mechanisms; U—Intracellular trafficking, secretion, and vesicular transport; V—Defense mechanisms.图5 菌株h9基因组COG功能分类Fig.5 COG functional classification of strain h9 genome
其次,重点进行了纤维降解相关基因的注释分析,从中分析预测出内切-β-1,4-葡聚糖酶(EC 3.2.1.4)的相关基因有6个,β-葡萄糖苷酶(EC 3.2.1.21)的相关基因有12个,外切-β-1,4-葡聚糖酶(EC 3.2.1.91)的相关基因有2个(表2)。

表2 菌株h9中纤维素酶基因Table 2 Cellulase genes in strain h9 genome
3 讨论
本研究利用羧甲基纤维素钠和滤纸条培养基同时从白金花金龟幼虫肠道中筛选纤维素降解菌,结果发现,两种分离方法有很大区别,羧甲基纤维素钠培养基上刚果红水解圈较大的菌株对滤纸的降解效果并不理想,这很可能是多种原因造成的。一方面,温度、平板厚度、初始pH、接种量等都对水解圈的大小有影响[5],包衎等[6]也发现,液体样品中酶的浓度与形成的水解圈直径,并不总是呈直接关系,还可能受其他因素影响。另一方面,刚果红固体平板培养的条件与滤纸条的液体培养基条件不同。羧甲基纤维素钠属于可溶性底物,通常用来测定内切葡聚糖酶的活性,内切葡聚糖酶随机作用于分子内的糖苷键,形成纤维素短链,其还原糖生成的速率不高;滤纸条培养基中的滤纸属于非可溶性底物,是一种由长纤维棉纸浆制成的通用模式底物,纤维素酶使纤维素的无定形区与结晶区发生水解,通常用来测定纤维素酶的总活力。多项研究表明,不同底物或者不同测定方法得到的纤维素水解活力结果存在一定的差别,其结果无法相互比较,纤维素酶对可溶性底物与不可溶性底物的活力并不具有明显的相关性[7-8]。此外,内切和外切酶在体系中的比例、反应过程中底物与酶的浓度、反应的时间等条件都对降解结果有很大影响[9]。因此,在筛选菌株的过程中,并不能以水解圈大小或者滤纸的降解效果来作为判断菌株产纤维素酶活力大小的唯一指标。综合利用水解圈实验和滤纸降解实验,可以筛选出降解效果较好的菌株。

注:GT—糖基转移酶;CBM—碳水化合物结合模块;PL—多糖裂合酶;CE—糖脂酶;GH—糖苷水解酶;AA—辅助功能酶。Note: GT—Glycosyl transferases; CBM—Carbohydrate-binding modules; PL—Polysaccharide lyases; CE—Carbohydrate esterases; GH—Glycoside hydrolases; AA—Auxiliary activities.图6 菌株h9 CAZy family分布Fig.6 CAZy family distribution of strain h9 genome
多项研究从昆虫体内筛选得到产纤维素酶的细菌,Handique 等[10]从甲虫(Lepidiotamansueta)的幼虫肠道发现了5株具有纤维素降解活性的柠檬酸杆菌(Citrobactersp.);陈俊梅等[11]从蠼螋(Earwigfurficulidae)肠道中筛选得到一株具有碱性内切葡聚糖酶活性的甲基营养型芽孢杆菌(Bacillusmethylotrophicus) Q5;宁娜[12]从黄翅大白蚁(Macrotermesbarneyi)肠道中得到一株具有漆酶活性的高地芽孢杆菌(Bacillusaltitudinis) CMC2;傅慧静[13]从松墨天牛(MonnochamusalternatusHope)肠道中得到一菌具有木质素过氧化物酶活性的粘质沙雷氏菌(Serratiamarcescens);Briones-Roblero等[14]从嗜根线虫(D.rhizophagus)肠道中得到了具有内切葡聚糖酶活性的节杆菌(Arthrobactersp.)和具有木聚糖酶活性的假单胞菌(P.azotoformans);Adriana等[15]从草地贪夜蛾(S.frugiperdalarvae)肠道中筛选得到具有内切-β-1,4-葡聚糖酶活性的坚硬芽孢杆菌(Bacillusfirmus) NCIMB 9366(T),这些昆虫来源的纤维素降解细菌大多能够产内切葡聚糖酶,少部分菌株产木质素降解相关的漆酶、过氧化物酶,体现出昆虫肠道是一个蕴藏着纤维素降解菌的宝库,对纤维素降解菌的筛选有着很大的潜力。本研究从白星花金龟幼虫中、后肠筛选出90株能够产生水解圈的菌株。其中,分离得到的Cellulomonassp. h9菌株CMC酶活为0.19 U·mL-1,高于许婧[16]从暗黑鳃金龟肠道筛选的Cellulosimicrobiumsp. HP18和Alcaligenaceaesp. HP14菌株CMC酶活。
纤维单胞菌是一类重要的纤维降解菌,其产酶特性得到了多项研究的确认。例如,侯晶[17]从Cellulomonasbogoriensis基因组中扩增得到三个糖苷水解酶基因;Anthony等[18]从CellulomonasbiazoteaATCC 486菌株中获得了5个β-葡萄糖苷酶基因;Elberson等[19]从土壤中分离得到Cellulomonaspersica,发现其能够降解纤维素,但目前尚未见对其纤维素酶基因的研究。研究发现,Cellulomonasflavigena能够产生木聚糖酶、β-木糖苷酶、内切葡聚糖酶、外切葡聚糖酶和β-葡萄糖苷酶等多种酶类[20-21]。这说明了在纤维单胞菌中,蕴含着相当丰富的与纤维素降解相关的酶基因资源。本研究中,菌株Cellulomonassp. h9基因组预测了12个β-葡萄糖苷酶基因,且有3个(4-211、4-263、4-381)已经得到初步的功能验证,其中酶活较高的4-211基因与Chan等[18]报道的β-葡萄糖苷酶基因cba4序列相似度为42.83%,可能是一个新酶的编码基因。
总之,本研究筛选到纤维降解活性较强的Cellulomonassp. h9菌株,根据全基因组测序结果,分析了其潜在的纤维素降解酶基因,且已有多个基因进行了功能验证,后续实验有望进一步验证其他基因的功能,就酶的性质,以及各酶之间的协同反应等方面进行深入研究,以期阐释菌株降解纤维素的机制。
