不同来源乳酸菌核苷降解能力研究
2021-06-27王垚李文静鲁茂林张臣臣马文龙顾瑞霞
王垚,李文静,鲁茂林,张臣臣,马文龙,顾瑞霞
(扬州大学江苏乳品生物技术与安全控制重点实验室,江苏扬州 225127)
0 引 言
体内核苷代谢紊乱导致尿酸产生过多或尿酸排泄减少时,容易引发高尿酸血症(Hyperuricemia,HUA),严重影响人们健康和生活质量[1-3]。通过严格的饮食控制,减少富含核苷类食物的摄入,是治疗高尿酸血症的一种方法;也可以通过别嘌呤醇或非布索坦等西药,抑制尿酸合成途径中关键酶黄嘌呤氧化酶的活性,达到降尿酸的目的。但是由于严格的饮食控制,降低患者生活质量,难以长期坚持,不能达到预期的效果[4-5];别嘌呤醇等西药虽然疗效好,但存在较大的副作用,在临床治疗上的应用受到一定限制;因此,探索安全、有效的降尿酸方案十分必要[6]。
乳酸菌作为肠道固有有益菌群,在食品、保健品和药品等领域有着广泛的应用,乳酸菌能够水解、吸收食物中的核苷类物质,调节肠道菌群,从而减少尿酸的合成,在治疗高尿酸血症上具有药物治疗无可比拟的优点[7-9]。近年来国内外对益生乳酸菌在辅助治疗HUA方面的研究越来越多,如日本明治乳业株式会社的研究表明,格氏乳杆菌PA-3能够胞外降解核苷,吸收核苷进入胞内,降低肠道对核苷类物质的吸收,达到降低血尿酸的效果[10-12]。但纵观目前国内关于降尿酸乳酸菌的研究发现,国内研究与日本等国差距较大,获得高效降解能力菌株也十分有限,产业化更是空白,因此加大对具备降尿酸功能乳酸菌的研究,具有较大应用价值。发酵食品和人体肠道是常见乳酸菌的两种主要来源,发酵食品源乳酸菌种类丰富,人源乳酸菌安全性相对较高,是当今乳酸菌主要的研究方向和重点。由于婴儿与老人摄入的食物结构存在较大差异,其体内的人源乳酸菌的种属和功能特性也有区别。因此本研究从核苷降解率和核苷降解速率两个方面,考察了健康婴儿肠道、健康长寿老人肠道和传统发酵食品三种不同来源的共172株乳酸菌的核苷降解能力,并对其核苷降解能力之间的差异进行分析,以期为后续筛选出核苷降解能力强、具备缓解高尿酸血症的益生乳酸菌提供参考。
1 材料与方法
1.1 实验材料
1.1.1 实验菌株
本研究所用到的172株乳酸菌均由江苏省乳品生物技术与安全控制实验室分离保藏,包含健康婴儿肠道来源的乳酸菌73株,健康长寿老人肠道来源的乳酸菌25株,泡菜、辣白菜、腌萝卜和乳扇等传统发酵食品来源的乳酸菌74株。
1.1.2 主要试剂
鸟苷、肌苷、鸟嘌呤、黄嘌呤、次黄嘌呤、黄嘌呤氧化酶均购自Sigma-Aldrich中国贸易有限公司。实验中用到的其他有机试剂、无机试剂购自国药集团。
1.1.3 主要仪器
PL2002(1/100)分析天平,Mettler Toledo;JF-SX-500全自动灭菌锅,TIMY;Millipore Direct 8超纯水仪,Millipore;ZHJH-C1209B超净工作台,苏州净化设备;SPX-150BS-Ⅱ生化培养箱,上海新苗医疗器械;5804R高速冷冻离心机,Eppendorf;1260 Infinity高效液相色谱仪,Agilent。
1.2 实验方法
1.2.1 溶液配制
鸟苷-肌苷-黄嘌呤-次黄嘌呤(Guanosine-Inosine-Xanthine-Hypoxanthine,GS-IS-X-HX)标准品溶液:准确称取0.025 g鸟苷、肌苷、黄嘌呤、次黄嘌呤,用20 mmol/L的KH2PO4溶液(pH 7.0)定容至50 mL,配制成GS-IS-X-HX母液,梯度稀释得浓度分别为0.5、0.2、0.05、0.02、0.005、0.002 g/L的混合标准品溶液。
鸟嘌呤(Guanine)标准品溶液:由于常温下0.025 g鸟嘌呤在50 mL的KH2PO4溶液(pH 7.0)中无法完全溶解,故配制鸟嘌呤标准品溶液时,称取0.0125 g鸟嘌呤,用20 mmol/L的KH2PO4溶液(pH 7.0)定容至50 mL,配制成鸟嘌呤母液,梯度稀释得浓度分别为0.25、0.1、0.025、0.01、0.0025、0.001 g/L的鸟嘌呤标准品溶液。
鸟苷-肌苷(Guanosine-Inosine,GS-IS)缓冲液:准确称取鸟苷0.02 g、肌苷0.02 g,用20 mmol/L KH2PO4溶液(pH 7.0)定容至100 mL并调节pH至7.0,最终缓冲液中鸟苷浓度为0.2 g/L(0.706 mmol/L),肌苷浓度为0.2 g/L(0.746 mmol/L)。
反应终止剂:0.1 mol/L高氯酸溶液,取571μL HClO4(70%),用超纯水定容至100 mL。
1.2.2 菌株活化
将待试菌株在平板上划线分离单菌落,挑单菌落接种至5 mL液体MRS培养基,37℃静置培养24 h,作为活化一代菌株;再将一代菌株以4%接种量转接至5 mL液体MRS培养基中,37℃静置培养24 h,作为活化二代菌株,取活化二代菌株用于后续试验。
1.2.3 核苷和嘌呤测定方法优化
鸟苷、肌苷、鸟嘌呤、黄嘌呤和次黄嘌呤的含量采用高效液相色谱(High Performance Liquid Chromatograph,HPLC)法检测,并对检测方法进行优化[10];通过外标法确定标准品的保留时间,绘制标准曲线。所用液相色谱仪为Agilent 1260,流动相为等梯度20 mmol/L磷酸二氢钾溶液(pH 3.0),流动相优化的过程中分别添加了1%、3%、5%和10%的甲醇,流速为1 mL/min,柱温25°C,次黄嘌呤、黄嘌呤、肌苷、鸟苷的检测波长为254 nm,腺嘌呤为263 nm,鸟嘌呤为273 nm,色谱柱优化过程中选择了ZORBAX SB-C18、Dubhe-C18和Chrom Core Polar C18。
1.2.4 核苷降解率的测定
采用磷酸盐缓冲液体系评价不同乳酸菌对鸟苷和肌苷的降解率[13]。取适量活化二代菌培养液,室温4 500 r/min离心3 min,弃上清,收集菌体,菌体用无菌生理盐水(0.9%NaCl溶液)洗涤2次,向清洗后的菌体中加入1 mL GS-IS缓冲液,混合均匀,控制缓冲液中菌浓OD600为1.5,37℃静置孵育4 h。孵育后,取1 mL菌液,于4℃,4 500 r/min离心3 min,取上清810μL,加入90μL反应终止剂0.1 mol/L高氯酸溶液,混合均匀后4 500 r/min离心3 min,取上清液使用0.22μL水相滤膜过滤后用于HPLC检测,分析反应液中鸟苷和肌苷的减少量,以及鸟嘌呤、黄嘌呤和次黄嘌呤的生成量。
1.2.5 核苷降解速率的测定
采用磷酸盐缓冲液体系考察不同乳酸菌对核苷的降解速率[14]。选择可以完全或者几乎完全降解鸟苷和肌苷的乳酸菌株56株,在MRS培养基中活化后,取活化二代菌培养液,离心收集菌体,用无菌生理盐水洗涤2次,重悬于含0.2 g/L鸟苷的磷酸盐缓冲液中,每隔30 min取样检测分析鸟苷的剩余量。
1.2.6 统计学处理
无特殊说明,相关实验均进行3次生物学平行,实验数据用分析软件SPSS进行统计分析,分析结果用Origin绘制图形。
2 结果与分析
2.1 核苷与嘌呤检测方法优化
开展乳酸菌核苷降解能力研究,首先必须建立核苷及其代谢产物嘌呤的检测方法,常用HPLC测定方法。结合研究室实际条件和文献报道[15-16],本文在安捷伦1260液相色谱仪的基础上,比较了3种色谱柱对于鸟苷、肌苷及其降解产物的检测效果,检测条件及结果如表1所示,色谱峰如图1所示。
从表1和图1A可以看出,反相色谱柱ZORBAX SB-C18不能有效分离鸟嘌呤、黄嘌呤、次黄嘌呤和腺嘌呤,反相色谱柱Dubhe-C18不能有效分离腺嘌呤和鸟嘌呤,如图1B,反相色谱柱ChromCore Polar C18可以较好的分离腺嘌呤、鸟嘌呤、次黄嘌呤和黄嘌呤,其出峰时间分别为6.9、7.9、9.4、12.1 min,如图1C,而且反相色谱柱ChromCore Polar C18对肌苷和鸟苷的分离度也较好,出峰时间分别为24.4 min和28.7 min,但肌苷和鸟苷出峰时间较长,影响样品检测效率;为进一步缩短检测时间,优化了流动相中甲醇含量,以增加反相色谱柱的洗脱能力,如图1D所示,流动相中添加1%甲醇,可将肌苷和鸟苷的出峰时间提前至17.9 min和21.6 min,继续增加甲醇含量至3%、5%和10%(数据未列出),仅能略微提前肌苷与鸟苷的出峰时间,且增加检测成本,因此确定流动相甲醇添加量为1%。

图1 核苷与嘌呤检测方法优化

表1 不同色谱柱检测条件及分离效果
经优化后,选择反相色谱柱ChromCore Polar C18,以KH2PO4(0.02 mol/L)∶甲醇=99∶1为流动相,经等度洗脱,可有效分离腺嘌呤、鸟嘌呤、次黄嘌呤、黄嘌呤和鸟苷、肌苷,25 min即可完成一个样品的定性检测和定量分析。
2.2 不同来源乳酸菌核苷降解率分析
对从婴儿肠道、长寿老人肠道和发酵食品中分离获得的172株乳酸菌的鸟苷和肌苷降解率进行了测定,结果如图2所示。
从图2可以看出,73株婴儿肠道源乳酸菌中,94.5%的菌株鸟苷和肌苷降解率低于50%,仅4株菌的鸟苷和肌苷降解率为100%,占比5.5%,如图2A;25株长寿老人肠道源乳酸菌中,17株乳酸菌鸟苷和肌苷降解率为100%,占比为68.0%,显著高于婴儿肠道源乳酸菌中5.5%的比例,如图2B;在74株传统发酵食品来源的乳酸菌中,35株乳酸菌鸟苷和肌苷降解率为100%,占比为47.3%,高于婴儿肠道源乳酸菌中5.5%的比例,但同样显著低于长寿老人肠道源乳酸菌中68%的比例,如图2C。结果表明,长寿老人肠道源乳酸菌可以完全降解鸟苷和肌苷的概率大于传统发酵食品源和婴儿肠道源乳酸菌中的概率,更适于筛选核苷降解率高的乳酸菌。
同时,研究过程中发现3种不同来源的172株乳酸菌的鸟苷和肌苷降解率呈现强正相关性(r=0.989,P<0.01),如图2D,即鸟苷降解率高的菌株,其肌苷降解率也高,进而基于Kyoto Encyclopedia of Genes and Genomes(KEGG)对不同种属乳杆菌的核苷代谢途径进行解析,发现乳杆菌中催化鸟苷、肌苷、腺苷降解的为同一个酶,嘌呤核苷磷酸化酶(purine-nucleoside phosphorylase,PNP),这从代谢水平上解释了同一菌株鸟苷降解率和肌苷降解率之间的强正相关关系。虽然本文没有测定菌株对腺苷的降解率,但基于以上分析,可以推测腺苷降解率和鸟苷、肌苷降解率同样成正相关关系,鸟苷、肌苷降解率高的菌株,其腺苷降解率也高。由于同一菌株的鸟苷和肌苷降解率呈现强正相关性,所以在考察不同来源菌株的核苷降解速率时,仅选择以鸟苷降解速率为代表。
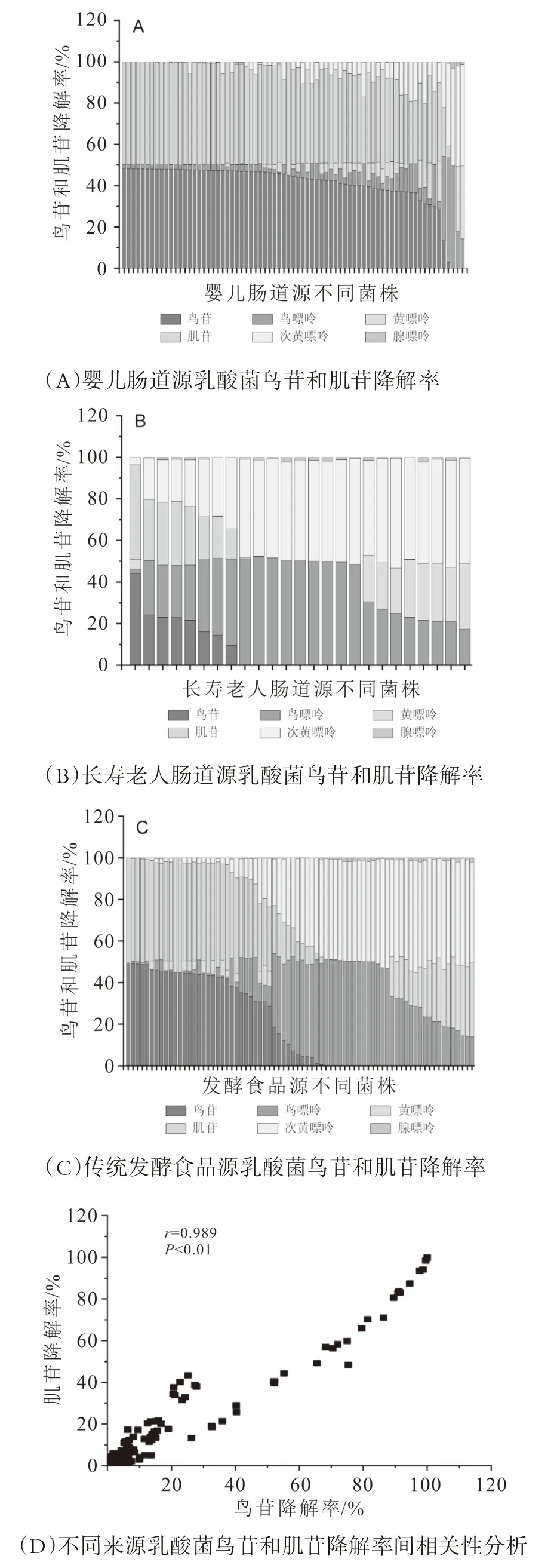
图2 不同来源乳酸菌鸟苷和肌苷降解率分析
2.3 不同来源乳酸菌鸟苷降解速率分析
选择上述鸟苷和肌苷降解率为100%的56株乳酸菌,活化后重悬于含0.2 g/L鸟苷的磷酸盐缓冲液中,每隔30 min取样检测反应体系中剩余的鸟苷含量,计算鸟苷降解速率,结果如图3所示。
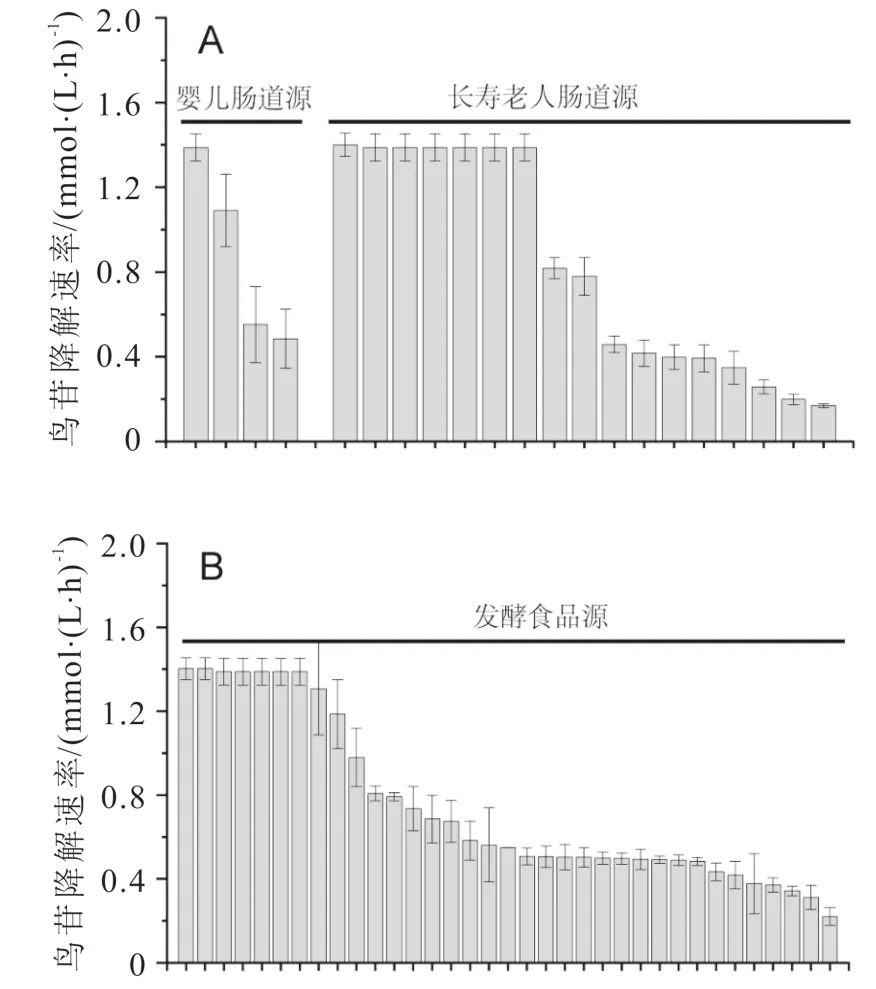
图3 不同来源乳酸菌鸟苷降解速率分析
从图3可以看出,婴儿肠道来源的4株乳酸菌中,仅1株菌在30 min内可以完全降解鸟苷,降解速率大于1.40 mmol/(L·h),其余3株菌的鸟苷降解速率低于1.1 mmol/(L·h);长寿老人肠道来源的17株乳酸菌中,鸟苷降解速率大于1.40 mmol/(L·h)的菌株共7株,占比41.2%;发酵食品来源的35株乳酸菌中,鸟苷降解速率大于1.40 mmol/(L·h)的菌株共7株,占比20.0%;这表明,在可以完全降解鸟苷、肌苷的乳酸菌中,长寿老人肠道源乳酸菌鸟苷降解速率大于1.40 mmol/(L·h)的概率显著高于婴儿肠道源乳酸菌和传统发酵食品源乳酸菌中相应概率,更适于筛选核苷降解速率快的乳酸菌。
3 结 论
本文以核苷降解率和核苷降解速率为评价指标,考察了婴儿肠道、长寿老人肠道和传统发酵食品3种不同来源乳酸菌的核苷降解能力,并比较了不同来源菌株核苷降解能力之间的差异。通过研究发现,(1)长寿老人肠道源乳酸菌中68.0%的菌株可以完全降解鸟苷和肌苷,所占比例最高,显著高于发酵食品源(47.3%)和婴儿肠道源乳酸菌中相应比例(5.5%);(2)长寿老人肠道源可以完全降解鸟苷和肌苷的乳酸菌中,41.2%的菌株鸟苷降解速率大于1.40 mmol/(L·h),所占比例同样显著高于发酵食品源(20.0%)和婴儿肠道源乳酸菌中相应比例(25.0%);(3)3种不同来源的172株乳酸菌的鸟苷和肌苷降解率呈现强正相关性。这些研究结果表明,长寿老人肠道源乳酸菌具有较高的核苷降解能力,婴儿肠道源乳酸菌核苷降解能力普遍较弱,长寿老人肠道源乳酸菌更适宜筛选核苷降解能力强、具备降尿酸潜力的益生乳酸菌,这为筛选可缓解高尿酸血症的益生乳酸菌提供一定指导。
