非小细胞肺癌进展过程中miR-203对ABCE1的调节作用
2021-06-27周镝田野杨雪鹰
周镝,田野,杨雪鹰
(中国医科大学附属第四医院胸外科,沈阳 110032)
肺癌是高发病率和高死亡率的恶性肿瘤,自2018年以来,全球每年约有177万人死于肺癌[1]。其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占所有肺癌病例的80%。在过去的几十年里,NSCLC的诊断和治疗水平得到了较大的提升,然而,只有约16%的患者能够在早期得到诊断和治疗,肺癌的5年生存率仍然低于20%[2]。因此,寻找更有价值的生物标志物和探索新的治疗靶点是NSCLC治疗中亟待解决的问题。
微RNA(microRNAs,miRNAs)是一种小的非编码RNA分子,通过与相应的靶点信使RNA(messenger RNA,mRNA)的3’非翻译性区域(3’untranslation region,3’UTR)直接相互作用来调控基因表达[3],与肿瘤的发生发展相关。研究[3]表明,miRNAs的错误表达与多种人类癌症相关,有学者将其定义为肿瘤抑制因子或抑癌基因。本课题组前期研究发现,miR-29a/b/c、miR-135a、miR-203在NSCLC中均出现了不同程度的表达下调[4],且有证据表明miR-203参与了多种肿瘤的发生[5-6]。但其在NSCLC发生及进展中的作用和机制尚不清楚。本研究通过检测miR-203在人NSCLC组织中的表达情况,结合体外实验,进一步研究miR-203在NSCLC中的作用,以期为NSCLC的治疗提供依据。
1 材料与方法
1.1 样本采集
选取2018年至2019年于我科接受手术治疗的NSCLC患者20例,术中留取新鲜NSCLC组织及其对应的癌旁组织。所有患者均签署知情同意书。本研究符合赫尔辛基宣言,并获得中国医科大学第四附属医院伦理委员会批准。
1.2 细胞培养与分组
人NSCLC细胞系H1650和LTEP-a-2购自中国科学院细胞库(上海)。细胞培养于含10%胎牛血清的DMEM高糖培养基中,在37 ℃、5% CO2细胞培养箱中常规培养。每2 d传代1次。将细胞分为对照组和miR-203过表达组2组。
1.3 方法
1.3.1 RNA提取、逆转录、实时定量聚合酶链反应:用TRIzol试剂(美国Invitrogen公司)提取总RNA。按照PrimeScript RT试剂试剂盒(日本TaKaRa公司)说明书进行互补DNA合成。采用正向引物5’-TCAAACTT CACAGGTTGCC-3’和反向引物5’-GATCATGTTCCA CCACAATG-3’检测ABCE1转录水平。β-actin作为内参,正向引物序列为5’-AGACCTGTACGCCAACAC AG-3’,反向引物序列为5’-CGGACTCGTCATACTC CTGC-3’。根据说明书,使用TaqMan miRNA分析(美国Applied Biosystems公司)试剂盒检测成熟miR-203的表达水平,并使用U6小核RNA作为内参。
1.3.2 细胞转染:将处于对数生长期的LTEP-a-2细胞按照3×105/孔接种于6孔板中,在细胞培养箱中过夜。用2 mL不含血清的DMEM培养基饥饿处理4 h。在200 μL无血清DMEM培养基中加入2 μg DNA和2 μL PLUS试剂,室温孵育10 min,然后加入200 μL无血清DMEM培养基加入6 μL LTX试剂,配制成转染工作液,室温孵育30 min。弃掉孔中培养基,加入转染工作液并将6孔板置于细胞培养箱中孵育。4 h后加入200 μL胎牛血清。转染24~48 h后,进入功能试验。
1.3.3 划痕实验:取出6孔板,用1 mL移液器吸头在孔中垂直作一划痕。用PBS清洗细胞3次,随后加入不含血清的DMEM培养基,拍照。将6孔板置于细胞培养箱中培养,24 h后取出拍照。
1.3.4 流式细胞术检测细胞凋亡:细胞处理24 h后,移去培养基,更换成无血清培养基,常规条件下培养饥饿24 h。收集细胞到离心管中,1 000 r/min离心5 min,加入4 ℃预冷的PBS重悬细胞,再次离心沉淀细胞,小心吸除上清。加入1×结合缓冲液重悬细胞,调节细胞密度为(1~5)×106/mL。取100 μL细胞悬液至于5 mL流式管中,加入5 μL Annexin V/FITC 混匀后于室温避光孵育5 min,加入10 μL PI染液,并加入400 μL PBS后进行上机检测。采用Flowjo软件对流式结果进行分析处理。
1.4 统计学分析
采用SPSS 18.0统计分析软件对数据进行分析。计量资料以表示,组间比较采用t检验,P< 0.05为差异有统计学意义。
2 结果
2.1 miR-203及ABCE1在NSCLC及癌旁组织的表达
采用实时PCR对20例NSCLC及癌旁组织进行检测,结果显示,NSCLC组织中miR-203平均表达水平(0.369±0.338)与癌旁组织(0.575±0.450)相比明显降低,差异有统计学意义(P=0.019)。而NSCLC组织中的ABCE1表达水平(1.243±0.716),较癌旁组织(0.739±0.316)明显升高,差异有统计学意义(P=0.000 6)。
2.2 miR-203在体外负性调节ABCE1的基因表达
由于miR-203在非小细胞肺癌的组织和细胞系中表达较低,miR-203水平相对较低的肺腺癌细胞系H1650、LTEP-a-2被用来评估miR-203诱导的效果。采用miR-203 mimics模拟表达载体诱导miR-203表达,实时PCR结果显示,miR-203在H1650、LTEP-a-2中表达分别达到1.954±0.099和5.631±0.282,较对照组(1.021±0.046和0.099±0.039)均有升高,提示过表达。实时PCR结果显示,过表达miR-203在H1650和LTEP-a-2细胞中使ABCE1mRNA水平分别达到0.449±0.049和0.353±0.018,较对照组(1.009±0.156和1.005±0.060)降低50%以上,差异均有统计学意义(P< 0.05),提示miR-203能够抑制ABCE1表达。
2.3 miR-203在体外抑制NSCLC的迁移
划痕实验检测miR-203过表达对H1650和LTEP-a-2细胞迁移能力的影响。结果显示,miR-203 mimics转染的H1650和LTEP-a-2细胞迁移区域分别为0.354±0.035和0.456±0.016,与对照组(0.585±0.021、0.590±0.013)相比,转染miR-203的细胞迁移能力降低,差异有统计学意义(P< 0.05),见图1。

图1 miR-203过表达对细胞迁移能力的影响Fig.1 Effects of miR-203 overexpression on cell migration
2.4 miR-203过表达诱导体外NSCLC细胞凋亡
流式细胞学检测结果显示,miR-203 mimics转染的H1650和LTEP-a-2细胞中,凋亡细胞比例分别达到31.307%±1.420%和35.250%±0.512%,明显高于对照组(13.068%±1.364%和19.313%±0.688%),差异有统计学意义(P< 0.05),提示miR-203过表达能够促进NSCLC细胞凋亡,见图2。
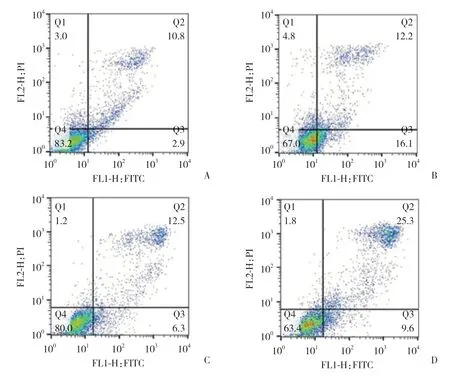
图2 miR-203过表达对H1650和LTEP-a-2细胞凋亡的影响Fig.2 Effects of miR-203 overexpression on apoptosis of H1650 and LTEP-a-2 cells
3 讨论
NSCLC的生存和预后相对较差,部分原因是复发和转移,以及对化疗、放疗和靶向治疗的耐药[7]。因此,阐明NSCLC的分子发病机制,对制定有效的干预策略至关重要。单个miRNA序列能够调控众多靶基因[8],miRNA通过调控不同的靶点来驱动肿瘤发生和进展,如miR-200、miR-34a在乳腺癌和脑膜瘤的发展过程中发挥重要作用[9-10]。本研究结果显示,miR-203在NSCLC细胞和组织表达下调,作为一个肿瘤抑制microRNA,通过抑制ABCE1途径的多个关键组件,抑制肺癌细胞生长和细胞侵袭性和转移。
miR-203是本课题组前期研究中独立筛选出的与肺癌密切相关的基因,并被证实具有确切的影响肺癌增殖、侵袭及转移等行为的功能。本文系统研究miR-203对ABCE1的调节,进一步探讨肺癌细胞增殖、凋亡的影响及机制,不仅有助于解决肺癌基础理论的相关问题,还有助于发现新的肿瘤治疗靶点。已有研究[11]表明,miR-203通过抑制GATA6的表达来降低人类结肠癌细胞的干细胞特性;在透明细胞肾细胞癌中,miR-203通过调节ZEB2参与了上皮-间充质转化通路的激活[12];miR-203在食管癌细胞中是一种肿瘤抑制因子,其表达水平有可能被用作食管癌患者预后的预测指标[13]。以上均提示miR-203的功能依赖于肿瘤细胞。本研究结果表明,miR-203在NSCLC细胞系和肿瘤组织中的表达明显降低。这一数据提示miR-203在调控多种信号通路方面发挥着核心作用,对于肺癌药物的开发具有潜在意义。
ABCE1是ATP结合盒超家族的成员之一,但是缺乏该家族其他转运蛋白所共有的跨膜区域,因此不参与任何跨膜转运功能。近年来,随着对ABCE1基因深入的研究,有证据表明该基因可能与肿瘤的形成、转移和预后相关[14]。最新的报道[15]显示,ABCE1对于肺癌化疗的敏感性有重要的作用。前期工作中本课题组应用RNA干扰技术特异性敲除ABCE1的表达后,发现其抑制了肺腺癌细胞、小细胞肺癌细胞的增殖及侵袭能力,并诱导细胞凋亡。目前,除了负性调节2-5A/ RNase L通路以及参与蛋白翻译过程[16],ABCE1基因的机制研究不多,其在肿瘤内乃至肺癌内的作用机制和细胞通路尚未明确。
综上,本研究首次筛选出NSCLC组织内能够有效调节ABCE1基因的 miR-203,并证实miR-203在肺癌内表达的减少降低了对ABCE1基因的负性调节,从而促进了肺癌侵袭和转移,抑制了凋亡。miR-203及其调节的ABCE1基因很有可能作为新的突破口,为肺癌的诊治提供新的思路。
