UPLC-MS/MS法研究黄芪甲苷对大鼠体内阿德福韦毒代动力学及肾转运的影响
2021-06-26刘俊瑾邵云云常壮鹏侯锐钢贾晋生
郑 圆,刘俊瑾,许 丁,邵云云,张 晓,常壮鹏,侯锐钢,贾晋生
(1.山西医科大学药学院,山西 太原 030001;2.山西医科大学第二医院药剂科,山西 太原 030000;3.山西医科大学附属晋煤集团总医院药剂科,山西 晋城 048006)
阿德福韦酯是一类新型的核苷酸类反转录酶抑制剂,因价格低廉、耐药率低等优点常作为临床治疗慢性乙型肝炎的一线用药[1-2]。然而,患者长期服用阿德福韦酯后易产生肾蓄积,进而损伤肾功能。临床数据显示,阿德福韦酯可使24%慢性乙型肝炎患者产生严重肾损伤[3]。亚太肝病学会制定的《乙型肝炎临床实践指南》中也建议应用阿德福韦酯治疗的患者至少应当每3个月检查一次肾功能[4]。严重的肾毒性限制了阿德福韦酯的临床应用,因此,探究其毒理机制、寻找可靠的治疗策略成为亟待解决的科学问题。
阿德福韦酯为前体药物,口服吸收后在非特异性酯酶作用下迅速水解为阿德福韦而发挥药效,显著提高了母体药物的生物利用度。阿德福韦不经肝代谢,主要通过肾小球滤过和肾小管主动分泌的方式经肾排泄清除。有学者指出,肾小管上皮细胞有机阴离子转运体(organic anion transporters,Oat)介导阿德福韦从血液进入肾小管上皮细胞,随后经多药耐药转运体(multidrug resistance transporters,Mrp)介导进入肾小管内并随尿液排泄,其肾蓄积主要与Oat对其的摄取作用增加和(或)Mrp对其的外排减少有关[5-7]。
近年来,关于中药与西药联合使用发挥减毒增效作用的报道不断增加,中药辅助西药成为临床用药的新方法。中药黄芪具有补气升阳、益卫固表和利水消肿之功效[8]。黄芪甲苷作为黄芪的主要活性成分之一,具有降血糖[9]、肾保护[10]和抗病毒[11]等多种作用。研究表明,黄芪甲苷在改善顺铂引起的肾损伤及糖尿病所致肾损伤等方面已具有广泛的应用[12-13]。我们前期研究发现,黄芪甲苷可显著改善阿德福韦引起的肾小管扩张及空泡样变,疗效显著[14]。然而,黄芪甲苷能否影响阿德福韦的体内处置过程,减少其肾蓄积进而改善肾损伤尚不清楚。因此,本研究利用超高效液相色谱-串联质谱法(ultra performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)测定大鼠血浆和肾组织中阿德福韦浓度,研究黄芪甲苷对阿德福韦毒代动力学的影响及其降低阿德福韦肾蓄积的机制。
1 材料与方法
1.1 药物、试剂和主要仪器
阿德福韦(批号:M0710AS,纯度≥99%),大连美仑生物技术有限公司;卡马西平(批号:M0901AS,纯度≥99%),大连美仑生物技术有限公司;阿德福韦酯(批号:RH161771,纯度≥98%),上海凛恩科技发展有限公司;黄芪甲苷(批号:HQJG20180629,纯度≥98%),南京春秋生物工程有限公司;羧甲基纤维素钠,天津市福晨化学试剂厂;总RNA提取试剂、逆转录试剂盒和荧光定量PCR预混试剂,北京聚合美生物科技有限公司;Oat1,Oat3,Mrp2,Mrp4和GAPDH引物,上海生工生物工程股份有限公司;生理盐水(36.5%),石家庄四药有限公司;甲醇(色谱纯),美国Fisher公司;超纯水(自制),山西医科大学第二医院。
电子分析天平(SQP型QUINTIX224-1CN),德国Sartorius公司;高速冷冻离心机(D-37520 Osterode),德国Biofuge公司;涡旋仪(Vortex-5),海门市 Kylin-bell公司;超声仪(SB3200),上海Branson公司;真空干燥箱(DZF-6050),苏州江东精密仪器有限公司;三重四级杆复合线性离子肼质谱仪(Q-TRAP 5500),美国AB Sciex公司;超高效液相色谱仪(LD-30A),日本Shimadzu公司;实时荧光定量PCR仪(StepOne Plus),美国Applied Biosystem公司;电动玻璃匀浆机(DY89-Ⅱ),宁波新芝生物科技股份有限公司。
1.2 动物
30只SPF级SD雄性大鼠,体重130~170 g,购于中国食品药品检定研究院实验动物中心,实验动物生产许可证号:SCXK(京)2014-0013,合格证号:No.1103242011013993。本实验经过了山西医科大学第二医院实验动物伦理委员会审查批准(批准号:2015KS001)。饲养条件为室温20~25℃,湿度50%~70%,明暗交替12 h/12 h,大鼠适应性喂养一周,期间自由摄食和饮水。
1.3 溶液配制
对照品溶液配制:取阿德福韦对照品适量,精密称定,加甲醇-水(3∶7,V/V)配制成浓度为1.0 g·L-1的对照品储备液,-20℃冰箱保存。临用前,用甲醇-水(3∶7,V/V)梯度稀释对照品储备液,配制成系列浓度的工作液。取内标(卡马西平)对照品适量,精密称定,加甲醇配制成1.0 g·L-1的对照品储备液,-20℃冰箱保存。临用前,用甲醇稀释对照品储备液,配制成50 μg·L-1的内标工作液。
标准曲线及质控样品配制:将10 μL相应阿德福韦工作液加入到90 μL空白大鼠血浆中,配制浓度为3.91,7.81,15.63,31.25,62.50,125.00,250.00和500.00 μg·L-1的阿德福韦含药血浆,同样的方法配成浓度为7.81,62.50和250.00 μg·L-1的血浆质控样品。
1.4 毒代动力学测定
12只SD雄性大鼠随机分为2组:阿德福韦组和黄芪甲苷干预组,每组6只。以适量1%羧甲基纤维素钠溶液将阿德福韦酯和黄芪甲苷分别制成10 g·L-1的混悬液。大鼠禁食12 h后,2组分别ig给予阿德福韦酯(30 mg·kg-1)和阿德福韦酯+黄芪甲苷(各30 mg·kg-1)。分别于给药后0,1,1.5,2,3,4,6,8,12和 24 h经大鼠眼眶静脉丛取血约0.5 mL,在1522×g,4℃条件下离心10 min,分离血浆,置于-20℃冰箱冷冻备用。取血浆样品100 μL置于1.5 mL离心管中,加入内标工作液10 μL,涡旋5 s,加入甲醇300 μL,涡旋震荡3 min,在16 074×g,4℃条件下离心10 min,吸取上清液50 μL至另一1.5 mL离心管中,37℃真空干燥。残渣用100 μL甲醇-水(3∶7,V/V)复溶,涡旋3 min,在16 074×g,4℃条件下离心10 min,吸取上清液稀释20倍后转移至自动进样器样品瓶中进行UPLC-MS/MS分析。
1.5 肾转运实验
18只SD雄性大鼠随机分为3组:生理盐水正常对照组、阿德福韦组和黄芪甲苷干预组,每组6只。用适量1%羧甲基纤维素钠溶液将阿德福韦酯、黄芪甲苷分别制成10 g·L-1的混悬液。大鼠禁食12 h后,正常对照组和阿德福韦组ig给予生理盐水,黄芪甲苷组ig给予黄芪甲苷30 mg·kg-1,每天1次,连续35 d;第8天时,除正常对照组ig给予生理盐水外,其余各组ig给予阿德福韦酯30 mg·kg-1,每天1次,连续28 d。麻醉处死大鼠取肾组织,置于-20℃冰箱冷冻保存备用。精密称取肾组织0.2 g,加入0.5 mL生理盐水匀浆,在16 074×g,4℃条件下离心10 min,收集上清液后,按照血浆样品处理方法进行处理。
1.6 色谱和质谱条件
色谱条件:Kinetex XB-C18色谱柱(2.1 mm×100 mm,2.6 μm),流动相为0.1%甲酸溶液(A)和甲醇(B);梯度洗脱:0~1.0 min,30%B~70%B;1.0~3.3 min,70%B~50%B;3.3~3.5 min,50%B~30%B;3.5~4.2 min,30%B;流速:0.3 mL·min-1;柱温:25℃;进样量:5 μL。
质谱条件:采用电喷雾离子化(electrospray ionization,ESI)正离子模式,优化去簇电压(declus⁃tering potential,DP)、入口电压(entrance poten⁃tial,EP)、碰撞能(collision energy,CE)和碰撞室出口电压(collision cell exit potential,CXP)参数,其他参数为:离子化电压:+5500 V;气帘气:40 psi;喷雾气:50 psi;辅助加热气:50 psi;温度:500℃;多反应监测(multiple reaction monitoring,MRM)扫描模式进行定量检测。
1.7 实时荧光定量PCR法检测大鼠肾组织中Oat1,Oat3,Mrp2和Mrp4 mRNA表达水平
按照总RNA提取试剂盒说明书,采用Trizol法提取大鼠肾组织总RNA,酶标仪测定其浓度和纯度,根据反转录试剂盒操作说明将总RNA逆转录成第一链cDNA,按照PCR试剂盒操作说明进行扩增。采用20 μL反应体系,反应条件为95℃预变性15 min,95℃变性 10 s,61℃退火 31 s,72℃延伸30 s,共50个循环。以GAPDH作为内参基因,2-ΔΔCt法计算待测样本mRNA表达水平。基因引物序列见表1。

Tab.1 Gene primer sequences used in real-time PCR
1.8 统计学分析
2 结果
2.1 分析条件优化
2.1.1 质谱条件
分别在正、负离子模式下对分析物阿德福韦进行检测。结果表明,阿德福韦和内标卡马西平均对正离子模式有更高的灵敏度和稳定性,母离子与子离子的质荷比分别为:m/z274.2→m/z162.2(阿德福韦)和m/z237.1→m/z194.1(内标卡马西平)(图1),质谱主要参数的优化条件见表2。
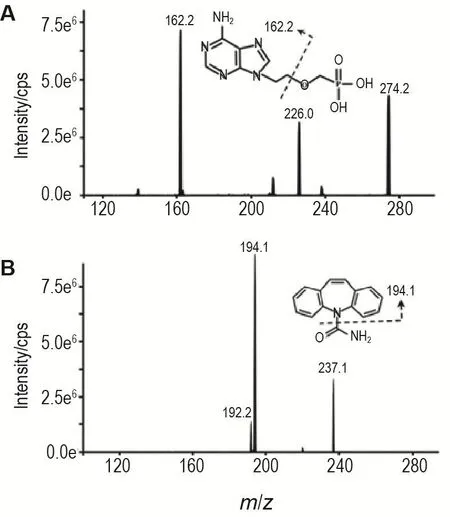
Fig.1 Mass spectrometry characteristic ion diagram and chemical structure formula of adefovir(Adv)(A)and internal standard carbamazepine(B).
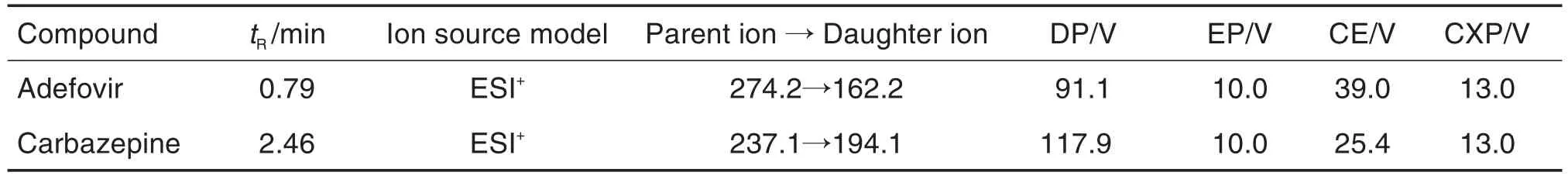
Tab.2 Main mass spectrometric parameters of Adv and internal standard carbazepine
2.1.2 液相条件的优化
分别尝试了不同比例甲酸(0.1%~0.3%)-水和甲醇或乙腈等多种组合作为流动相。结果表明,0.1%甲酸-水和甲醇作为流动相可以使分析物阿德福韦和内标卡马西平有更好的分离度,并且可以有效改善色谱峰的峰型(图2),阿德福韦和内标卡马西平的保留时间分别为0.79和2.46 min。
2.2 方法学验证
2.2.1 标准曲线和线性范围
按1.3配制标准含药血浆,按1.4方法处理后进行UPLC-MS/MS分析。以阿德福韦与卡马西平峰面积之比为纵坐标,阿德福韦浓度为横坐标进行线性回归,得到回归方程为y=0.00003x+0.0006,r=0.9992,表明阿德福韦在 3.91~500.00 μg·L-1范围内线性关系良好。大鼠血浆中阿德福韦的最低定量限(lower limit of quantification,LLOQ)可以达到3.91 μg·L-1(信噪比>10)。
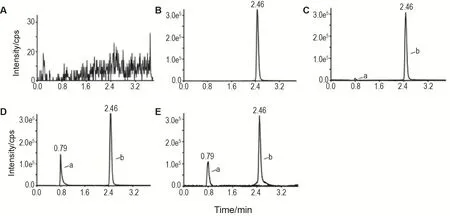
Fig.2 Typical multiple reaction monitoring(MRM)chromatograms of Adv(a)and internal standard carbamaze⁃pine(IS,b)in rat plasma.A:blank rat plasma sample;B:blank rat plasma sample spiked with IS(50 μg·L-1);C:blank rat plasma sample spiked with Adv(LLOQ,3.91 μg ·L-1)and IS(50 μg ·L-1);D:blank rat plasma sample spiked with Adv(ULOQ,500 μg·L-1)and IS(50 μg·L-1);E:a rat plasma sample collected at 3 h after ig administration of Adv dipivoxil(30 mg·kg-1)spiked with IS(50 μg·L-1).
2.2.2 准确度和精密度
按1.3配制7.81,62.50和250.00 μg·L-13个浓度质控样品,每个浓度5个平行样,按1.4方法处理,分别在同一天和连续3 d进行UPLC-MS/MS分析。以相对误差(relative error,RE)表示方法的准确度,相对标准偏差(relative standard deviation,RSD)表示方法的精密度。由表3可见,批内和批间准确度分别为-6.40%~-0.91%和-5.25%~-3.32%,批内和批间精密度分别为1.98%~6.80%和1.66%~7.41%,均满足生物样品分析的要求。
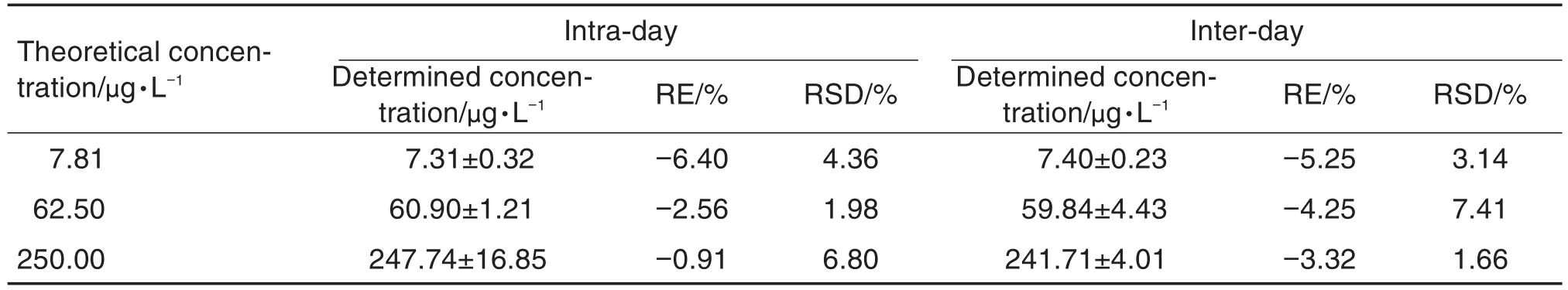
Tab.3 Accuracy and precision of Adv in rat plasma
2.2.3 基质效应
分别在6批不同来源的空白血浆中加入甲醇,进行蛋白沉淀处理,于离心后的上清液中加入阿德福韦7.81,62.50和250.00 μg·L-1的质控溶液和内标溶液,其余按1.4操作。另取流动相代替空白基质同法操作。通过计算基质存在下的峰面积与不含基质的相应峰面积的比值,求算阿德福韦和内标的基质因子,二者的比值即为内标归一化的阿德福韦的基质因子。由表4可知,阿德福韦的基质效应为97.3%~100.7%(RSD≤4.32%),表明此前处理方法尚无明显的基质效应。
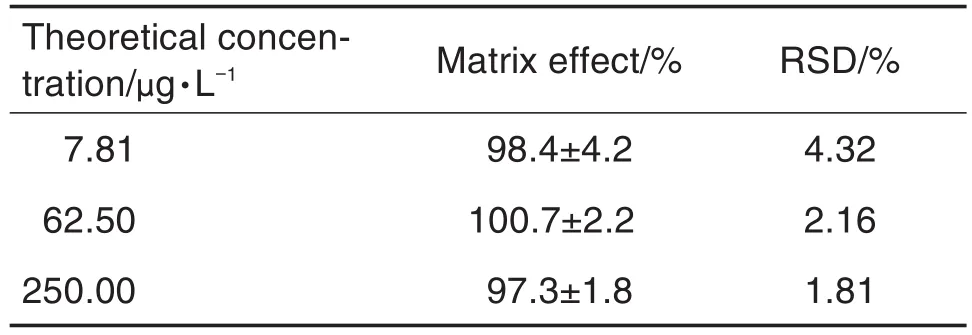
Tab.4 Matrix effect of Adv in rat plasma
2.2.4 稳定性
按1.3配制7.81,62.50和250.00 μg·L-13个浓度质控样品,分别在4℃放置24 h、-20℃放置10 d和-80℃放置21 d后取出,按1.4处理后进行UPLC-MS/MS分析。由表5可知,3种条件下阿德福韦的测定结果均在允许范围内,表明阿德福韦在储存和分析过程中具有良好的稳定性。
2.3 黄芪甲苷对大鼠体内阿德福韦毒代动力学行为的影响
基于上述建立的UPLC-MS/MS方法,进一步探究阿德福韦的血药浓度-时间曲线(图3)。经DAS 2.0软件分析后,相关毒代动力学参数见表6。结果显示,阿德福韦的血浆药-时曲线呈现单峰。与阿德福韦组相比,黄芪甲苷干预组t1/2和Tmax无统计学差异,2组阿德福韦均在给药4 h达到最大血药浓度。但黄芪甲苷干预组在给药3,4和6 h后阿德福韦血药浓度显著降低,Cmax,AUC0-t和 AUC0-∞明显减小(P<0.01),表明黄芪甲苷可明显降低阿德福韦在体内的峰浓度;Vd和Cl明显增大(P<0.01),表明黄芪甲苷可以增加阿德福韦体内分布,进而降低其血药浓度,同时黄芪甲苷也可增加阿德福韦的排泄,加快其在体内的消除。上述结果说明,黄芪甲苷可以影响大鼠体内阿德福韦的毒代动力学行为。
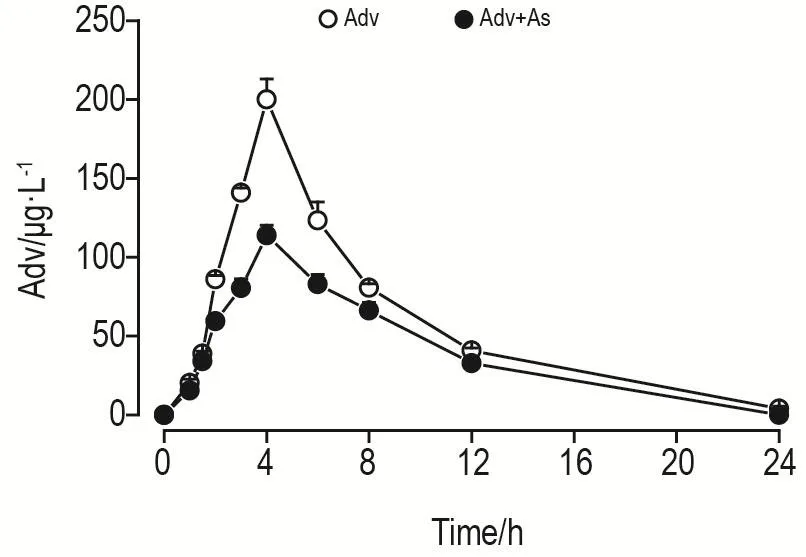
Fig.3 Plasma concentration-time curves of Adv after single administration of drugs to rats.The rats of the Adv group were administrated intragastrically with Adv dipivoxil at the dose of 30 mg·kg-1and the rats of the astragaloside inter⁃vention(Adv+As)group were administrated intragastrically with Adv dipivoxil at the dose of 30 mg·kg-1and As at the dose of 30 mg·kg-1.Blood samples were collected from the orbital venous plexus of rats at each time point at 0,1,1.5,2,3,4,6,8,12 and 24 h after single administration,respectively.±s,n=6.
2.4 黄芪甲苷对大鼠体内阿德福韦肾蓄积的影响
与大鼠体内阿德福韦组相比,黄芪甲苷干预组中肾组织阿德福韦浓度为(61±4)ng·g-1,降低(26.64±3.79)%(P<0.01),表明黄芪甲苷可以降低肾组织中阿德福韦浓度,减轻阿德福韦在肾中的蓄积。
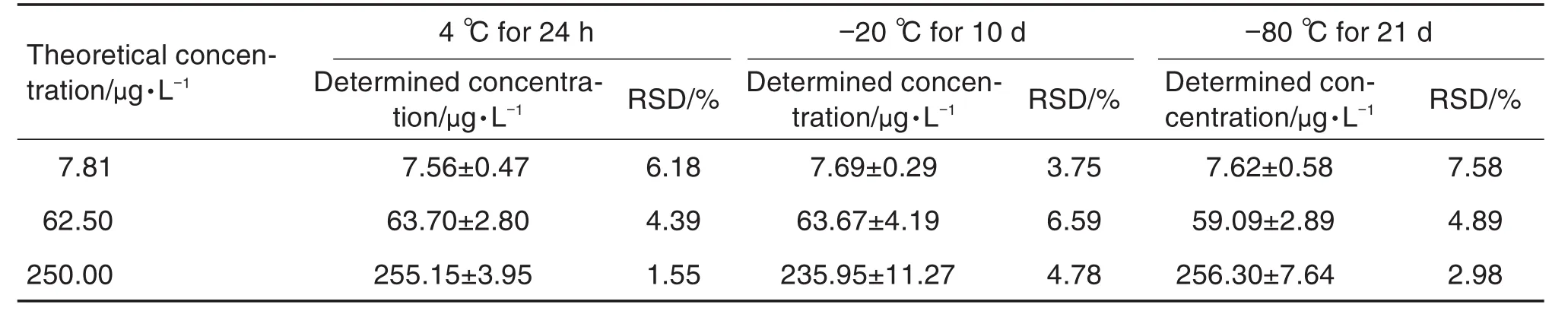
Tab.5 Stability of Adv in rat plasma
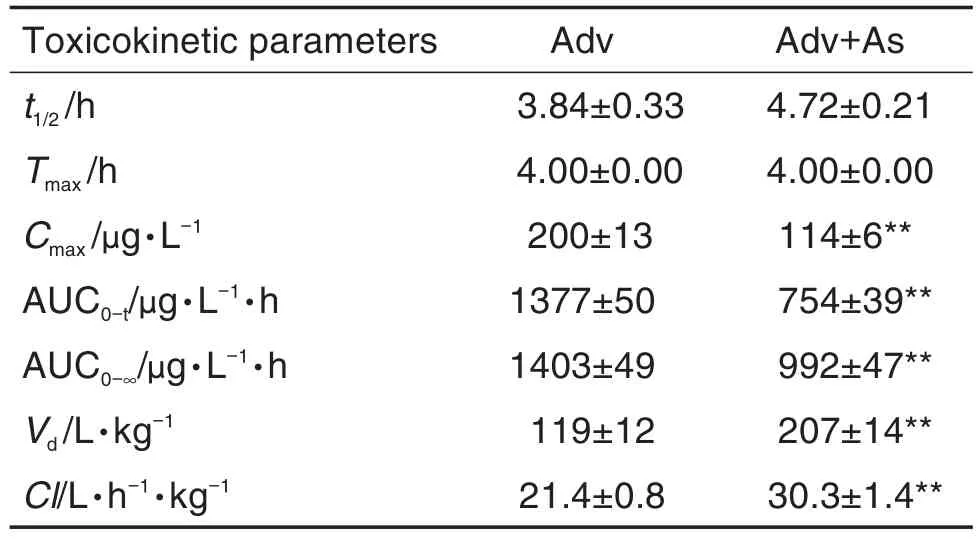
Tab.6 Toxicokinetic parameters of Adv after single administration to rats
2.5 黄芪甲苷对阿德福韦肾转运相关基因表达的影响
与盐水对照组相比,阿德福韦组大鼠肾组织中Oat1和Oat3mRNA表达明显升高(P<0.01),而Mrp2和Mrp4mRNA表达无明显变化。黄芪甲苷干预后,大鼠肾组织中Oat3mRNA表达明显降低(P<0.01),Mrp4mRNA表达明显升高(P<0.01),而Oat1和Mrp2mRNA表达无明显变化。表明阿德福韦可通过高表达Oat1和Oat3mRNA增加其在肾组织中的蓄积,黄芪甲苷通过降低Oat3mRNA表达和增高Mrp4mRNA表达减少阿德福韦在肾组织中的蓄积(表7)。
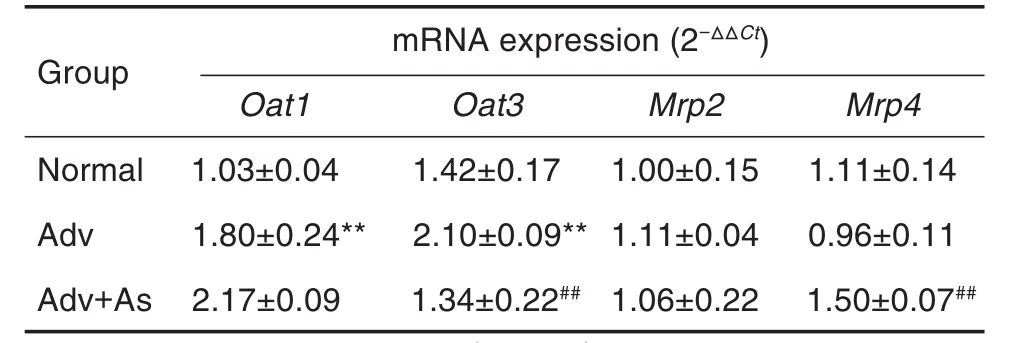
Tab.7 Effect of Adv on mRNA expressions of organ⁃ic anion transporters (Oats) and multidrug resis⁃tance transporters(Mrps)in rat renal tissue
3 讨论
本研究应用UPLC-MS/MS方法建立了大鼠血浆阿德福韦的定量方法,该方法操作简单,具有较高的灵敏度和专属性,分析物和内标分离度高且保留时间短,可以满足本实验低浓度药物测定的需要。
本研究结果显示,阿德福韦的血浆药-时曲线呈现单峰,毒代动力学符合权重因子为1/C2的二室模型,与文献报道一致[15]。峰浓度指药物给药后达到的最高血药浓度,若超出安全范围则显示毒性反应。阿德福韦与黄芪甲苷联用后,阿德福韦的峰浓度降低了43.15%,提示黄芪甲苷可以降低阿德福韦的血药浓度。血浆清除率反映机体清除药物的能力,黄芪甲苷干预后,阿德福韦的血浆清除率增加了41.50%,表明黄芪甲苷可以加快阿德福韦的消除,减少其在体内中的蓄积。毒代动力学实验结果提示,黄芪甲苷对阿德福韦的大鼠体内处置过程有一定的影响,可显著加快阿德福韦的排泄并降低其血药浓度,基于此本研究进一步探讨了其分子机制。
阿德福韦主要经肾排泄,当阿德福韦在肾中富集作用增强而排泄受阻时,会导致药物蓄积,产生肾毒性[16]。近年来大量研究表明,阿德福韦所致肾毒性与摄取型转运体Oat介导其在肾小管的大量聚集以及外排型转运体Mrp介导其外排有关,且抑制Oat对药物的摄取和促进Mrp对药物的外排是降低肾毒性的有效策略[17-18]。Uwai等[19]研究证实,阿德福韦为Oat1和Oat3的底物,能被其从血液中摄取进入肾小管上皮细胞。本研究发现,阿德福韦本身即可增强肾Oat1和Oat3mRNA表达,这可能是其长期使用造成肾蓄积的原因。当蓄积于细胞内的药物浓度过大时,阿德福韦与线粒体DNA聚合酶结合,抑制线粒体DNA的合成,导致线粒体功能发生障碍,从而影响肾小管的重吸收和分泌功能,引起肾毒性[20]。同时,本研究结果表明,黄芪甲苷能够降低肾组织中Oat3mRNA表达,从而减少阿德福韦摄取进入肾细胞,而且黄芪甲苷因具有酚羟基结构,可以推测其在体内以阴离子形式存在,与阿德福韦同属于有机阴离子化合物,故可以竞争性抑制转运体Oat3对阿德福韦的摄取,减少阿德福韦肾蓄积。另有研究报道,Mrp4参与了阿德福韦的外排过程[21]。本研究结果显示,与正常对照组相比,阿德福韦组Mrp4mRNA表达略有下降,而黄芪甲苷可提高Mrp4mRNA表达,从而促进阿德福韦从肾小管上皮细胞的外排。推测黄芪甲苷通过减少摄取、增加外排来减轻阿德福韦肾蓄积,从而减轻肾毒性。
综上,本研究建立了快速、灵敏的UPLC-MS/MS法用于大鼠体内阿德福韦浓度测定。结果提示,黄芪甲苷可改变阿德福韦的毒代动力学行为,且可通过减少肾小管上皮细胞Oat3 mRNA的表达、增加Mrp4 mRNA的表达降低阿德福韦在肾中的蓄积。本研究为临床使用黄芪甲苷防治阿德福韦致肾毒性提供了实验依据。
