红藻藻胆体的结构及关键色素分析
2021-06-25肖亚男马建飞游鑫隋森芳
肖亚男,马建飞,游鑫,隋森芳†
①南方科技大学 生命科学学院,广东 深圳 518055;②清华大学 生命科学学院,北京 100084
光合作用是地球上最重要的化学反应之一,光合作用的第一步便是光能的吸收与传递[1-2]。为了有效地吸收光能,生活在不同环境中的生物进化出各种捕光系统[3],其中捕光复合体(light-harvesting complexes, LHCs)主要存在于绿藻和高等植物中,而藻胆体(phycobilisome, PBS)是位于蓝藻和红藻类囊体膜基质侧表面的大型水溶性捕光复合体,分子量为3~18 MDa[4-8]。
藻胆体能吸收较宽范围波长(490~650 nm)的光能,将能量传递给光合作用的反应中心,继而驱动光合电子传递[9-11]。藻胆体的吸收光谱恰好与叶绿素a (最大吸收为440 nm和670 nm)互补,使得藻类在几乎整个可见光区都有光吸收[9-10]。由于水中的光照条件不同,例如深水区充满了蓝绿色的光,藻胆体的捕光能力对于水生生物十分重要[12]。
最初,科研人员在红藻Porphyridium cruentum的类囊体膜基质侧发现一些小颗粒,并且在层状膜上具有高度有序的空间排列,经过生化分析、电子显微镜观察及分离纯化等研究,证明这些小颗粒主要由3种藻胆蛋白组成,因此后来将其命名为藻胆体[13-15]。
目前研究者发现主要存在以下几种形状的藻胆体:半圆盘形(存在于许多蓝藻中)[6,16]、半椭圆形(存在于许多红藻中)[6,17]、块型[8,18]和束型[19]。另外,还在含有叶绿素d的蓝藻中发现一种不常见的杆状藻胆体[20-21]。
自20世纪60年代发现藻胆体以来,藻胆体的结构研究历程主要分为以下三个阶段[22]:20世纪90年代之前主要通过负染透射电镜进行藻胆体的低分辨形态学研究;90年代中期至21世纪初,主要通过X射线晶体学进行藻胆体的组分——藻红蛋白、藻蓝蛋白、别藻蓝蛋白、连接蛋白等的晶体结构研究,代表性成果为我国科学家梁栋材课题组等解析的红藻Polysiphonia urceolata的R-PC的2.4 Å[23]和R-PE的1.9 Å晶体结构[24],以及张玉忠、吴嘉炜课题组合作解析的蓝藻Synechocystis sp. PCC 6803 LR的N末端的1.9 Å晶体结构等[25];21世纪初,随着单颗粒冷冻电镜等生物物理技术的发展,利用三维重构解析藻胆体高分辨结构成为可能。我们课题组与中国科学院植物研究所匡廷云院士课题组较早开展这方面工作,合作解析了第一个蓝藻Nostoc flagelliforme藻胆体的冷冻电镜三维结构[26]。之后,我们课题组与北京大学赵进东院士课题组合作完成了另一株蓝藻Anabaena sp. strain PCC 7120的负染电镜三维重构[27]。然而,由于当时冷冻电镜条件和单颗粒三维重构方法等的限制,以上两个蓝藻结构只解析到中等分辨率。在长期探索的基础之上,随着2013年以来冷冻电镜技术的突破,我们课题组选择两种红藻——Griffithsia pacifica(太平洋凋毛藻)和Porphyridium purpureum(紫球藻)为研究对象解析了两种藻胆体的高分辨率冷冻电镜结构,分辨率分别为3.5 Å和2.8 Å[8,28]。两种红藻的藻胆体结构相似,而P. purpureum的藻胆体分辨率更高,因而我们将主要以此来介绍藻胆体的结构及特征。
1 藻胆体的亚基组成及性质
藻胆体是一个结构复杂的超级复合体,由藻胆蛋白(phycobilinproteins, PBPs)和连接蛋白(linker protein)两种组分组成。
1.1 藻胆蛋白
藻胆体中藻胆蛋白质量分数为85%左右,结合色素,主要用于捕获光能。藻胆蛋白有两个同源亚基α和β,每个亚基的分子量为15~20 kDa (160~165个氨基酸)。α和β亚基形成一个异源二聚体(αβ),通常称为(αβ)单体,随后主要通过疏水作用力组装成稳定的(αβ)3三聚体,作为藻胆体逐级组装的基本单位[6,29]。通常每个亚基结合1~3个开链四吡咯环的藻胆色素,色素A环或D环通过硫醚键与序列保守的半胱氨酸残基共价结合[26,30]。水溶性藻胆蛋白占细胞内可溶性蛋白质量分数的一半以上,同时也可作为氮源储存[31-32]。
存在于红藻G. pacifica和P. purpureum藻胆体中的色素有藻红胆素(PEB)、藻尿胆素(PUB)和藻蓝胆素(PCB)三种,其中PUB是PEB的双键异构体[9]。色素的双键共轭变化导致色素能级的改变,使它们吸收不同波长的光并按能量从高到低传递。
根据色素能级不同,可以将藻胆蛋白分为以下几种:藻红蛋白(PE),位于杆的远核端,结合PEB,同时也可以结合PUB,吸收490~550 nm的蓝光、绿光和黄光;藻蓝蛋白(PC),位于杆的近核端,结合PEB和PCB,吸收620~630 nm的红光;别藻蓝蛋白(APC),是核的主要成分,结合PCB,吸收650 nm的红光[4,33-34]。α和β亚基在PC、PE和APC之间也是同源的[16],因此,虽然不同藻胆蛋白具有不同的吸收光谱,但它们具有相似的晶体结构[27,35-36]。
核APC有几种特殊的亚基,氨基酸序列发生变化,如αLCM(LCM的类αAPC结构域,由apcE基因编码,LCM包括结合色素的αLCM结构域和几个linker结构域),类αAPC/ApcD (αAP-B,由apcD编码),类βAPC/ApcF变体(β18.5,由apcF编码)[6,27,37]。ApcD、αLCM和ApcF亚基中都各结合一个藻蓝胆素。普通的APC亚基最大发射峰为660 nm,而ApcD和αLCM的最大发射峰为680 nm,因此被称为能量末端发射受体(terminal emitters)[38-40]。ApcD、ApcF和αLCM的结构与APC的α和β亚基相似,但不完全相同,蛋白的带电性也不同[41]。
1.2 连接蛋白
藻胆体中的连接蛋白大多为无色,也有的连接蛋白结合色素,但是不属于藻胆蛋白的α和β亚基,通常称为γ亚基。γ亚基并不普遍存在,仅存在于少数海洋蓝藻和红藻中[9,40]。连接蛋白占藻胆体质量的15%左右,参与藻胆蛋白的空间排列和功能调节,进而组装成藻胆体高效的捕光系统[9]。
根据功能和位置,连接蛋白分为以下几种:杆连接蛋白LR,参与杆的组装;核杆连接蛋白LRC,参与杆与核之间的连接;核连接蛋白LC,参与核的组装;核膜连接蛋白LCM,参与核的组装[6,40]。在LCM的类αAPC结构域αLCM插入有一段loop (称作PB-loop)[38],目前认为与类囊体膜内的光系统相互作用。
连接蛋白中有两种保守结构域Pfam00427和Pfam01383,参与杆和核的组装,并广泛存在于多种连接蛋白中[9]。根据蛋白的结构域,红藻中的连接蛋白LR和LRC可以进一步分为几类(图1)。

图1 红藻G. pacifica和P. purpureum藻胆体中的连接蛋白的结构对比图及示意图。(a)红藻G. pacifica和P. purpureum藻胆体中连接蛋白的结构对比图。图中玫红色的连接蛋白来自P. purpureum,浅蓝色连接蛋白来自G. pacifica。(b) G. pacifica和P. purpureum中连接蛋白的结构示意图。图中数字标记了结构域的位置,除LR6来自P. purpureum外,其他均标记了G.pacifica连接蛋白的结构域位置(图片修改自[8, 28])
杆连接蛋白LR可分为三类。第一类包括LR1~LR3,以及红藻P. purpureum的LR6,这类连接蛋白含有Pfam00427结构域。第二类是藻红蛋白的γ亚基,被称为LRγ,包括LRγ4、LRγ5、LRγ7和LRγ8及G. pacifica的LRγ6。这类连接蛋白含有一个之前未被发现的、保守的色素结合域(chromophore binding domain, CBD),结合PEB和/或PUB,占据PE六聚体的中心腔,从六聚体中伸出的小螺旋或loop与相邻的连接蛋白的刚性结构域(如Pfam00427结构域)相互作用。第三类只有LR9,含有与细胞黏附相关的FAS1同源结构域。
核杆连接蛋白LRC也可以分为三类。第一类LRC1,包含一个埋藏在其藻蓝蛋白六聚体中的N端Pfam00427结构域和一个C端loop。第二类为LRC2和LRC3,它们的N端都有Pfam00427结构域,C末端有一个卷曲螺旋基序(motif),螺旋结构中的两个螺旋是反向平行的。第三类为LRC4、LRC5和LRC6,以前是未知的,与其他连接蛋白的结构有很大不同。LRC4、LRC5和LRC6都是“中间结构域-两侧loop”组成形式,区别在于LRC4和LRC5中间包含一个长α螺旋,在LRC6中间包含一个FAS1结构域。
2 藻胆体的结构
2.1 总体组成
在G. pacifica藻胆体的核中有46个APC亚基(不包含LCM),杆中有672个PE亚基、72个PC亚基,共有72个连接蛋白及2 048个色素分子,总分子量18.0 MDa。在P. purpureum藻胆体的核中有46个APC亚基,杆中有528个PE亚基、72个PC亚基,共有60个连接蛋白及1 598个色素分子,总分子量14.7 MDa。
红藻G. pacifica和P. purpureum的藻胆体结构相似(图2),核由三个圆柱(A、A′、B)组成,圆柱B垛叠于底部圆柱A和A′形成的肩凹上方。核周围有14个杆交错排列,另外还有一些单独的六聚体、α亚基和β亚基填充在核和杆的外部空间,这可能有助于稳定藻胆体的结构(图2(a)和(c))。P. purpureum的藻胆体较小,5个杆Ra、Rb、Rc、Rd和Re外侧各少一个PE六聚体及一个连接蛋白,并且缺少He六聚体及其连接蛋白(图2(a)~(d))。
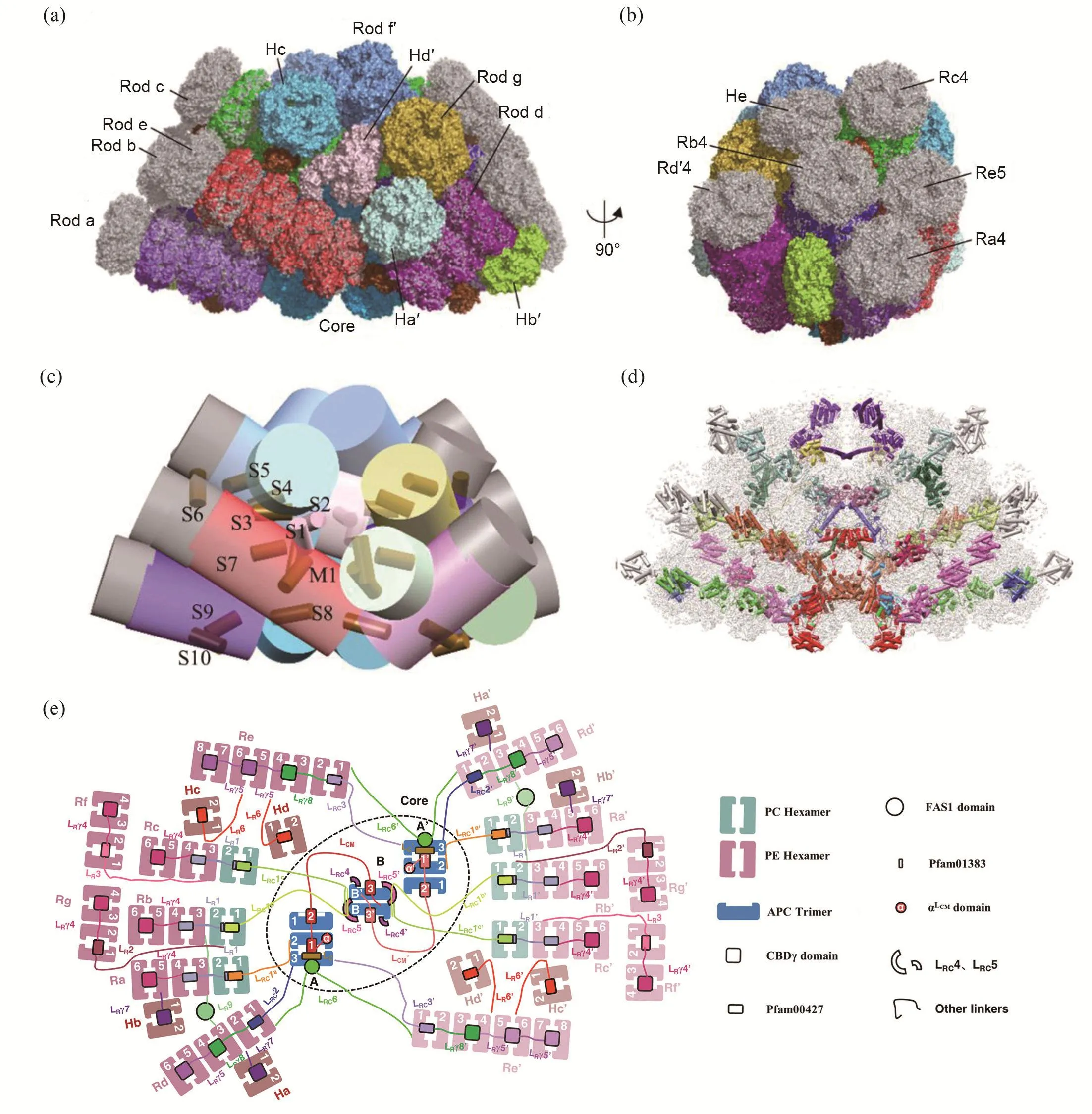
图2 红藻G. pacifica (PDB: 5y6p)和P. purpureum (PDB: 6kgx)的完整藻胆体结构比较。(a)~(b)藻胆体的整体结构比较,分别为正面视图(a)和侧面视图(b)。其中P. purpureum藻胆体的结构以彩色显示,G. pacifica藻胆体结构以灰色表示。P.purpureum藻胆体的杆Ra、Rb、Rc、Rd′、Re外侧各少一个PE六聚体,并且缺少单独的六聚体He。(c) G. pacifica和P.purpureum藻胆体中杆与核的分布示意图。所用颜色同图(a)~(b),标记了P. purpureum藻胆体中单独的PEβ亚基(S1~S10)和(αβ)单体(M1)。(d) G. pacifica和P. purpureum藻胆体中的连接蛋白骨架比较。G. pacifica藻胆体轮廓以灰色透明背底表示,P. purpureum藻胆体的连接蛋白以彩色显示,G. pacifica的连接蛋白以灰色表示。P. purpureum比G. pacifica缺少5个杆Ra、Rb、Rc、Rd′、Re和单独的六聚体He中的连接蛋白。(e) P. purpureum藻胆体的结构模式图。右侧展示了各个图形所代表的藻胆体组分(图片修改自[28])
2.2 杆的结构
红藻藻胆体共有14个杆,由PE和PC或仅由PE组成。含有PE和PC的杆为type I,PC位于近核端,包括Ra/Ra′、Rb/Rb′和Rc/Rc′;仅含有PE的杆为type II,包括Rd/Rd′、Re/Re′、Rf/Rf′和Rg/Rg′,其中10个杆较长(≥3个PE或PC-PE六聚体),而Rf/Rf′和Rg/Rg′这4个杆较短,只由2节PE六聚体组成,而且不直接与核接触(图2(e))。连接蛋白在杆的组装中起到非常重要的作用,其模型有两种:互锁模型(interlocking)和分子骨架模型(skeleton)[9,25,42-43]。在互锁模型中,两个藻胆蛋白六聚体分别与一个连接蛋白的两个结构域相互作用。这一模型没有突出连接蛋白之间的相互作用;分子骨架模型则更加关注连接蛋白之间特异性相互作用,认为连接蛋白形成杆组装的骨架。
红藻藻胆体中杆的组装同时包含这两种模型。例如,P. purpureum藻胆体的杆Ra-c (type II),由1个PC六聚体、2个PE六聚体和3个连接蛋白LRC1、LR1和LRγ4组成。PC六聚体和相邻的PE六聚体由LR1连接,LR1含有两个结构域:N端的Pfam00427结构域和C端的Pfam01383结构域。这两个结构域分别结合相邻的两个藻胆蛋白六聚体,即LR1按照互锁模型连接相邻的藻胆蛋白六聚体。同时,LR1两端分别与LRC1和LRγ4连接,形成杆Ra-c的骨架,这与分子骨架模型一致(图3(a)和(b))。
总之,具有两个结构域的LR1按照互锁模型组装部分杆,10个较长的杆中所有连接蛋白从近核端到远核端按照LRC—(LR1)—LRγ的顺序相互作用,4个较短的杆按照LR2/3—LRγ的顺序相互作用,从而形成杆的骨架(图2(e))。结合色素的LRγ位于杆的远核端,可能是由于藻胆体外周的色素密度提高有助于其增大捕光面积。第三类杆连接蛋白LR9具有FAS1结构域,并在C端有很长的loop,位于杆之间,稳定与其接触的杆(图4(a))。从整体来看,藻胆体中所有的连接蛋白按照一定的顺序相互连接,形成藻胆体组装的骨架(图2(d))。
2.3 核的结构
红藻藻胆体的核由三个圆柱(A、A′、B)组成:圆柱B位于上方,两个APC三聚体B1和B2背对背排列;圆柱A和A′各由三个APC(A1、A2、A3/A1′、A2′、A3′)组成三聚体,其中A2/A2′和A3/A3′面对面结合,而A1/A1′与A2/A2′背对背连接,圆柱A和A′反向平行排列(图3(c)~(d))。αLCM和ApcF位于A2/A2′中,ApcD位于A3/A3′中(图3(d)~(f))。
核三聚体亚基之间的相互作用是对称的:三聚体B1、A2与A′1相互作用,三聚体B2、A′2与A1相互作用(图3(e))。另外,连接蛋白LC和LCM位于APC三聚体中心的空洞中,起到连接作用:LCM连接B1、A1和A2,LC连接A2和A3(图3(f))。三聚体之间的相互作用及与连接蛋白的相互作用,可以使核保持稳定。
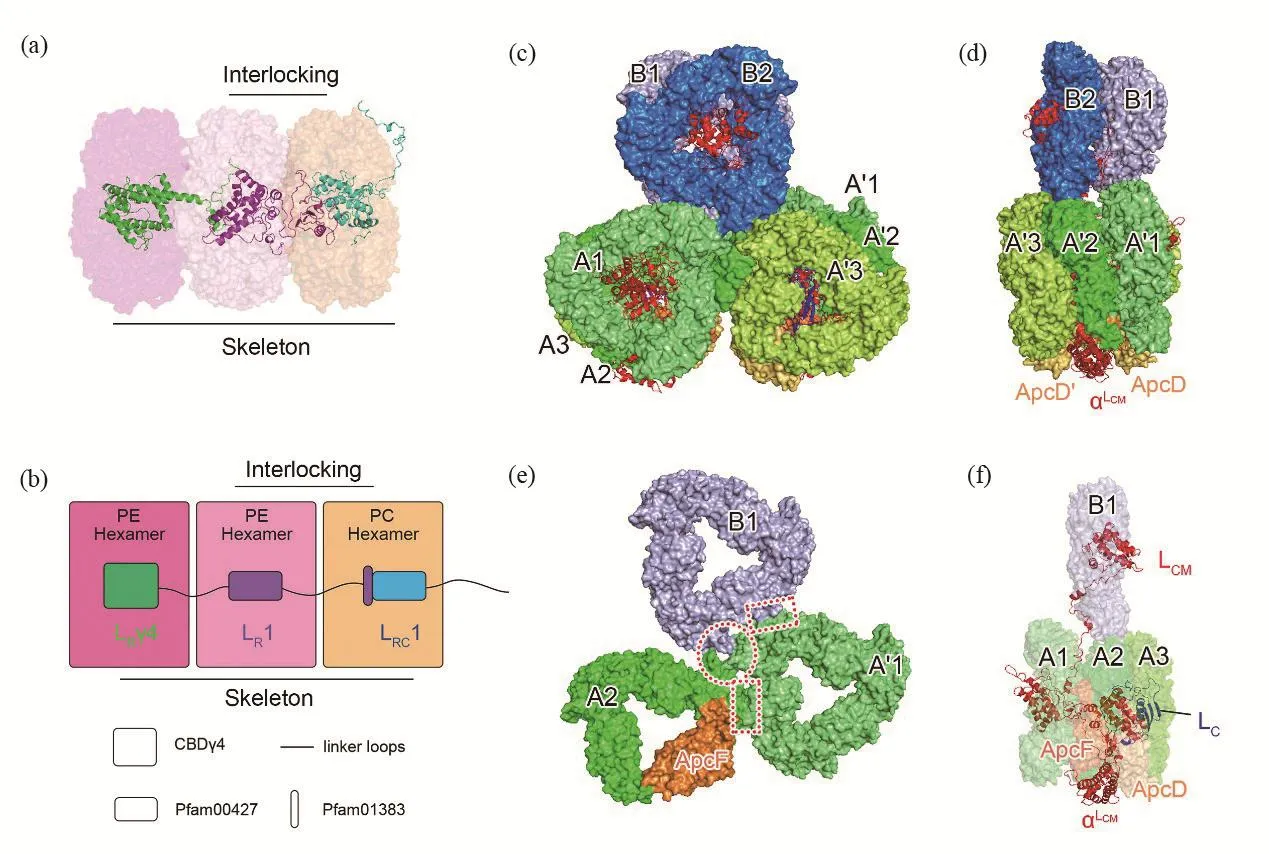
图3 藻胆体杆((a)~(b))与核((c)~(f))的组装。(a)~(b) P. purpureum藻胆体杆Rc的结构图(a)和模型图(b):LR1的两个结构域(Pfam00427结构域和Pfam01383结构域)按照互锁模型(interlocking)连接相邻PC和PE的六聚体;同时,LRC1、LR1和LRγ4彼此相连,形成杆Ra-c的骨架(skeleton)。(c)~(d)红藻藻胆体核三聚体的排列及与连接蛋白的位置关系(其中红色为连接蛋白LCM,蓝色为连接蛋白LC),分别为正面(c)和侧面(d)视图。(e) 核三聚体之间的相互作用,红色虚线图形标注了三聚体B1、A2和A'1之间的相互作用位点。(f) 连接蛋白在核中的位置,LCM连接B1、A1和A2,LC连接A2和A3(PDB: 6kgx)
2.4 藻胆体的组装
红藻藻胆体中有14个杆,其中10个杆通过连接蛋白LRC1-3与核结合。LRC1-3的C末端有一个序列保守的α螺旋,通过广泛的疏水相互作用和静电相互作用与核APC的α亚基表面的一个凹槽(groove)结合(图4(c)~(f)),而另一端的Pfam00427结构域与杆结合。序列比对研究表明,参与相互作用的LRC蛋白C末端的α螺旋上的氨基酸残基和核APC的α亚基中结合位点中的氨基酸残基是保守的,并且在红藻和蓝细菌中均包含疏水性或带电荷和/或极性氨基酸(图4(b)),这说明藻胆体组装过程中,杆-核连接蛋白可能使用一种通用机制[8,28]。在核中有8个三聚体(A1-A3、A′1-A′3、B1和B2),含有20个APC的α亚基(不包括两个αLCM亚基和两个ApcD亚基)。由于一些结合位点在核圆柱体的3个三聚体相互作用交界处以及三聚体和类囊体膜之间,最终有12个位点可以与LRC结合(图4(d)、(f)):A1、A′1、A2、A′2三聚体,以及A3、A′3、B1和B2三聚体各自提供的两个结合位点。正常情况下,一个LRC锚定到一个结合位点,但是A1(A′1)和A2(A′2)的两个结合位点被一个LRC占据(图4(d))。因此,12个结合位点对应10个LRC,进而对应10个杆:A1和A2—LRC1a—Ra;A′1和A′2—LRC1a′—Ra′;B1—LRC1c—Rc;B1—LRC1b′—Rb′;B2—LRC1b—Rb;B2—LRC1c′—Rc′;A3—LRC2—Rd;A3—LRC3′—Re′;A3′—LRC2′—Rd′;A3′—LRC3—Re(图4(d))。这10个杆的连接蛋白形成的骨架,通过近核端的一点结合着核表面的这12个保守位点(图4(a))。藻胆蛋白在骨架上组装成杆,最终使得藻胆体如同天线(antenna)或一把始终张开着的伞,每个伞骨(连接蛋白骨架)通过一点固着与伞柄结合,支撑着巨大伞面(藻胆蛋白)来收集光子,并将太阳能高效传递至伞柄(核)。
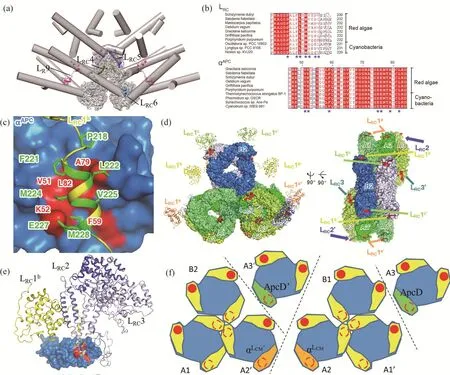
图4 藻胆体的核杆组装。(a) G. pacifica的杆与核的连接。核显示为灰色的表面,灰色圆柱表示杆连接蛋白形成的骨架,带颜色突出显示LR9和LRC4-6对杆之间、核与杆之间的稳定作用。(b)红藻和蓝藻中LRC1及αAPC序列比对图(http://espript.ibcp.fr/ESPript/cgi-bin/ESPript.cgi)。相互作用的保守氨基酸位点标记为* (图修改自[8])。(c)核B2的αAPC形成的凹槽与LRC1b的C末端α螺旋之间的相互作用。发生相互作用的保守氨基酸位点已标识(图修改自[28])。(d)藻胆体核表面αAPC形成的12个凹槽与10个LRC结合;左右图分别为正面观和顶面观,αAPC与LRC结合的凹槽显示为红色表面;除了LRC1a与两个αAPC凹槽结合之外,其他LRC各结合一个αAPC凹槽(图修改自[28] )。(e)LRC1b、LRC2、LRC3与αAPC的结合界面,以αAPC进行整体的结构匹配; 3个LRC虽然分别处于不同走向,但结合界面处LRC的结构和序列基本保守。(f)分层显示(d)右图中藻胆体核表面与LRC结合情况。每个蓝色圆盘为一个APC三聚体;αAPC显示为黄色多边形,αAPC上的保守凹槽用红圈表示,其中具备结合LRC能力的显示为实心红圈,不具备结合LRC能力的显示为空心红圈
另外还有4个杆(Rg、Rf、Rg′、Rf′)不直接与核结合,而是通过杆连接蛋白LR2/ LR3结合到其他杆上,例如杆Rg通过LR2与Rb结合,杆Rf通过LR3与Rc结合(图2(e))。在红藻藻胆体中还有单独的PE六聚体,例如Ha-He、Ha′-He′通过杆连接蛋白与其他杆连接(图2(e))。这些组分的存在可能有利于增大捕光面积并维持藻胆体的结构稳定性。
在红藻藻胆体中发现一组新的核杆连接蛋白(LRC4、LRC5和LRC6),蛋白中间部分为一个α螺旋或FAS1结构域,两侧有很长的loop(图1(b)和4(a))。中间结构域与核结合,而两侧loop类似束带,与核和周围的杆具有广泛的相互作用,因此可以稳定藻胆体的完整组装。
3 色素的蛋白质环境分析
能量从高能级藻胆蛋白传递至相对低能级的藻胆蛋白,再传递到反应中心的叶绿素,这一过程是通过色素-色素、色素-蛋白之间的相互作用来实现的[9],其能量传递效率高于95%[6,11,44]。
如果天线蛋白中只结合一个色素,那么该色素的能量状态由于吸收光子而被激发,处于激发态的色素基团最终以非辐射方式或通过辐射方式(荧光发射)返回到基态。如果天线蛋白结合两种具有不同吸收特性的色素,当两个色素基团之间的距离很近时,如小于5 nm,根据Förster理论,激发态的能量以共振能量转移的方式从高向低传递,例如从PEB(供体)向PCB(受体)传递。如果天线蛋白结合两个同种色素,而蛋白质环境导致两个色素的吸收特性发生变化,则一个是供体,另一个是受体[7,45-47]。氨基酸与色素之间的相互作用包括静电、疏水相互作用和π-π相互作用等[48-49]。在藻胆蛋白同一个三聚体中,相对位置一样的色素处于相同的蛋白质环境中,而在完整的藻胆体中,连接蛋白的存在会对同一个三聚体中的不同色素产生不同的影响。其中,连接蛋白芳香族残基的π电子与色素π电子之间的相互作用对于调节色素基团的能量状态非常重要[28]。
3.1 杆中色素的蛋白质环境分析
如前所述,在红藻中藻胆体type I的杆中有两种藻胆蛋白三聚体(PE、PC)和三种连接蛋白(LRγ、LR及LRC)。考虑到藻胆蛋白亚基的同源性,接下来我们以type I型的杆Rc为例,讨论藻胆体杆内的能量传递途径。
连接蛋白对藻胆蛋白色素能级的影响可以分为两种方式。首先,连接蛋白中的氨基酸调节藻胆蛋白色素能级。例如,在Rc(图5(a))的PC-I三聚体内,连接蛋白LRC1c的H58与β282具有π-π相互作用,最小距离为2.8 Å,属于强的相互作用;LRC1c-Y104与β182具有π-π相互作用,但距离为4.3 Å,因此相互作用较前者弱一些;但是没有芳族氨基酸残基与β382相互作用。因此,由于连接蛋白LRC的影响,β282在这三个色素中可能处于最低的能量状态(图5(b))。由于PC-I三聚体直接与核衔接,在整个PC-I三聚体中,可能是光收集和能量从杆传递至核的关键位点,我们称之为中转站色素。同理,在Rc的PE-I三聚体内,LRγ4的三个芳香族残基(F139、F80和F124)分别与PE-I三聚体的β182、β282和β382具有较强的π-π相互作用,这说明LRγ4有助于稳定β82,从而使三个β82的能级降低(图5(c)),这与LRC对PC三聚体的影响相似。其次,连接蛋白中的色素也会对藻胆蛋白的色素能级产生影响。例如,连接蛋白LRγ4结合的PEB(γLRγ4152)靠近β282,最近距离为2.9 Å,形成激子耦合效应,使π电子在两个色素之间离域[23,50]。因此,与其他β82相比,β282处于相对较低的能级。综上所述,在整个PE三聚体I中,β282可能是光收集和能量传递的关键位点(图5(c))。
通过序列和结构比较发现,与色素相互作用的芳香族氨基酸在红藻和蓝藻中是相对保守的(图5(d)、(e)),说明其功能的重要性[28]。总之,连接蛋白能够通过不同数量的芳香族氨基酸、不同强度的相互作用及色素的位置调节藻胆蛋白内色素的能级。
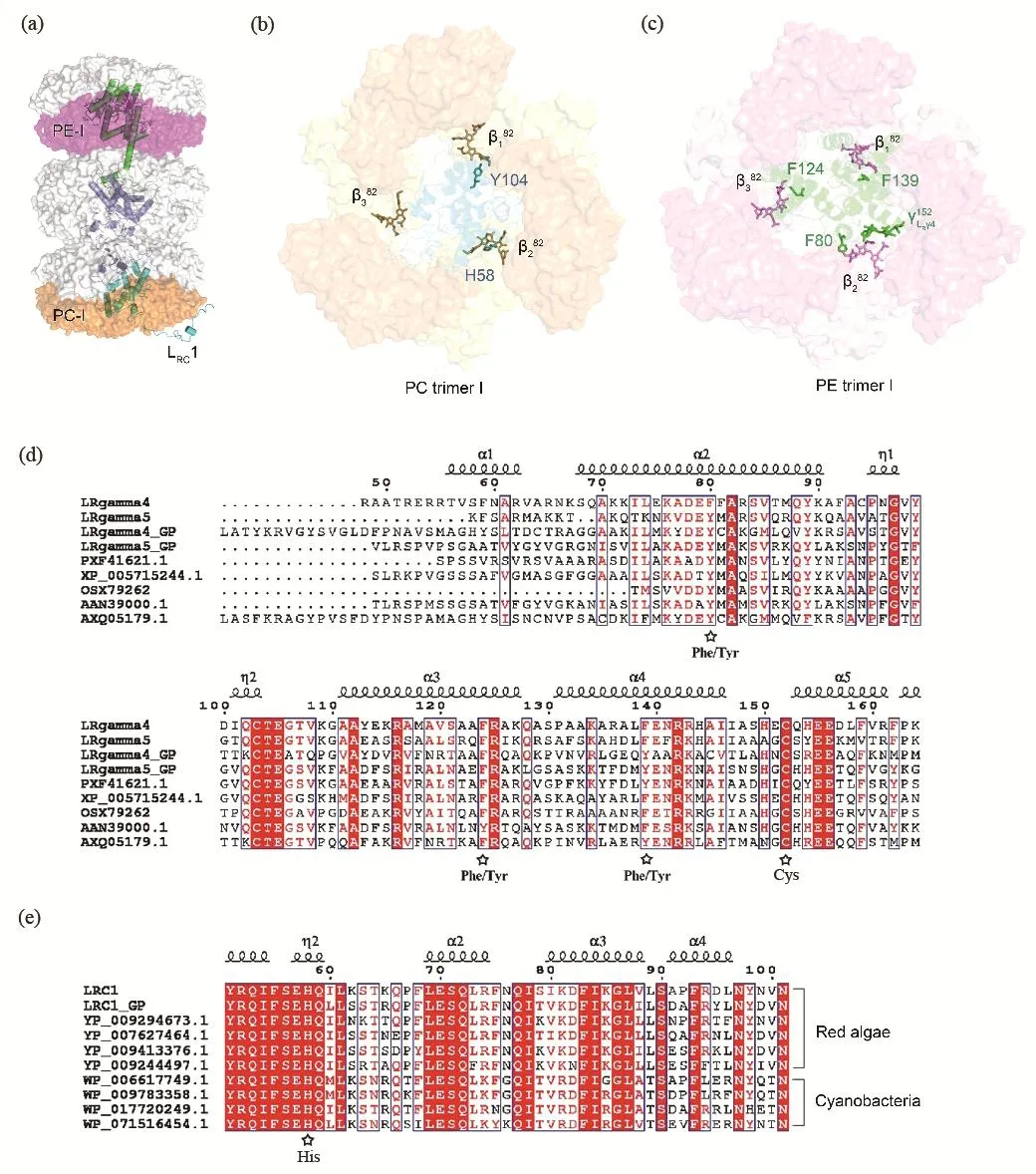
图5 P. purpureum藻胆体杆中的连接蛋白及其对杆中色素能级的影响。(a)杆Rc的整体结构,图中标记了PC三聚体I (PC-I)和PE三聚体I(PE-I)的位置;(b)连接蛋白LRC对PC-I的影响;(c)连接蛋白LRγ4对PE-I的影响;(d) P. purpureum藻胆体中LRγ4-5与其他红藻γ亚基序列对比图;(e) P. purpureum 藻胆体中LRC1与其他物种中的LRC1的序列对比图。图(d)和(e)中与色素相互作用的芳香族氨基酸标记为星号。图引自[28],图中氨基酸及色素颜色:蓝绿色,LRC;绿色,LRγ4(PDB: 6kgx)
3.2 核中色素的蛋白质环境分析
在APC中,αβ亚基各结合一个PCB,分别为α81和β81。核B连接杆Rc/Rc′和Rb′/Rb,因此这部分杆吸收的能量可能首先传递给B。在B1中,LCM的F850位于B1β381附近,距离为4.8 Å,因此,能量可能会经过B1β381传递给更靠近核A的色素(图6(a))。
核A1中,A1α181位置最接近核B,然后依次是A1β281、A1β181和A1β381。LCM-F454与A1β181相互作用,LCM的Y443、Y583和F610与A1β381具有π-π相互作用,因此,在LCM的影响下,A1β381的能级最低,其次是A1β181和A1β281(图6(b))。
ApcF是核A2中特殊的β亚基,对于将能量从藻胆体转移至PSII至关重要[51-53]。在ApcF中,ApcF-F60、ApcF-R89、ApcF-Y93和ApcF-Y97与形成较强的π-π相互作用,从而降低其能级。同时,αLCM中的氨基酸(V12、P14、L16、L247、L249、F397、P401、C404和W407)在周围形成一个疏水口袋,从而使A2β87ApcF更加稳定(图6(c)、(e))。
核A3中也有一个特殊的α亚基ApcD,在藻胆体向PSI传递能量过程中具有重要作用[51-54]。ApcD-W87、ApcD-F59、ApcD-Y65、ApcD-R83和核A3-β-Y73与A3αApcD81相互作用,这些氨基酸的存在会降低A3αApcD81的能级(图6(d))。
αLCM连接核与类囊体膜,其色素是藻胆体的末端能量受体。在αLCM中,αLCM-Y140和αLCM-R144直接与A2α186相互作用,尤其是αLCM-Y140占据LCMA环的位置,形成空间位阻,导致的A环构象发生变化,使其ABCD环几乎处于同一平面上(图6(f)~(h))。色素分子的二面角与其能级有关,二面角越小,色素分子的四个吡咯环越接近同一平面,则能级越低[24],因此在所有色素中处于能量最低的状态。

图6 红藻藻胆体核内色素的蛋白环境。(a)~(d)分别为核B1、A1、A2和A3中色素的蛋白环境。图中展示了各个APC三聚体从A1向A3方向的视图,三聚体的下方均为类囊体膜的方向,图中显示了位置特殊的α181和所有β81色素分子及与其相互作用的氨基酸残基。(e)与A2βApcF87相互作用的氨基酸及其周围的疏水“帽子”。(f)PCB色素分子二面角示意图,其中Φ1、Ψ1等分别代表NA-C(4)–C(5)–C(6)、C(4)–C(5)–C(6)–NB等平面之间的夹角。(g)A2αLCM186与核PCB的二面角比较。(h)A2αLCM186(红色)与核PCB(灰色)之间的构象比较,从图中可以看出A2αLCM186 A环的位置发生明显的变化(修改自[28])。氨基酸颜色:深蓝色,核B1;红色,LCM;粉红色,ApcF;浅棕色,ApcD;蓝色,LC;浅蓝色,核A3(PDB: 6kgx)
综上所述,在核中,连接蛋白也发挥了调节色素能级的作用,特别αLCM-Y140和,不仅通过π-π相互作用影响色素的π电子状态,同时还通过空间位阻效应影响A2αLCM186色素的平面构象,致使A2αLCM186色素成为整个藻胆体的能级最低的末端能量受体。蛋白环境对色素的影响与藻胆体的能量传递的方向一致,即杆吸收的能量汇聚到核,然后传递给藻胆体末端能量受体,最后传递给光反应中心[51, 55]。
4 结论和展望
红藻高分辨率的藻胆体结构,对于了解其结构组装及能量传递的机制具有非常重要的意义。藻胆蛋白(αβ)3三聚体是藻胆体的基本结构单位,通过连接蛋白组装成杆和核,并进一步组装成完整的藻胆体,组装过程涉及藻胆蛋白与连接蛋白、藻胆蛋白与藻胆蛋白,以及连接蛋白与连接蛋白之间的相互作用。在完整的藻胆体结构中,所有的连接蛋白均参与骨架的构建(G.pacifica中72个,P. purpureum中60个),如图2(d)所示。另外,连接蛋白在藻胆体的能量传递中可能发挥着关键的调节作用。在杆中,连接蛋白通过提供不同数量的芳香族氨基酸侧链π电子,或通过自身结合的色素(LRγ)与藻胆蛋白内的色素相互作用,调节β亚基中色素的能级,有利于能量在杆中高效传递。在核中,连接蛋白也具有微调APC中色素能量的作用。核中特殊的亚基ApcF、αLCM和ApcD,其色素能级均受到连接蛋白的调节,尤其是αLCM亚基中色素的特殊构象,在藻胆体向光系统传递能量过程中起到非常重要的作用。
藻胆体中存在大量的色素,这些色素基团是能量接收和传递的载体。分析色素的构象是了解藻胆体能量传递的结构基础,但受分辨率限制,仍有许多色素的精确构象是未知的,因此,需要继续提高藻胆体的结构分辨率。另外,在结构的基础上,可能需要更多的实验来验证关键氨基酸或色素的功能及其在生理状态下的动态变化。例如,采用分子生物学技术,在结构的指导下对关键基团进行突变,结合光谱学功能分析揭示能量传递的途径。藻胆体作为蓝藻和红藻中的主要捕光天线,其主要功能是向反应中心传递能量,虽然之前报道了藻胆体与PSII和/或PSI结合的复合体[27,56-57],但是目前还难以用于分析藻胆体如何向光系统传递能量。考虑到水溶性藻胆体和膜蛋白的性质差异大,难以分离纯化,需要考虑采用其他实验技术来原位研究超级复合体结构,例如冷冻电子断层扫描技术等。
随着化石燃料逐渐匮乏及其燃烧造成的温室效应等环境问题的出现,如何直接利用太阳能这一可持续能源引发更多关注[58]。其中一个方向是,模拟自然界已存在数亿年的光合作用相关蛋白,设计更简洁高效的光能器件用以捕获和利用太阳能,称作人工模拟光合作用(artificial photosynthesis)[59]。染料敏化太阳能电池(dyesensitized solar cell, DSSC)利用染料作敏化剂,增加钛、钙、锌的氧化物等半导体对可见光区的吸收,其制作工艺简单,成本低,效率提高的潜力大[60]。藻胆体作为水溶性的色素-蛋白复合体,能量传递效率高,尤其是红藻藻胆体对深水区蓝绿光具有较强吸收能力,因此藻胆体可以作为光学敏化材料,同时其精细结构可以指导我们设计更高效、长寿命、低成本的光电转换器件。若将该器件铺设到海底,可以开发利用广阔海域的更多太阳能。
