绿硫细菌光合反应中心复合体的原子结构
2021-06-25陈景华匡廷云沈建仁张兴
陈景华,匡廷云,沈建仁†,张兴†††
①浙江大学 医学院生物物理系,邵逸夫医院,冷冻电镜中心,杭州 310058;②中国科学院植物研究所,北京100093
1 光合细菌反应中心简介
1.1 光合反应中心定义与分类
光合作用是指光合生物利用光能将无机物转化为有机物,同时产生氧气(或生成硫单质)的生化反应过程。光合作用为几乎所有生物的生存繁衍提供必需的物质基础和能量来源,被称为“地球上最重要的化学反应”。反应中心是光合作用过程中进行光能-电能转化的核心结构,是具有特殊空间构造的色素-蛋白复合体。通常根据末端电子受体的种类可以将反应中心分为两类,即铁-硫型反应中心(type-I型)和醌型反应中心(type-II型)[1]。已知的产氧光合生物(如蓝细菌、绿藻和高等植物)均具有两类反应中心,分别又称为光系统I和光系统II;而非产氧光合生物(绝大多数光合细菌)仅具有单一类型的反应中心。
1.2 光合细菌的分布
光合细菌是地球上分布最广、种类最多的光合生物。已报道的光合细菌主要分布在7个菌门,即厚壁菌门(Firmicutes)、绿菌门(Chlorobi)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、变形菌门(Proteobacteria)、芽单胞菌门(Gemmatimonadetes)和蓝细菌(Cyanobacteria)[2]。不同菌门的代表性光合细菌在反应中心类型、蛋白亚基及色素组成上存在较大差异(表1)。由表1可见,这些光合细菌中,除蓝细菌是产氧生物,具有两类反应中心外,其余都是非产氧细菌,仅具有单一类型的反应中心。
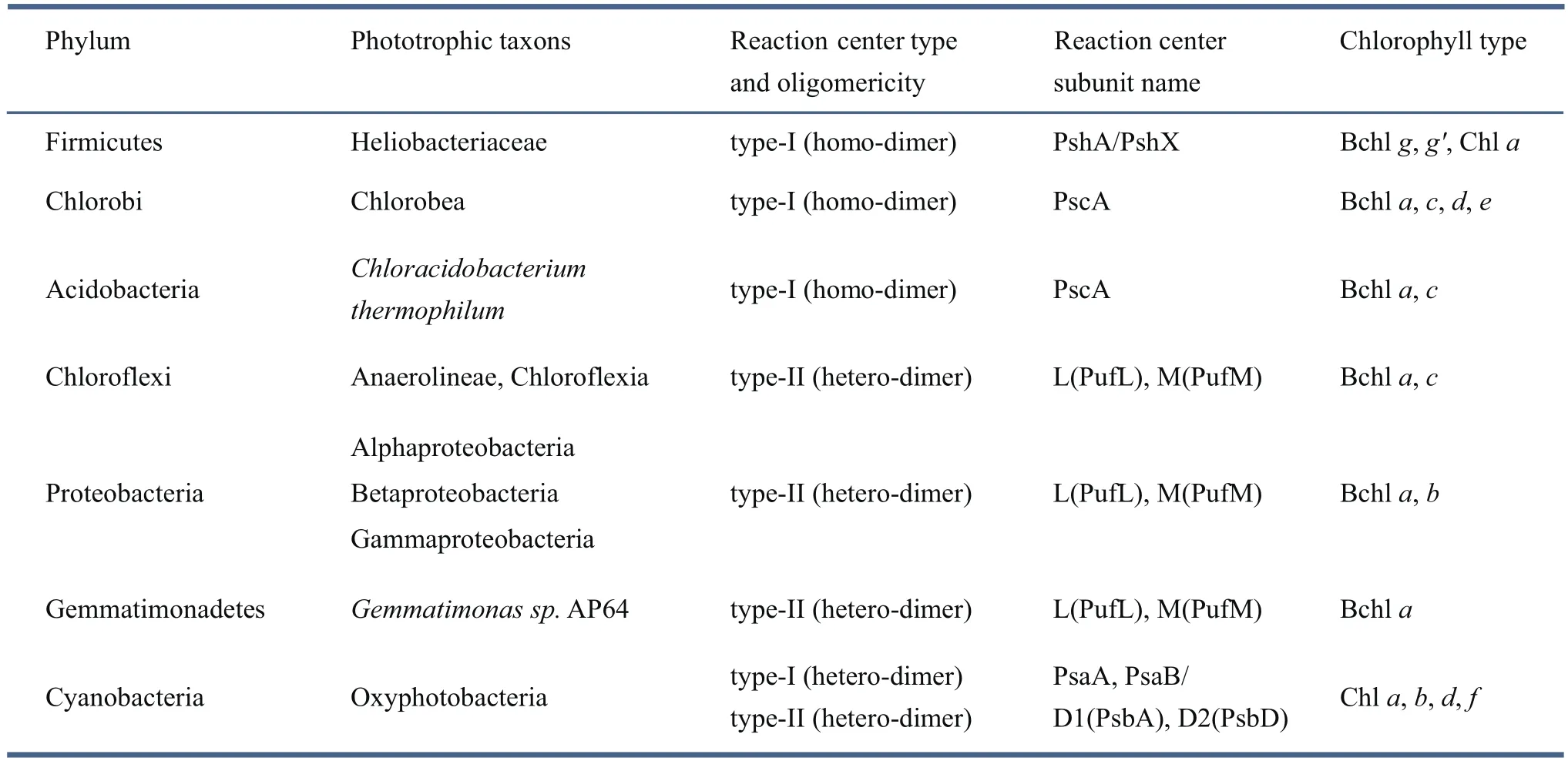
表1 光合细菌所属的菌门及各代表性菌种反应中心类型与色素组成[2]
1.3 光合细菌反应中心的进化研究
1985年,科学家Hartmut Michel、Robert Huber和Johann Deisenhofer解析了紫细菌(变形菌门)光合反应中心的原子结构 (世界上第一个膜蛋白晶体结构),因此荣获1988年诺贝尔化学奖[3]。此后,除绿菌门和酸杆菌门外,已知的光合细菌的反应中心空间结构均先后被解析[4-13]。研究人员通过对比分析已解析的各类光合细菌反应中心的结构信息,并结合分子进化学研究推测各类光合细菌反应中心的进化关系如图1所示。
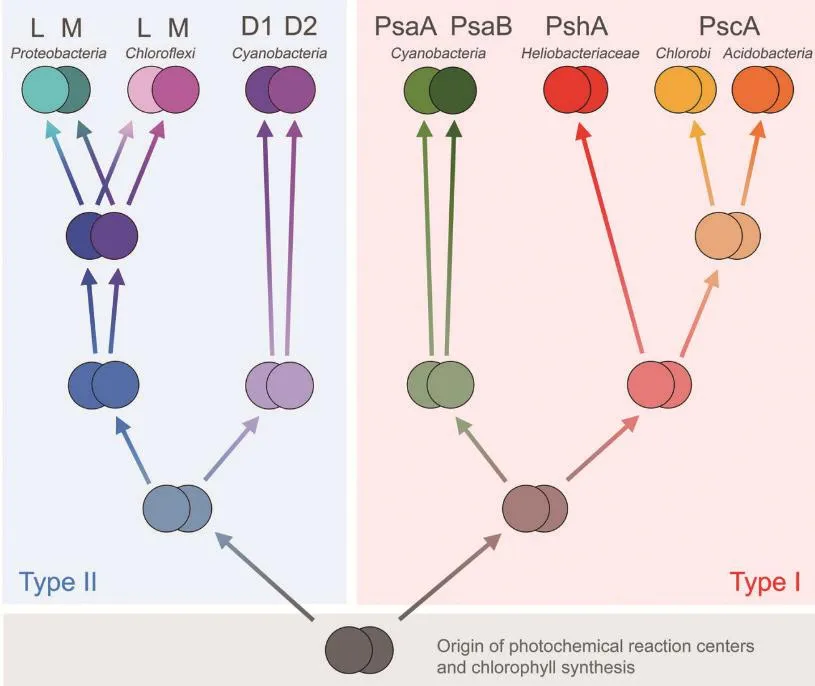
图1 光合细菌反应中心进化关系图[2]
已有研究广泛认为,type-I和type-II型反应中心起源于原始同质二聚体反应中心,之后逐渐进化为不同类型的反应中心[14-16]。生化结果表明,绿菌门和酸杆菌门光合细菌的反应中心在多肽序列和色素组成上接近,二者反应中心的结构同源性较高[17]。因此,对于这两类光合细菌反应中心结构的解析成为光合细菌反应中心结构生物学研究的“最后一座堡垒”。
2 绿硫细菌光反应系统
绿硫细菌属于绿菌门,是一类严格厌氧的光合自养型细菌,能够在极弱的光照环境下进行光合作用,因而被称为“黑暗中的捕光者”[18-20]。嗜热型绿硫细菌Chlorobaculum tepidum (早期称Chlorobium tepidum, C. tepidum)是绿硫细菌的代表性菌种,最早由Wahlund等[21]分离自新西兰的火山温泉,为革兰氏阴性菌。C. tepidum的培养需严格厌氧,最适生长温度为47 ℃,一般细胞大小(0.6~0.8) μm×(1.3~2.6) μm。绿硫细菌光反应系统由三部分构成:外周捕光天线(绿小体)、中间能量传递系统(FMO蛋白)和反应中心复合体(图2)[22]。
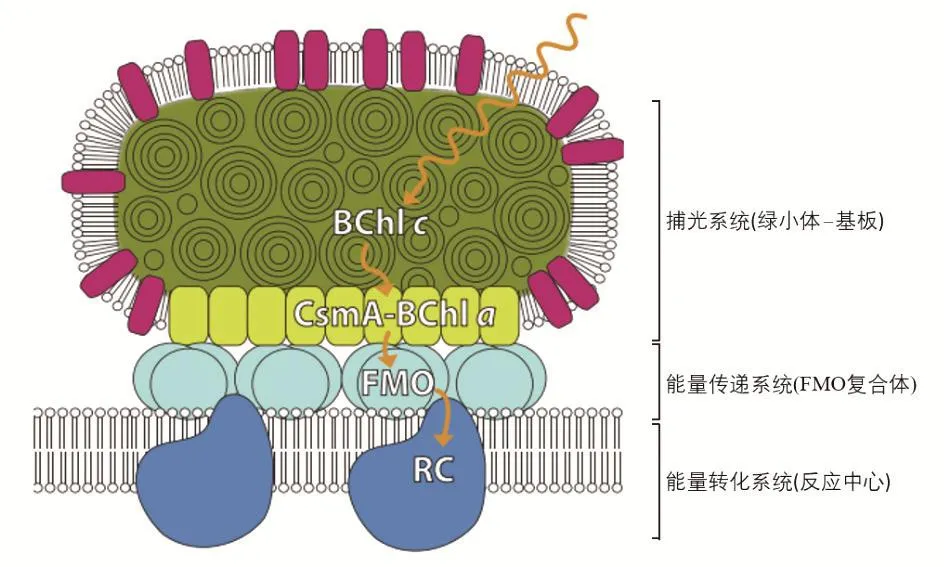
图2 绿硫细菌光反应系统示意图[22]
绿小体是由单层生物膜包裹数万个细菌叶绿素分子而形成的长120~200 nm、宽40~80 nm的椭球形结构,是自然界已知生物体内最大的捕光天线。绿小体内部不存在蛋白结构,叶绿素分子完全通过化学自组装的方式形成有序的片层结构,再由片层结构进一步弯曲重叠形成套筒状的椭球结构[23-26]。绿小体靠近细胞膜的一侧形成由细菌叶绿素a(BChl a)和CsmA蛋白构成的能量受体“基板”,通过该结构绿小体捕获的光能被传递至内侧FMO蛋白[22,27]。
FMO连接绿小体能量基板和反应中心,每个FMO包含3个呈C3轴对称排列的同质单体(图3)。每个FMO单体分子量约42 kDa,形状类似雪茄,结合8个细菌叶绿素(编号1至8号)。色素分子主要被包裹在β折叠片富集的蛋白外壳内部,其中,第1~7号细菌叶绿素分子排列较为紧凑,而第8号细菌叶绿素靠近相邻FMO单体中的1号细菌叶绿素[28-30]。每个FMO单体中的第3号细菌叶绿素的能态最低,因而被认为是FMO内部能量传递的终点[31-33]。FMO不仅作为能量传递体将激发能传递至反应中心,而且在强光照的环境下具有光保护功能[29]。
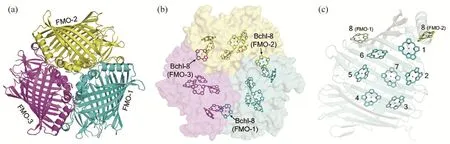
图3 FMO晶体结构及内部色素排列[31]:(a) FMO三聚体蛋白的晶体结构(平行C3轴视角);(b) FMO三聚体内部细菌叶绿素排布;(c) FMO单体内部细菌叶绿素排布(垂直C3轴视角)
绿硫细菌反应中心(GsbRC)由4个蛋白亚基(PscA/PscB/PscC/PscD)构成[34]。绿硫细菌C.tepidum基因组测序结果显示,该细菌基因组内仅存在核心亚基PscA的编码基因,而没有与PscA相似的第二个亚基存在,由此推测GsbRC核心为同质二聚体结构[35-36]。氨基酸序列比对分析表明,尽管PscA与PSI的核心亚基PsaA/B一致性(identity)较低,但其三维结构可能较为保守[37]。外周亚基PscB分子量约为23 kDa,包含231个氨基酸残基,其中,N末端存在多个富含脯氨酸(Pro)、丙氨酸(Ala)和赖氨酸(Lys)残基的重复片段。PscB具有两个铁硫簇结合位点并与PsaC的铁硫簇结合位点氨基酸序列高度保守[34]。PscD分子量约为15 kDa,生理功能尚不确定,推测其参与电子由反应中心向铁氧还蛋白(Fd)的传递[38]。遗传突变研究发现,PscB与PscD对于稳定FMO与反应中心所形成的复合物具有重要作用[34]。PscC是一个细胞色素蛋白(Cyt c551),分子量约为17 kDa,由C末端血红素结合结构域(结构已被解析)和N末端跨膜结构域(结构尚未见报道)构成[39]。
Permentier等[40]早期对GsbRC进行的色素定量分析表明,GsbRC内部结合大约20个叶绿素分子,包括16个细菌叶绿素(BChl a)、2个酯化叶绿素(Chl a670)和1对特殊细菌叶绿素(称为P840)[40-42]。
GsbRC为type-I型。与其他type-I型反应中心相比,GsbRC在蛋白亚基和色素组成上均存在较大差异,尤其色素数量明显减少。这些特征暗示GsbRC具有特殊的光合作用机制[7,10,34]。
尽管早期对于GsbRC的生化研究较多,但其原子结构的解析一直没有突破。Tsiotis等[43]最早利用扫描透射电子显微镜技术(STEM,100 kV)对C.tepidum反应中心进行成像分析,发现该复合体与蓝细菌光系统I单体颗粒的大小接近,呈14 nm长、8 nm宽且具有假二重对称的单体构造。Remigy等[44]通过改进样品制备方法获得更加完整的反应中心复合体样品,并通过STEM成像后得到反应中心结合一个FMO复合体(FMO-GsbRC)的低分辨率(17 Å)模型。BÍna等[45]利用透射电镜技术直接对绿硫细菌细胞膜样品进行成像分析,推测在生理状态下存在由2个反应中心和4个FMO复合体构成的超级复合体(4FMO-2GsbRC),且每个绿小体平均结合30个反应中心和60个FMO复合体。
近期,我们利用单颗粒冷冻电子显微镜技术解析了绿硫细菌FMO-反应中心复合体(FMOGsbRC)2.7 Å分辨率的原子结构,为阐明复合体内部能量传递机制提供了重要的结构基础[46]。
3 绿硫细菌FMO-反应中心复合体原子结构
3.1 整体结构模型
如图4所示,FMO-GsbRC复合体整体包括胞质侧的FMO和镶嵌在膜上的GsbRC两部分。整个复合体长度约16 nm,宽度约10 nm,高度约12 nm。GsbRC核心部分是两个呈C2对称的PscA亚基构成的跨膜同质二聚体,分别标记为PscA1和PscA2。三个FMO单体(分别标记为FMO-1、FMO-2、FMO-3)结合于GsbRC胞质侧且靠近核心亚基PscA1一端,而PscA2侧没有结合FMO。外周亚基PscB和PscD位于PscA二聚体核心上方,且均靠近FMO与PscA1的界面。该模型中缺少PscC亚基,推测其可能在样品制备中丢失[34,47]。
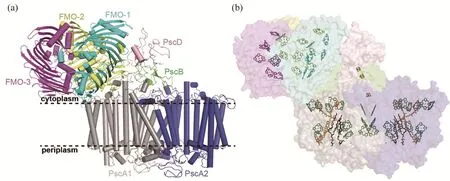
图4 绿硫细菌FMO-GsbRC复合体结构模型(PDB ID: 6M32):(a) 复合体蛋白结构;(b) 复合体内部辅因子空间排列
整个复合体共结合67个辅因子,包括FMO内结合的24个细菌叶绿素a(每个FMO单体结合8个细菌叶绿素a)、GsbRC结合的30个叶绿素(包括26个细菌叶绿素a和4个叶绿素a异构体)、4个类胡萝卜素(2个绿菌烯和2个绿菌烯酯)、4个脂分子(2个PG和2个MGDG)、2个钙离子,以及3个铁硫簇(Fe4S4)。
与日光杆菌反应中心(HbRC)和光系统I(PSI)的结构类似,GsbRC每个PscA亚基包含11次跨膜螺旋,分为天线结构域和电子传递结构域,铁硫簇FX位于两个PscA亚基对称轴且被两对半胱氨酸残基固定。GsbRC的跨膜区与紫细菌反应中心(PbRC)、HbRC、PSI和光系统II(PSII)的跨膜区存在很高的保守性,而非跨膜区(特别是周质侧)的结构差异明显,暗示其与各自不同的电子供体存在特异的相互作用。
3.2 反应中心辅因子排列
GsbRC结合的叶绿素分子数量(包括26个细菌叶绿素a和4个酯化叶绿素a)明显少于已报道的其他type-I型反应中心(HbRC结合60个叶绿素,PSI核心结合87个叶绿素),而与PSII核心结合的叶绿素数量(35个叶绿素和2个脱镁叶绿素)接近。不过,GsbRC与HbRC及PSI核心中叶绿素分子的排布具有很高的保守性(图5)。GsbRC的叶绿素排布为三个明显的叶绿素分子簇,即位于中心电子传递结构域的叶绿素分子簇,以及聚集于两侧天线结构域的叶绿素分子簇,且这些色素的空间位置和取向与PSII核心中相关叶绿素分子十分接近(图5)。因此,GsbRC的叶绿素空间排布具有type-I和type-II两种光合反应中心叶绿素分子的空间排布特点,暗示其可能作为光系统进化的祖先,通过后期进化而分裂成两种反应中心。

图5 GsbRC与三种反应中心(PSII-RC、HbRC、PSI-RC)核心叶绿素排列比较[46]
GsbRC的天线叶绿素分子在细胞膜平面呈双层排布,分别位于膜的胞质侧和基质侧,但两层叶绿素分子之间缺失在PSII、HbRC以及PSI核心的天线叶绿素分子层之间均存在的中间叶绿素分子(本文称为linker叶绿素),而是通过两个类胡萝卜素衍生物hydroxychlorobactene glucoside laurate (在PDB中标记为F39)连接,该分子的具体生物学功能尚不确定(图6)。

图6 GsbRC与三种反应中心(PSII-RC、HbRC、PSI-RC)叶绿素分子层排列比较[46]
3.3 电子传递链
GsbRC内两条电子传递链的辅因子排列如图7所示。三对叶绿素分子呈对称排列,相邻色素(P840-ACC、ACC-A0)中心镁原子距离分别为12.7 Å和10.0 Å。次级电子受体(A0)与第一个铁硫簇(FX)间中心原子的距离为18.1 Å,三个铁硫簇之间中心原子的相邻距离分别为15.2 Å和12.7 Å。构成反应中心特殊叶绿素对的两个细菌叶绿素分子中心镁原子间的距离为6.5 Å,卟啉环平面的垂直距离为3.3 Å。
对结构已解析的type-I型反应中心电子传递链进行比较可知:GsbRC与HbRC电子传递链中辅因子的排布相似,二者的两条电子传递链排列是对称的,且相邻辅因子间的距离接近;而在PSI核心中,两条电子传递链的排列是不对称的,且第三对叶绿素分子与第一个铁硫簇(FX)之间的距离明显大于HbRC和GsbRC电子传递链中对应的A0-FX间的距离,它们之间的电子传递是由一个醌分子介导的(图7)。然而在HbRC和GsbRC的电子传递链中,第三对叶绿素与铁硫簇之间均没有观察到醌分子,考虑到二者间的距离较近,醌分子可能并不是其间电子传递所必需的[10]。
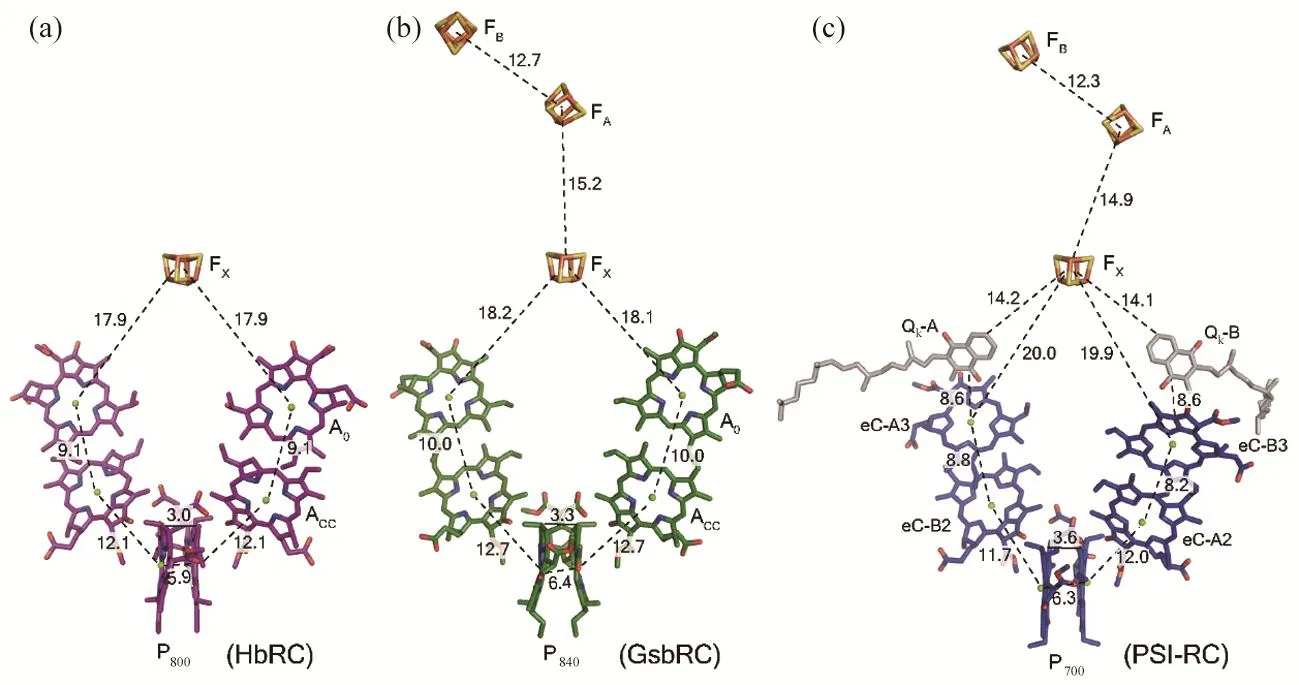
图7 三种type-I型反应中心电子传递链进行比较[46]:(a) HbRC;(b)GsbRC;(c)PSI-RC
3.4 FMO-反应中心复合体内部能量传递机制
在绿硫细菌的光反应阶段,光能被绿小体捕获后经FMO传递至反应中心。早期研究表明,能量在绿小体内部、绿小体与FMO间、FMO内部的传递效率接近100%,类似于高等植物捕光天线LHCI内以及由LHCI向PSI核心的能量传递效率。不过,在活体细胞中能量由FMO向反应中心的传递效率低于75%,在分离纯化的FMOGsbRC系统中能量传递效率更低(<50%)[48-53]。
由FMO-GsbRC冷冻电镜结构可知,FMO与GsbRC的膜平面呈倾斜排布,结合于FMO-2和FMO-3的细菌叶绿素分子(BChl-8)处于整个分子表面的最外侧,因而更容易从绿小体获得能量(图8)。
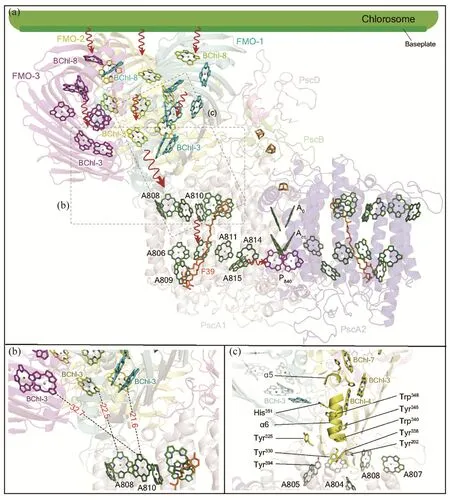
图8 FMO-GsbRC复合体内部可能的能量传递途径[46]。(a) 绿硫细菌“绿小体FMO-GsbRC”系统内部能量传递示意图;(b) FMO与GsbRC界面细菌叶绿素分子排列;(c) FMO与GsbRC界面一段富含芳香族氨基酸的螺旋结构
激发能经过FMO内部色素分子网络传递至反应中心,见图8(a)。在FMO与GsbRC之间的叶绿素分子相隔距离较远,其中,BChl-3 (FMO-1)和BChl-3 (FMO-2)与反应中心上层细菌叶绿素BChl-808和BChl-810的距离分别为22 Å和23 Å,而BChl-3 (FMO-3)与反应中心上层细菌叶绿素的最近距离超过33 Å(图8(b))。因此,能量由FMO向反应中心传递主要通过BChl-3 (FMO-1)和BChl-3 (FMO-2)。
在高等植物PSI-LHCI能量传递系统中,天线LHCI与PSI核心之间存在较多的gap chlorophylls,相邻叶绿素分子间的距离为8~13 Å,因而能量能够在色素分子间进行高效传递[54-55]。然而,在FMO-GsbRC系统中,FMO与GsbRC结合的色素分子之间存在较大的间隔,这可能是造成能量在FMO与GsbRC之间传递效率低的主要原因。
早期对FMO内部能量传递机制的研究表明,位于BChl-3和BChl-4附近的两个短α螺旋对于能量在色素分子间的分布存在明显的影响[56]。由FMOGsbRC结构模型可知,在FMO-2的两个细菌叶绿素分子(BChl-3和BChl-4)与PscA1结合的两个叶绿素分子(A805和A810)之间存在一段包含多个芳香族氨基酸的α螺旋(图8(c)),该结构可能对于能量从FMO向GsbRC的传递具有促进作用。
4 总结与展望
绿硫细菌反应中心是一种重要的光合细菌反应中心,代表了type-I光系统的起源。绿硫细菌反应中心原子结构的解析对于探究地球早期光合生物的光合作用机制、揭示两个光系统从早期光合反应中心的进化具有重要意义。绿硫细菌的光反应系统包括绿小体、FMO和反应中心三部分,但目前我们仅仅解析了其中一部分的空间构造,而完整光反应系统构造的解析对于阐明绿硫细菌的光合作用机制十分必要。
