应用二维相关同步荧光光谱研究市政污水中溶解性有机物组分*
2021-06-25于本心张广彩孙迎雪
于本心 张广彩 孙迎雪
(1.北京工商大学生态环境学院,北京 100048;2.中国环境科学研究院,流域水环境污染综合治理研究中心,北京 100012)
市政污水中溶解性有机物(DOM)约占总有机物质量的30%~40%[1],含有大量能够产生荧光的带有共轭键的官能团[2-4]。DOM的组分和含量不同,其荧光峰位置和荧光强度也就不同[5]。在一定浓度范围内,荧光DOM含量与其荧光强度有关[6]。而且,荧光光谱是一种简单快速、灵敏度高、选择性强、成本低廉的检测技术,已被广泛用于识别水中DOM的组分和半定量分析[7-10]。
荧光光谱中的同步荧光光谱和三维荧光光谱已经成功地应用于污水中DOM组分识别和解析,并用于市政污水中DOM组分的去除特征研究[11-13],但不能辨识荧光峰重叠的组分。利用二维相关(2D-COS)方法处理同步荧光光谱,不仅能通过延展荧光峰来分离重叠的荧光峰,而且能分析它们之间的相对含量,解释它们的降解转化过程[14-17],还可利用主成分分析(PCA)方法对数据进行降维[18]。
本研究运用同步荧光光谱分析北京某大型市政污水处理厂处理过程中市政污水的DOM,应用PCA进行数据降维,识别出不同荧光峰位置的DOM组分,利用光谱积分面积对各DOM组分进行半定量,并计算它们的去除率,最后引入2D-COS方法研究污水处理过程中各DOM荧光组分,可为优化污水处理工段和提升污水处理效率提供技术参考。
1 方 法
1.1 样品采集
水样采自北京某大型市政污水处理厂,该厂污水处理能力为1.0×106m3/d,分别在沉砂池(1#)、初沉池(2#)、厌氧单元(3#)、缺氧单元(4#)、兼氧单元(5#)、好氧单元(6#)和二沉池(7#)的出水口设置了7个采样点。在每个采样点采集两个平行样品,带回实验室后过0.45 μm滤膜后在4 ℃条件下保存,2 d内完成荧光检测。
1.2 同步荧光光谱检测
利用荧光分光光度计(Hitachi F-7000,日本)检测同步荧光。光源为150 W氙灯,光电倍增电压为700 V,激发和发射狭缝宽度均设为5 nm,响应时间为0.5 s,扫描速率为240 nm/min,设置扫描时仪器自动校正。同步荧光扫描的激发波长为260~550 nm,发射波长与激发波长的波长差为30 nm,以Mill-Q水为空白,水样光谱扣除空白[19-20]。
1.3 数据处理
用荧光分光光度计自带的FL Solutions 2.1软件计算各DOM组分光谱积分面积进行半定量。应用2D-shige软件绘制2D-COS同步荧光光谱的同步和异步图谱[21]。利用SPSS软件进行PCA。
2 结 果
2.1 同步荧光光谱特征
由图1可见,市政污水在不同处理过程中DOM同步荧光光谱都呈现出1个强尖峰和4个弱肩峰,其中强尖峰位于激发波长277 nm附近,属于类酪氨酸荧光峰(TYLF),由于该峰极强而覆盖了激发波长310 nm附近的类色氨酸荧光峰(TRLF),因此把这两个峰统称为类蛋白荧光峰(PLF),是市政污水DOM的主要成分,主要源于人类生活污水中的较新鲜蛋白质[22]。第1个弱肩峰位于激发波长330 nm附近,属于微生物代谢产物荧光峰(MLF)。第2和第3个弱肩峰分别位于激发波长370、420 nm附近,分别属于紫外光区和可见光区的类富里酸荧光峰(FLF)。第4个弱肩峰位于激发波长480 nm附近,属于类胡敏酸荧光峰(HLF)。总体而言,各荧光峰沿程减弱。
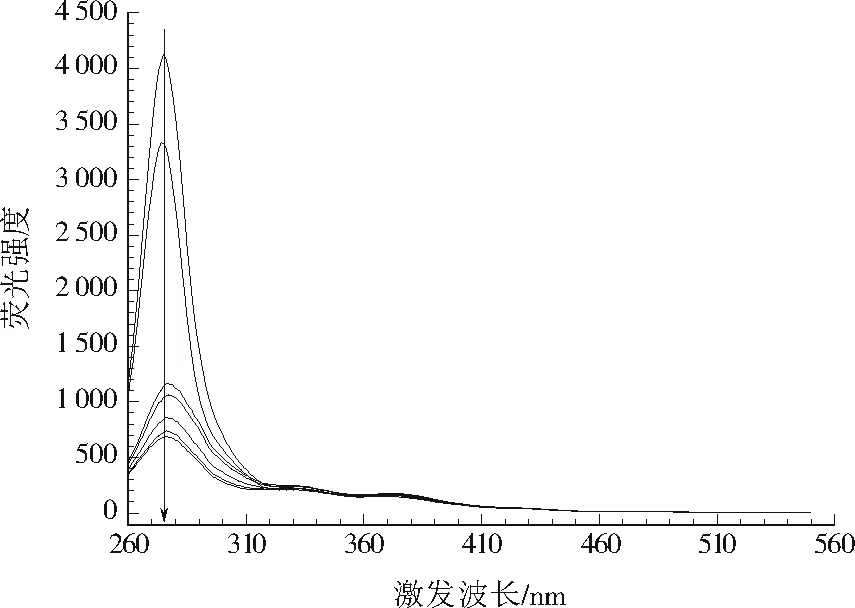
注:箭头所示的荧光峰由上到下依次对应采样点1#、2#、3#、4#、5#、6#、7#。
各处理单元中污水DOM组分的荧光强度见表1。PLF的荧光强度由大到小依次为1#、2#、3#、4#、5#、6#、7#,表明类蛋白物质在污水处理单元中持续被去除,尤其是3#中PLF荧光强度大幅下降。但MLF和FLF在3#中荧光强度最大,HLF在2#中荧光强度最大。
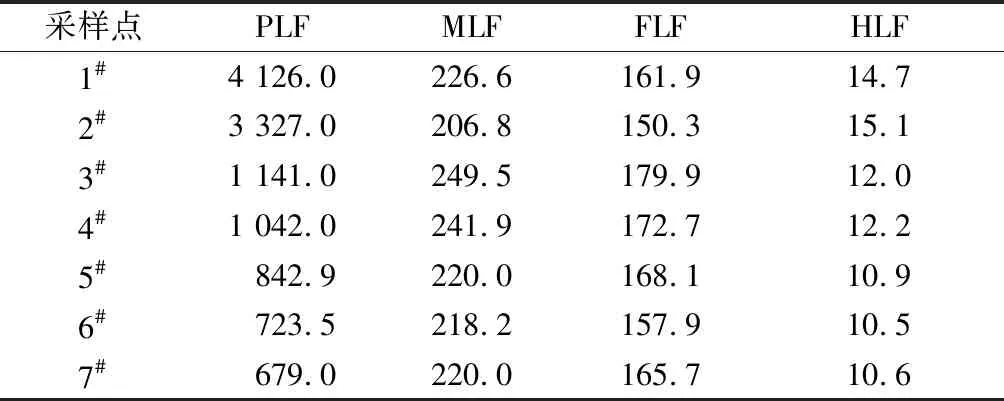
表1 各处理单元中污水DOM组分的荧光强度
2.2 同步荧光的PCA
KMO统计量为0.84,大于0.50,并且p<0.01,表明污水中DOM的同步荧光数据适用于PCA[23]。7个采样点的同步荧光光谱数据的共同度为0.994~1.000,表明同步荧光光谱数据在PCA过程中保留了大部分信息。对同步荧光光谱数据矩阵进行PCA,得到两个主成分,解释总方差的99.50%,其中主成分1(PC1)解释96.75%,主成分2(PC2)解释2.75%。
PCA结果见图2。由图2(a)可见,PC1的得分曲线呈现1个尖峰和4肩峰,其中尖峰(激发波长278 nm处)为PLF,第1个肩峰(激发波长332 nm处)为MLF,第2个肩峰(激发波长373 nm处)和第3个肩峰(激发波长425 nm处)为FLF,第4个肩峰(激发波长482 nm处)为HLF;PC2的得分曲线也呈现1个尖峰和4个肩峰,其中尖峰(激发波长274 nm处)为PLF,比PC1蓝移了4 nm,第1个肩峰(激发波长310 nm处)为被覆盖的TRLF,第2个肩峰(激发波长362 nm处)和第3个肩峰(激发波长415 nm处)为FLF,分别比PC1蓝移了11、10 nm,第4个肩峰(激发波长470 nm处)为HLF,比PC1蓝移了12 nm,在PC2中没有出现MLF,表明所有采样点的MLF均没有发生波长漂移现象。由图2(b)可见,7个采样点被分成了两组,第1组包括1#和2#,位于第1象限;第2组包括3#~7#,位于第4象限。

图2 PCA结果Fig.2 Results of PCA
2.3 半定量分析DOM组分的去除情况
为了更加准确地分析DOM的去除情况,分别对激发波长260~320、320~360、360~460、460~550 nm范围内的荧光强度进行积分来半定量表征PLF、MLF、FLF和HLF相对含量。PLF在1#~7#中的比例分别为86.55%、84.50%、70.10%、69.03%、65.81%、63.01%、61.17%,定量化地说明了PLF是污水DOM的主要成分。
PLF、MLF、FLF和HLF的总去除率分别为75.92%、1.38%、0.35%、20.71%,表明污水处理过程主要针对PLF进行去除。由图3可见,PLF在初沉池、厌氧单元、缺氧单元、兼氧单元、好氧单元和二沉池6个处理单元中的去除率分别为19.60%、50.90、7.76%、18.50%、14.08%、5.57%,其中在厌氧单元中去除率最大,说明PLF易于被厌氧微生物降解。MLF、FLF和HLF在一些处理单元中出现负的去除率,说明MLF、FLF和HLF很有可能是PLF经微生物代谢产生的中间产物。

图3 污水处理过程中DOM各组分的去除率Fig.3 Removal efficiency of each fraction in the sewage treatment process
2.4 2D-COS同步荧光分析
通过2D-COS同步荧光光谱的同步和异步图谱分析,可以把PLF中荧光峰重叠的TYLF、TRLF区分开来,但HLF由于荧光强度非常弱,在2D-COS同步和异步光谱中没有显现出来,TYLF、TRLF、MLF和FLF 4个同步荧光光谱的荧光峰荧光强度变化表明,在污水处理过程中,去除率为TYLF>TRLF>MLF>FLF。
3 结 论
利用同步荧光光谱分析北京某大型市政污水处理厂处理过程中市政污水的DOM,发现1个强尖峰和4个弱肩峰,1个强尖峰为PLF,是市政污水DOM的主要成分,第1个弱肩峰为MLF,第2和第3个弱肩峰为FLF,第4个弱肩峰为HLF。PLF在污水处理单元中持续被去除,主要靠厌氧微生物降解。MLF、FLF和HLF很有可能是PLF经微生物代谢产生的中间产物。通过2D-COS同步荧光光谱的同步和异步图谱可以把PLF中荧光峰重叠的TYLF、TRLF区分开来。
