水生态环境中邻苯二甲酸酯(PAEs)塑化剂的赋存及行为归趋
2021-06-25熊希瑶贺聪聪焦啸宇王成俊
熊希瑶,贺聪聪,焦啸宇,王成俊
(中南民族大学 资源与环境学院,武汉 430074)
自从20世纪70年代以来,邻苯二甲酸酯类(PAEs)塑化剂作为一种添加剂广泛应用于与人们生活密切相关的各类聚氯乙烯(PVC)包装材料、油漆、洗涤剂、医疗器材、个人护理品等日常用品中,由于PAEs在这些材料中未形成共价键,它极易浸出从而释放到环境中,并随着材料的老化和分解其释放速度加快[1-3].随着 PAEs 塑化剂引起的各种中毒事件的频发,其生物毒性及大量使用引发的环境问题受到了公众和学术界的关注.研究表明:PAEs 严重影响生物体生殖系统、呼吸系统、免疫系统甚至致癌,它被列为本世纪初重要的内分泌干扰物类环境污染物之一[4].此外,PAEs在生物体内能迅速代谢为毒性更强的邻苯二甲酸单酯(MPAEs).据报道:邻苯二甲酸单酯(2-乙基己基,MEHP)会增加精子的死亡,并导致人类绒毛外滋养层细胞被侵蚀[5];邻苯二甲酸单正丁酯(MnBP)、邻苯二甲酸单甲酯(MMP)和邻苯二甲酸单乙酯(MEP)会破坏人体DNA造成遗传疾病[6].作为PAEs的代谢产物,MPAEs通常会随尿液排入生活污水,而常规污水处理工艺不能完全去除此类污染物,因此环境水中会残留这些物质[7].除排放的生活污水外,微生物在自然水生态环境中降解PAEs也可形成MPAEs[8],目前已在湖泊、海洋、河流、生活污水等环境水中检验出高浓度MPAEs.
由于PAEs塑化剂的内分泌干扰特性及其代谢物的低挥发性、低水溶性,且易通过食物链进行生物富集,它对生物体生殖系统和水生态环境具有巨大的潜在危害.本文对水生态环境中PAEs塑化剂及其代谢物的赋存形态及浓度、迁移转化规律和降解途径等方面的研究进展进行了概述,以期为水生态环境中PAEs塑化剂的防治控制方法或技术提供基础数据及理论依据.
1 PAEs塑化剂的理化性质
邻苯二甲酸酯(PAEs)塑化剂,是一种重要的环境类激素化合物,为无色透明的油状液体,有特殊刺激性气味,常温下不易挥发,难溶于水,可溶于多种有机溶剂,如甲醇、正己烷、乙腈、乙酸乙酯等.PAEs塑化剂的化学结构是由两个可塑的非线型脂肪侧链和一个刚性平面芳香环组成,其分子结构式如图1,其中R和R′为烷基、苯基或烷基[9].
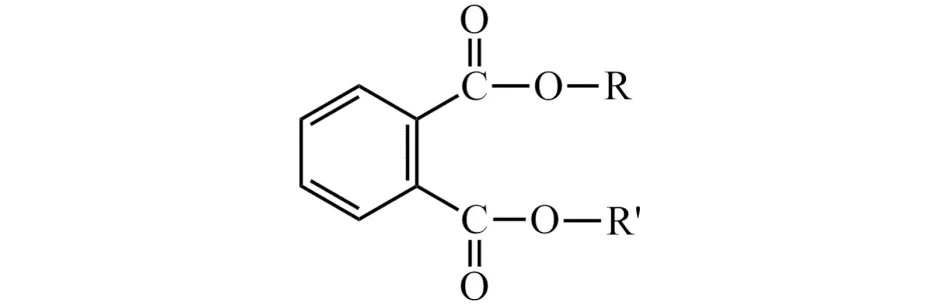
图1 邻苯二甲酸酯的分子结构式Fig.1 Chemical structure of phthalates molecule
有机污染物的理化性质,包括水溶解度(Sw)、蒸气压(Vp)、空气-水分配系数(KAW)、辛醇-空气分配系数(KOA)、辛醇-水相分配系数(KOW)及总有机体分配系数(KOC)等,不仅控制着污染物在环境中的行为及迁移转化,还控制着其在大气圈、岩石圈、水圈和生物圈等不同储层之间的交换[10]. 常见PAEs的主要理化特征如表1所示[11],表1中PAEs塑化剂的Sw随着碳链长度的增加而降低;KOW值表明PAEs塑化剂均具有较强脂性亲和力且其脂溶性随着碳链长度的增加而增强,因此在水生生物体中极易富集造成毒性放大;KAW和KOA分配系数也有同样的规律,随着PAEs塑化剂烷基链的增加,碳分子数量的增加,logKAW和logKOA值明显增加,饱和蒸气压降低,说明分子量越高的PAEs疏水性越强,更容易向非极性介质迁移,则生物体中浓度越高.
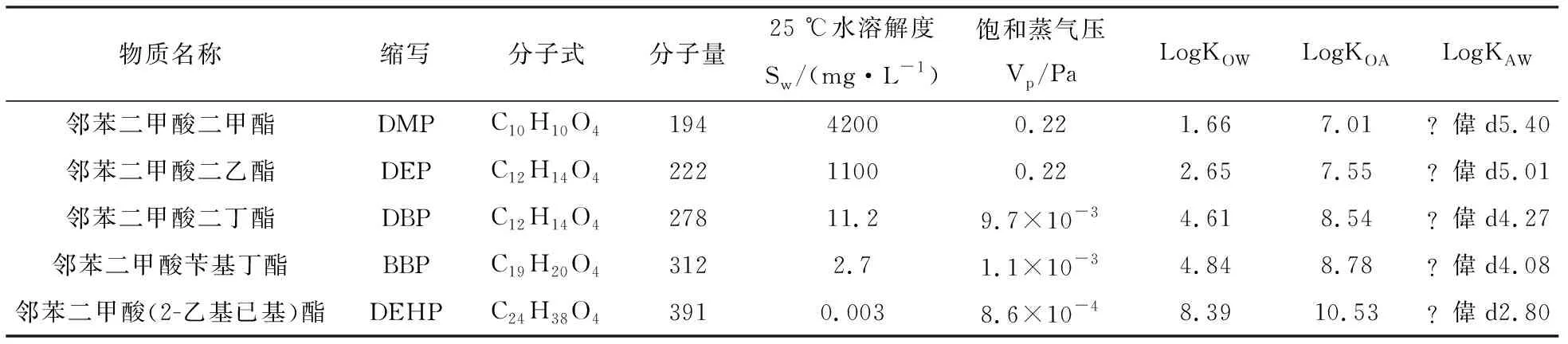
表1 常见PAEs的主要理化特征Tab.1 Main physical and chemical characteristics of common PAEs
2 PAEs塑化剂在水生态环境中赋存
水生态环境中的PAEs塑化剂的含量与其溶解度有很大关系:烷基链侧链越短、分子量越低则越易溶于水;相反侧链越长,分子量越高越难溶于水,且在未被沉积物吸附或结合时,后者一般呈透明油状,漂浮于水面.PAEs塑化剂可通过直接或间接途径进入地表水和地下水中:直接途径包括固体废弃物、大棚塑料薄膜经雨水冲刷、土壤浸润或者工业废水和生活污水的排放进入;间接途径是该类有机化合物进入大气后,通过雨水淋洗或干沉降转移到地表水环境中[12].目前,环境研究者们对水生态环境中PAEs塑化剂的含量进行了比较系统和详尽的检测,多数检测到的PAEs塑化剂在10-6级.黄晓丽等[13]研究了长春市不同位置的4个湖泊表层水体中PAEs塑化剂的含量,结果表明:4个湖泊水体中PAEs塑化剂的总浓度(∑PAEs)范围为3.02~13.03 μg·L-1,随着季节的变化∑PAEs的含量有很大差异:在5、6月和7月DBP和DEHP的平均浓度分别为1.20~4.30 μg·L-1和2.86~4.52 μg·L-1.李新冬等[14]对章江赣州城区段水体中PAEs塑化剂的含量进行研究,结果显示:∑PAEs的浓度为0.401~4.35 μg·L-1,主要污染物为DOP.受降水影响,各时期∑PAEs的顺序符合以下规律:枯水期>平水期>丰水期,主要是由于降水可以稀释污染物浓度;另外水体下游PAEs塑化剂的含量显著高于上游水体中含量,表明PAEs塑化剂是比较稳定特性及累积性.LEE等[15]研究了韩国峨山湖中PAEs的含量,结果发现:湖水中∑PAEs在夏季最高,秋季最低,秋季和夏季的平均浓度分别为(0.021±0.041) μg·L-1和(0.449±0.378) μg·L-1,其中DEHP和DBP被检到频率最高,分别占57.4%和53.2%;湖水中PAEs塑化剂的来源受湿沉降和径流的影响,上游工业园区的废水是娥山湖中PAEs塑化剂的主要污染源.钟嶷盛等[16]对地表水体中PAEs塑化剂的浓度分布进行了研究,结果显示:水体中PAEs塑化剂的总含量为6.4~138.1 μg·L-1,平均浓度为27.9 μg·L-1,主要污染物为DEHP和DBP,并且以东南部和西北部公园的水体污染最为严重.另外,与基质材料混合的PAEs塑化剂也可直接释放到大气中,气态分子的形式存在的PAEs塑化剂可沉积并直接吸附在大气颗粒上,再通过降雨将大气中的PAEs塑化剂迁移到地表水中,导致其在河流、湖泊及沉积物中广泛分布[17-18].
3 PAEs塑化剂在水生态环境的行为归趋
PAEs塑化剂属于中等极性物质,一般难溶于水,水体中PAEs塑化剂的存在形态与它的分子量有关,主要有三种形态:吸附于悬浮物表面的吸附态、溶解于水中的溶解态及转移至沉积物中的沉积态,其中沉积物中PAEs塑化剂最不易分解,会造成二次污染[19].由于PAEs塑化剂的蒸气压较低,在水中的挥发性低,PAEs在进入环境水中后很难迁移到大气中,所以其迁移转化过程主要发生于水相中各种介质中,主要包括水解、吸附、光化学转化、生物降解等[20].
3.1 水解行为
PAEs塑化剂的水解是分子中的羰基起决定性作用,过程一般情况分为两步:首先水解为单酯和醇,再二次水解为邻苯二甲酸和醇,其水解速率会受到醇的空间位阻的影响[21-22].水体pH对PAEs塑化剂的水解也有影响:中性条件下可忽略不计,其水解半衰期约为几年,最长的可达100年以上[23];酸性环境中的水解速率仅略快于中性环境,而碱性环境中的水解速率相当于酸性环境中的四倍[24],但水解并不能使其完全矿化.因此,PAEs塑化剂的水解作用并不是该类物质在自然水生态环境中降解的主要途径.
3.2 环境介质间的迁移
由于PAEs的疏水性和高辛醇水分配系数,可被土壤、沉积物及一些悬浮泥沙中的有机物质所吸附,实现PAEs在液相和固相之间的重新分配.在一定条件下,污染物通过吸附、沉降、扩散等方式进入沉积物,但沉积物对有机物的吸附是水体中有机物迁移的主要途径.沉积物对PAEs塑化剂的吸附过程受其溶解度的影响,与KOW呈正相关,水中的PAEs塑化剂被沉积物或悬浮颗粒吸附是迁移的重要原因.烷基链短的PAEs物质,如DMP、DEP在水中溶解度较高,KOW较低,易通过光降解或生物降解等其他途径去除;而长链的PAEs,如DEHP难溶于水,KOW较高,易被吸附在沉积物或悬浮颗粒上.PAEs类化合物在沉积物中的吸附并不随着浓度的增加而呈线性增长,而是与沉积物的有机组分有关.
WANG等[25]通过固相萃取(SPE)系统测定了长江武汉段PAEs塑化剂在沉积物的分布,结果显示:枯水期和丰水期主流沉积物中PAEs的浓度范围分别为76.3~275.9 μg·g-1和151.7~450.5 μg·g-1,但计算得出的沉积物和水相之间DBP和DEHP的KOC均高于其理论值,说明DBP和DEHP在枯水期有从水相向沉积物转移的趋势,而在高水期有从沉积物向水相转移的趋势.有机碳分配系数KOC是衡量水生态环境中沉积物吸附污染物能力的重要指标,ZHANG等[26]报道了DMP在河流的KOC值为55.0~360 L·kg-1,SULLIVAN等[27]报道了DEHP的KOC范围为1.2×10-4~1.0×10-6L·kg-1,表明不同类PAEs塑化剂在土壤沉积物中KOC差异很大.造成上述现象的原因可能是由于沉积物中可溶性的腐殖质与PAEs强烈结合,增大了PAEs的表观水溶性,减少了表观沉积物吸附;另一个原因可能是与土壤沉积物中OM值有关.ZHANG等[28]研究了珠三角水产养殖塘中PAEs类污染物的分布,结果表明:在∑PAEs与沉积物OM之间(y=1.84x+2.72,R2=0.39,P=0.035)、DEHP与沉积物OM(y=2.13x-2.04,R2=0.38,P=0.025)以及DNOP和沉积物OM之间(y=0.024x-0.023,R2=0.28,P=0.012)都观察到显著的正相关,说明OM可能会影响沉积物中PAEs的浓度.ZENG等[29]对城市湖泊中水的pH、DOC以及沉积物的TOC和pH进行了调查,调查发现:水的pH值和DOC与沉积物的pH值和TOC之前呈弱相关.这种情况可能是由于较低的pH值可以使氧含量降低,使降解速率降低,有助于有机物的积累.
悬浮颗粒物的吸附也是水中PAEs塑化剂迁移的重要方式,粒径的大小对吸附有着至关重要的影响.马晗宇[30]选用PAEs中的DMP、DEP、BBP和DOP作为研究对象,标准土GSS-2和GSD-9作为水中颗粒物来源,通过过滤的方法分离PAEs溶液中各粒径颗粒物,将颗粒物分为4级:10、2、0.45、0.1 μm,分析PAEs在不同粒径颗粒物和水相中的分布情况.实验发现:DEP和DMP主要分布在水中,各级颗粒物中这两种物质吸附量很少,DOP主要分布在粒径10 μm的颗粒物上,而BBP会随着颗粒物种类的不同分布情况发生改变,这种现象可以用它们的不同KOW来解释.DMP和DEP的KOW相对较低,大部分分布于水相;而BBP和DOP的KOW相对较高,所以多数分布于颗粒物上.BBP的特殊性很可能是取决于自身结构和颗粒物表面有机碳含量.HE等[31]对巢湖中悬浮颗粒物(SPM)系统中PAEs的分布进行研究,结果显示:多种PAEs在水相和SPM相表现出不同季节性趋势,logKOC的平均值从DEHP的2.38 ± 0.86到DBP的3.98±0.66,且每种PAE的logKOC值大约相差2~3个单位,所以很难确定PAEs塑化剂在水体中的分布是否处于平衡状态,logKOC和logKOW之间未发现线性关系,因此KOC可能不适合描述水体SPM系统中PAEs塑化剂的分布.
3.3 生物降解
在自然水体中,污染物水解速率缓慢且不易完全矿化,其光解速率与水体中有机质和日光光通量有关,易造成二次污染.因此,生物降解是水生态环境中有机污染物物降解的重要途径之一[32].微生物对PAEs塑化剂的降解方式有三种:一是以PAEs塑化剂为唯一碳源和能源进行代谢降解;二是微生物之间相互协同作用对PAEs塑化剂进行降解;三是PAEs塑化剂作为难降解有机污染物同生长基质以共代谢的方式进行降解[33].
目前研究主要致力于从环境介质中分离高效的邻苯二甲酸酯降解细菌,达到降解目的.李文兰等[34]在活性污泥中分离出能高效降解邻苯二甲酸丁基苄酯的降解菌群,能在1 d内降解90%以上的BBP,该活性污泥对BBP的降解符合一级动力学,其降解速率随着BBP浓度的增加而降低,说明高浓度的BBP对生物降解有抑制作用.LIANG等[35]从河流污泥中分离出Acinetobactersp.,JDC-16能以DEP为唯一碳源并使其降解.以上对PAEs塑化剂的生物降解都具有专一性,分离出的菌株和菌群只能对某一种物质完成生物降解.PAEs塑化剂的完全矿化需要多种代谢基因和酶,因此有些被筛选出的菌株并不能使PAEs塑化剂完全矿化.在自然环境中,PAEs塑化剂也可通过各种微生物的协同作用来完全降解[36].邻苯二甲酸二辛酯(DOP)在Gordoniasp.菌JDC-2和Arthrobactersp.菌JDC-32的共同作用下,可以在48 h内完全降解[37].梁浩花等[38]从土壤中筛选得到一种以DMP、DnBP和DEHP为碳源和能源的细菌MB1,可同时降解DMP、DnBP和DEHP,其降解率分别达99.62%、99.65%和55.26%.经过形态学、生理生化特征和16SrDNA序列鉴定分析,该细菌为微杆菌.除细菌外,某些真菌也可以降解PAEs塑化剂.王静雯[39]结合形态学和ITS rDNA序列分析方法,确定一株名为A.versicolorIR-M4的曲霉,证实该曲霉菌株在降解过程中产生的二酯酶与单酯酶均具有很高的选择性和特异性.
对于PAEs塑化剂的生物代谢途径,烷基链和芳香环之间酯基的裂解是常见的初始步骤.在好氧条件下,邻苯二甲酸酯经水解过程后,通过双加氧酶催化途径分解:邻苯二甲酸4,5-双加氧酶将PA分解成顺式4,5-二羟基邻苯二甲酸;邻苯二甲酸3,4-双加氧酶将PA分解成顺式3,4-二羟基邻苯二甲酸[40].邻苯二甲酸被转化为原儿茶酸等双酚化合物,它是芳香族化合物重要的中间代谢物.原儿茶酸通过邻位或间位裂解转化为相关的有机酸,并在芳香环裂解酶的帮助下形成三羧酸循环(TCA循环),最终矿化为CO2和H2O[41].此外,像DMP和DEP这类短链的PAEs塑化剂,在降解过程中不产生单酯,可直接转化为邻苯二甲酸[42].对于长侧链的邻苯二甲酸,可通过每次去除一个已基的β-氧化的方式来缩短侧链长度,从而更容易被降解[43](见图2).
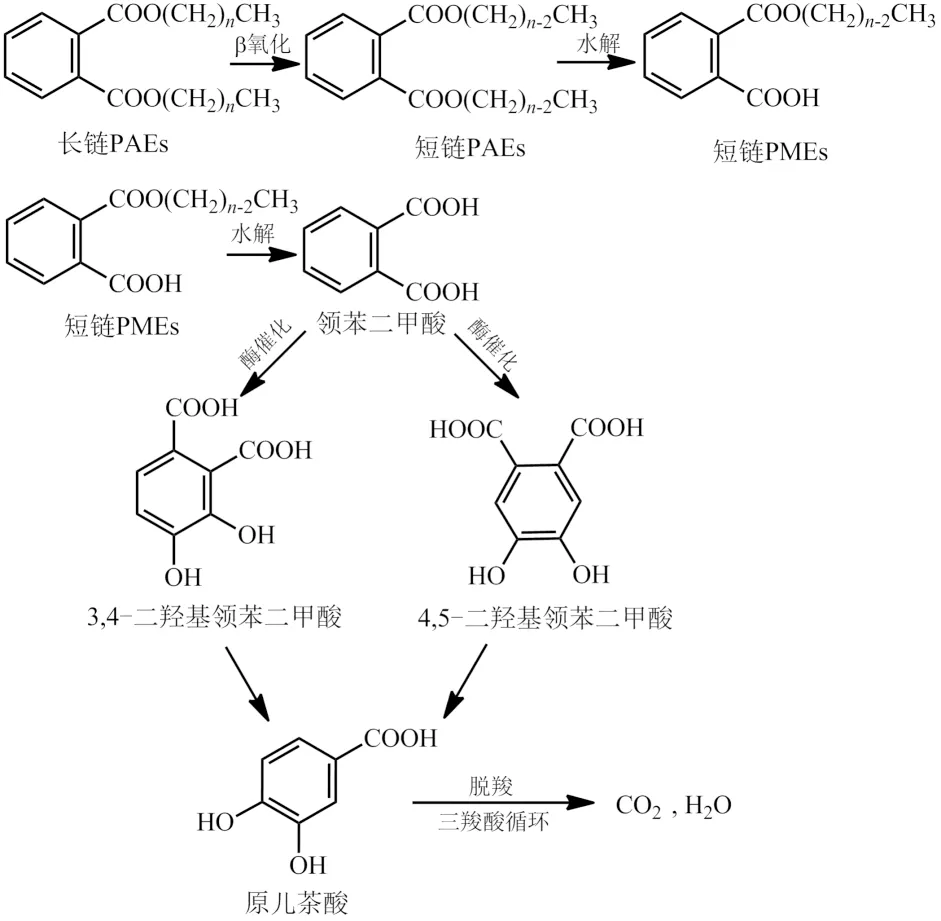
图2 有氧条件下PAEs的生物降解途径Fig.2 Biodegradation pathway of PAEs under aerobic conditions
研究表明:由于缺乏营养条件,PAEs塑化剂的厌氧生物降解要比好氧生物降解慢得多[45].在厌氧条件下,PAEs塑化剂先代谢生成邻苯二甲酸单酯和相应的醇,另一个酯基裂解再生成邻苯二甲酸,进一步通过脱羧作用转化为苯甲酸,苯甲酸再继续裂解成CO2、H2和乙酸盐[46-47],最后乙酸盐转化为甲烷形成终产物(见图3).
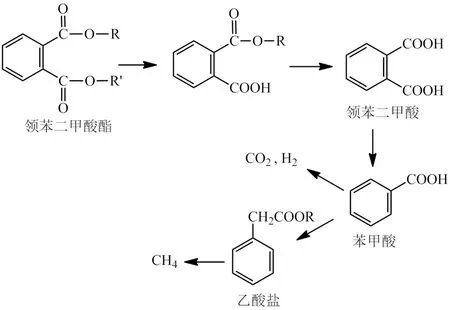
图3 无氧条件下PAEs的生物降解途径Fig.3 Biodegradation pathway of PAEs under anaerobic condition
3.4 光化学转化
PAEs塑化剂在水环境中的光化学转化分为直接光解和间接光解.直接光解是生色团吸收太阳辐射中波长(λ)为290~400 nm的光子能量,使分子由基态转化为激发态,从而使分子化学键断裂或结构重排生成小分子的过程.间接光解又分为两类:一类是环境水体中的光敏物质如天然有机质(NOM)吸收光子后变为激发态3NOM*,激发态3NOM*通过分子碰撞将能量传递给PAEs塑化剂从而发生降解,又称敏化光降解;另一类是水中的共存天然阴阳离子(如Fe3+、NO3-等)或其络合物先通过光诱导产生·OH、1O2、水合电子等活性物质,再通过氧化还原等方式将PAEs塑化剂降解[24].当化合物的吸收光谱与太阳光谱重合较多且辐射足够强时,才可以通过直接吸收光子发生有机污染物的直接光解.然而在自然水生环境中,PAEs对λ>300 nm的光吸收较少,很难发生直接光解反应[25].因此环境水中,间接光解是PAEs塑化剂污染物在环境地表水中降解的主要途径.

(1)
(2)
(3)
(4)

除了这些天然有机质外,一些半导体催化剂也可以进行光催化降解有机污染物[52].研究发现TiO2通过吸收光子能量,产生电子-空穴,空穴夺取吸附在DEHP上的电子,与TiO2表面吸附的OH-反应生成·OH,DEHP的一条侧链与·OH发生加成反应分解成邻苯二甲酸单酯和侧链生成五元环状的中间体物质,进一步在酸性环境条件下转化邻苯二甲酸酐,而邻苯二甲酸单酯继续脱酯生成邻苯二甲酸,最终两者都被氧化成二氧化碳和水[53].
4 展望
目前世界各国都面临PAEs塑化剂带来的严峻环境问题.近二十年来,科学工作者对PAEs塑化剂的理化性质、生物降解、光催化及其许多分析检测方法有突破性的进展.虽然可以通过各种方法从不同的环境基质中消除PAEs塑化剂,但其广泛使用和永久排放导致其在环境中无处不在.现有的防治控制方法仅在于特定的系统中,缺乏普适性,因此今后需要从以下方向进行深入研究.
(1) PAEs塑化剂在环境中的迁移及行为归趋研究:主要针对瓶装水、饮用水和在植物吸收中的迁移转化,探讨植物吸收途径和塑料瓶中的PAEs塑化剂迁移到水中的物质和浓度,了解PAEs塑化剂在人体内的暴露情况与健康影响.
(2) PAEs塑化剂代谢产物的研究:进一步深入研究人体中PAEs塑化剂代谢途径,研究特定代谢产物的形成机制及其动力学,可用作生物标记物以评估人体对PAEs塑化剂的代谢情况.
(3)改变PAEs塑化剂与塑料基质结合方法及耦合程度:由于现阶段塑料制品在工农业生产和生活中的不可替代性,因此目前不能完全禁用,所以需进一步探索改变PAEs塑化剂与塑料基质结合方法,可使其不易从塑料制品中析出.
(4) PAEs塑化剂的替代品的开发:面临现今环境污染的情况,开发环境友好型或者易降解性塑化剂替代品,从源头上解决PAEs塑化剂带来的环境问题.
