胰腺腺泡细胞癌的临床特点和病理特征及基因突变分析
2021-06-25韩家伟王欢时霄寒李勃高绥之沈硕张国虓蒋慧边云郭世伟金钢
韩家伟 王欢 时霄寒 李勃 高绥之 沈硕 张国虓 蒋慧 边云 郭世伟 金钢
1海军军医大学第一附属医院胰腺外科,上海 200433;2海军军医大学第一附属医院病理科,上海 200433;3海军军医大学第一附属医院影像科,上海 200433
胰腺腺泡细胞癌(pancreatic acinar cell carcinoma, PACC)是一种罕见的可分泌胰酶的恶性肿瘤[1],起源于胰腺腺泡细胞和终末分支胰管,由日本学者Berne于1908年首次报道[2]。PACC占胰腺外分泌肿瘤的1%~2%[2-3],发病率较低,恶性程度高,预后较差。其组织病理学表现为大小相对均匀的肿瘤细胞排列成腺泡状或实性巢状[4],分化较好的肿瘤细胞可产生胰腺外分泌酶,主要包括胰蛋白酶、胰脂肪酶和胰糜蛋白酶[3]。PACC发病原因尚不明,染色体不稳定性、基因突变等可能在其发生和发展过程中起到一定的促进作用[5]。本研究总结34例PACC患者的临床表现、病理特征、基因突变及随访资料,并结合相关文献进行分析,以提高对该疾病的认识和诊断水平。
资料与方法
一、临床资料
收集2009年12月至2018年7月间海军军医大学第一附属医院胰腺外科收治的34例经病理证实的PACC患者的临床资料。其中男性23例(68%),女性11例(32%)。年龄25~75岁,平均54岁。体重指数为17.6~34.0 kg/m2,平均22.7 kg/m2;其中<18.5kg/m23例(9%),18.5~24.0 kg/m223例(68%),>24.0 kg/m28例(23%)。
二、方法
记录患者的临床症状、体征、实验室及影像学检查结果、手术方式、切除标本的病理学检查结果。肿瘤分期依据第8版美国癌症协会(American Joint Committee on Cancer, AJCC)标准。采用免疫组织化学法检测胰腺肿瘤组织α1抗凝乳蛋白酶(α1-ACT)、极低分子量细胞角蛋白(CAM5.2)、突触素(Syn)、铬粒素A(CgA)的表达。所有抗体均购自美国Dako公司,按试剂说明书操作。采用第二代基因测序技术对肿瘤标本进行基因突变检测,由北京诺禾致源测序公司完成。通过门诊或电话随访获得患者的生存数据,随访时间为2010年1月至2020年7月。
结 果
一、临床资料
34例患者中21例(62%)主诉腹痛或腹胀,4例(12%)皮肤或巩膜黄染,9例(26%)为体检发现。实验室检查示术前总胆红素5.6~308 μmol/L,平均40.6 μmol/L,直接胆红素2.3~304 μmol/L,平均24.8 μmol/L;血白蛋白29~48 g/L,平均41 g/L;血淀粉酶16~247 U/L,平均80 U/L。CA19-9升高7例(20.6%),CEA升高3例(8.8%),AFP升高7例(20.6%)。
增强CT检查见病灶呈不规则状,表现为不均匀略低密度,内可见囊变、坏死区(图1)。
二、手术方式及术后并发症
34例患者中行胰十二指肠切除术9例,保留幽门的胰十二指肠切除术4例,胰体尾联合脾切除术4例,胰体尾联合脾+胆囊切除术2例,胰体尾联合脾+近端胃切除术2例,胰体尾联合脾+左侧肾上腺切除术4例,胰体尾联合脾+特殊肝段+部分胃切除术2例,胰腺节段切除+胰肠吻合术4例,全胰切除术2例,智能臂辅助胰体尾联合脾切除术1例。手术时间75~260 min,平均150 min。术中出血量120~1 800 ml,平均550 ml。术中输血量0~3 000 ml,平均684 ml。
术后并发A级胰瘘5例,B级胰瘘4例,C级胰瘘(伴腹腔感染)1例。并发胃排空障碍3例。1例因延迟性腹腔出血而进行二次手术。经积极对症治疗,患者均恢复良好。术后30例获得随访,4例失访,术后生存时间为3~45个月,中位生存期为38.3个月。
三、PACC的病理学特征
34例患者肿瘤位于胰头部14例(41%),胰体尾部19例(56%),胰颈部1例(3%)。肿瘤最长径为1.5~15.5 cm,平均5.4 cm。PACC肿瘤通常单发,偶见多发,质地软而均匀,切面多呈灰白色。镜下见肿瘤细胞排列呈腺样或腺泡样(图2)。神经浸润21例次(62%),脉管癌栓16例次(47%)。Ⅰ期4例(12%),Ⅱ期14例(41%),Ⅲ期14例(41%),Ⅳ期2例(6%)。免疫组织化学染色显示,34例α1-ACT(图3A)和CAM5.2(图3B)均表达阳性,8例(23.5%)Syn阳性表达,6例(17.6%)CgA阳性表达。Ki-67表达9%~70%,平均41%。
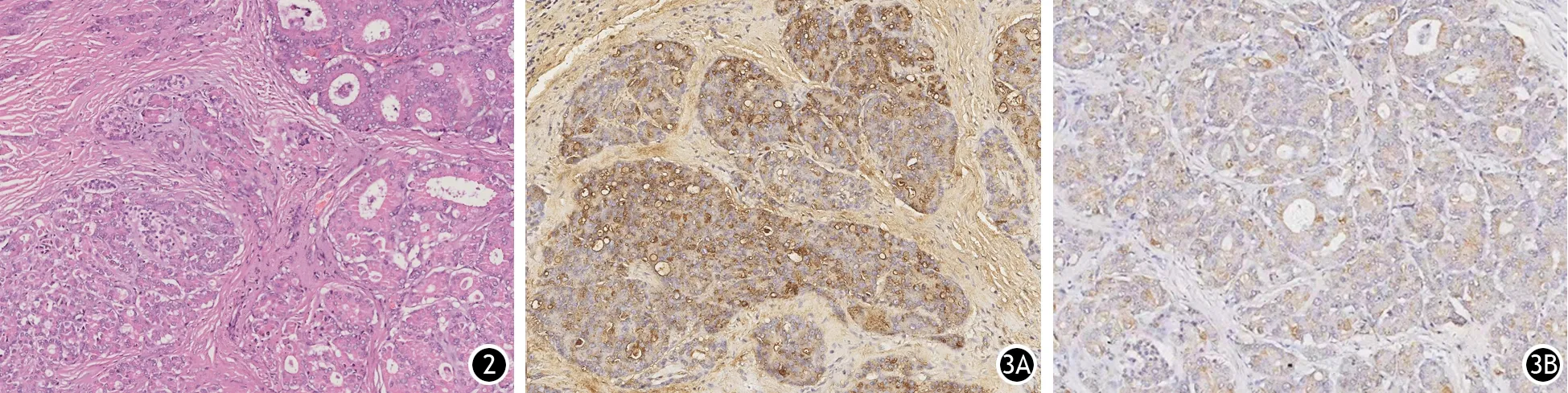
图2 PACC肿瘤细胞呈腺泡样排列(HE染色 ×100) 图3 PACC肿瘤组织α-1抗胰蛋白酶(3A)和极低分子量细胞角蛋白(3B)表达阳性(免疫组织化学染色 ×100)
四、基因突变
6例患者行肿瘤组织基因突变检测,结果显示,2例BRCA2突变(7155C>G),1例K-ras突变(35G>T),1例RET突变(200G>A),1例LKB1突变(234G>T),1例K-ras和RET双突变(35G>A、1798C>T)。
讨 论
PACC的发病率远低于PDAC,占胰腺肿瘤的1%左右[6]。PACC通常好发于老年患者,高峰年龄约60岁,男性发病率高于女性,男女发病比例约为2∶1,青少年发病少见[7]。Kitagami等[8]报道了目前为止病例数量最多的115例PACC患者,其中男女比例为77∶38,年龄30~85岁,平均59.6岁。本组患者男女比例2.1∶1, 平均54岁,与文献报道相似。但本研究中患者的平均年龄和最小年龄均小于以上文献,似有年轻化趋势。
随着影像技术的发展,通过CT和MRI检查,可发现一些特殊影像学表现以辅助诊断PACC。其病灶多表现为少血管,呈实性或囊实性,囊性区域无强化,实性区域的强化亦低于周围正常胰腺组织[8]。有文献报道,若在影像学上出现边界清晰的较大的外生性肿块,且没有明显的胰管或胆管扩张,应考虑PACC的诊断[9-10]。
目前确诊PACC需要依靠组织病理学检查,常需和PDAC相鉴别。PDAC多见于老年男性,肿瘤体积相对较小,具有嗜神经生长和围管性浸润的特点,易侵犯或压迫胆胰管而出现梗阻性黄疸,预后差。混合性腺泡-内分泌混合型癌兼有腺泡细胞癌和内分泌肿瘤的特点,分别表达胰腺腺泡细胞和内分泌标志物。鉴别诊断需要依靠免疫组织化学结果,PDAC多表达CEA、CA19-9,不表达α1-ACT和神经特异性烯醇化酶(NSE),而胰腺神经内分泌肿瘤则多表达Syn、NSE、CgA。在PACC中散在分布的内分泌细胞可形成小灶性内分泌细胞结节,可表达CgA和Syn[11-12],但α1-ACT和CAM5.2表达更常见。本研究34例患者的α1-ACT和CAM5.2均呈阳性表达,表明其在PACC的诊断方面具有较高的价值。
基因测序技术也越来越多地应用于肿瘤学领域。本研究6例患者的基因测序结果发现,BRCA2、K-ras、RET和LKB1基因发生突变。有文献报道[13-14],在PDAC中TP53、Smad4、K-ras和BRCA等基因突变较常见。相比之下,PACC中TP53和Smad4突变频率较低,而BRCA、K-ras基因突变则较常见。K-ras在调节细胞增殖的信号通路中发挥着关键作用[15],而BRCA2基因突变则与对化疗的敏感性相关[16],两者为胰腺癌的治疗提供了新思路。PACC肿瘤发生的分子途径与PDAC不同,需要进一步的研究来加深对其分子发病机制的了解,以寻求新的治疗方法。
目前对于确诊的PACC,多采取以手术为中心的多学科联合治疗。对于可切除的PACC,手术是最有效的治疗方法。本组患者中位生存期为38.3个月,经手术治疗,大多数患者预后良好。对于手术不能切除的患者,目前提倡包括放疗、化疗和生物靶向治疗等综合治疗,可明显提高患者的生存期。Kitagami等[8]报道115例PACC患者中,76.5%的患者肿瘤切除后,5年生存率为43.9%;Wisnoski等[3]利用美国SEER数据库(1988~2003)报道了672例PACC患者,发现局部可切除的PACC患者预后明显好转, 5年生存率为72%,而局部可切除的PDAC患者的5年生存率仅为16%。Hall等[17]使用肿瘤异种移植小鼠模型的研究表明,使用奥沙利铂为基础的治疗可能是治疗PACC最有效的治疗方法。
综上所述,PACC总体预后较差,仍然是一个具有挑战性的疾病,国内外目前尚无大样本前瞻性的临床治疗及实验性研究资料,早期诊断较为困难,确诊主要依靠病理学结果,常见的突变基因有BRCA2、KRAS、RET和LKB1。为更进一步加深对PACC的认识,有待多中心、大样本的研究。
利益冲突所有作者均声明不存在利益冲突
