长链非编码RNA FBXL19-AS1靶向miR-339-3p对胰腺癌细胞增殖、迁移和侵袭的影响
2021-06-25董娜娜郭瑞娟付爱芹
董娜娜 郭瑞娟 付爱芹
1烟台市烟台山医院肿瘤内一科,烟台 264000;2烟台市烟台山医院东院肿瘤内科,烟台264000
长链非编码RNA(long noncoding RNA, lncRNA)和微小RNA(microRNA, miR)是两类小分子非编码RNA,两者通过相互作用参与肿瘤的发生和发展,可作为肿瘤靶向治疗的分子靶点[1-3]。F-box和富含亮氨酸的重复蛋白19反义RNA 1(FBXL19-AS1)属于lncRNA,lncRNA FBXL19-AS1在胃癌[4]、非小细胞肺癌[5]和乳腺癌[6]等肿瘤中表达升高,促进肿瘤发展进程。但lncRNA FBXL19-AS1对胰腺癌发生发展的影响未见报道。Starbase生物信息学软件预测显示,lncRNA FBXL19-AS1可能靶向结合miR-339-3p。研究表明,miR-339-3p在胃癌细胞中呈低表达,上调其表达可抑制胃癌细胞增殖并促进细胞凋亡[7];miR-339-3p在结直肠癌组织和细胞系中表达下调,过表达miR-339-3p可抑制结直肠癌肿瘤生长和转移[8]。但miR-339-3p对胰腺癌发生发展的影响也未见报道。本研究检测lncRNA FBXL19-AS1和miR-339-3p在胰腺癌组织和细胞中的表达水平,观察其对胰腺癌细胞增殖、迁移和侵袭能力及相关蛋白表达的影响,验证lncRNA FBXL19-AS1与miR-339-3p的靶向关系,以期阐明lncRNA FBXL19-AS1和miR-339-3p在胰腺癌发生发展中的作用,为胰腺癌治疗提供新的分子靶点。
资料与方法
一、胰腺癌组织、细胞株lncRNA FBXL19-AS1和miR-339-3p表达检测
收集2017年1月至2019至8月间烟台市烟台山医院手术切除且病理确诊的73例胰腺癌患者的癌组织及匹配的癌旁正常胰腺组织(距离手术切缘>3 cm)。TNM分期:Ⅰ期10例、Ⅱ期18例、Ⅲ期34例、Ⅳ期11例;低分化35例、中分化28例、高分化13例。患者术前均未接受放疗或化疗等辅助治疗。所有标本取下后立即置-196℃液氮中保存。
应用Trizol法抽提胰腺癌和癌旁组织总RNA,应用 RNA逆转录与扩增试剂盒(大连宝生物工程有限公司)逆转录成cDNA,按说明书操作。转录的cDNA行实时荧光定量PCR(RT-qPCR)反应。lncRNA FBXL19-AS1正向引物序列为5′-GGT-ACAACTACGGATATGA-3′,反向引物序列为5′-TACGTCTCGACCATTACGCA-3′;miR-339-3p正向引物序列为5′-CGACATACGACTACGAGATA-3′,反向引物序列为5′-CGATTTACGATACGCAAGACGA-3′;内参GAPDH正向引物序列为5′-CGACTC-AGCGACGAGTCGA-3′,反向引物序列为5′-CTA-CGATACGGGAACAACGTCCG-3′;内参U6正向引物序列为5′-CGCTACGACTCGCGCTCTTC-3′,反向引物序列为5′-CTCGCGGCCAAGAGCTAGCG-3′。引物由上海生工生物工程有限公司设计并合成。PCR反应条件:95℃ 5 min,95℃ 10 s、60℃ 30 s、72℃ 30 s,35个循环。通过PCR仪器自带软件获取扩增产物的Ct值,采用公示2-△△Ct计算lncRNA FBXL19-AS1和miR-339-3p相对表达量。每个样品设3个复管,取均值。
正常胰腺上皮细胞株hTERT-HPNE及胰腺癌细胞株Capan-1、SW1990和PaTu8988均购自武汉普诺赛生命科技有限公司。常规复苏、传代。取对数生长期细胞,采用上述相同方法检测lncRNA FBXL19-AS1和miR-339-3p的表达量。
二、胰腺癌Capan-1细胞分组及检测
1.Capan-1细胞分组:将Capan-1细胞分为NC组 (正常对照组)、si-NC组(转染无意义阴性序列)、si-FBXL19-AS1组(转染FBXL19-AS1小干扰RNA),miR-NC组(转染空质粒对照)、miR-339-3p组(转染miR-339-3p过表达慢病毒载体),si-FBXL19-AS1+anti-miR-339-3p NC组(共转染FBXL19-AS1 siRNA和miR-339-3p抑制剂阴性对照序列)、si-FBXL19-AS1+anti-miR-339-3p组(共转染FBXL19-AS1siRNA和miR-339-3p抑制剂)。所有siRNA、anti-miR构建及慢病毒包装均由上海生工生物工程有限公司完成。以病毒∶细胞为100∶1的比例感染细胞24 h,更新培养液,以含1 g/ml嘌呤霉素的DMEM培养液处理24 h以杀死未被感染的细胞,取存活并感染的细胞进行培养及传代。
2.Capan-1细胞增殖活性检测:取NC组、si-NC组、si-FBXL19-AS1组、miR-NC组、miR-339-3p组、si-FBXL19-AS1+anti-miR-339-3p NC组、si-FBXL19-AS1+anti-miR-339-3p组Capan-1细胞,以2.5×104个/孔接种于96孔板,分别培养0、12、48、72 h,到时间点加入10 μl CCK-8(日本株式会社)继续孵育2 h,上酶标仪测每孔在波长450 nm处的吸光值(A450值)。
3.Capan-1细胞迁移和侵袭能力检测:取上述各组对数生长期Capan-1细胞,调整为细胞密度5.0×104个/ml的细胞悬液。将Transwell小室(美国Corning公司)或预先在隔膜上室面铺设Matrigel基质胶并自然晾干后的Transwell小室置于24孔板。上室加100 μl细胞悬液,下室加500 μl培养液,培养24 h后弃培养液,轻轻擦去隔膜上室面未穿膜细胞,经4%多聚甲醛固定、结晶紫染色,置显微镜下以200倍随机取5个视野,计算穿膜细胞数,取均值。
4.Capan-1细胞cyclinD1、MMP2和MMP9蛋白表达检测:取上述各组对数生长期Capan-1细胞,以5.0×105个/孔接种于6孔板,培养24 h后用RIPA试剂提取细胞总蛋白。经BCA法定量蛋白后常规行蛋白质免疫印迹法检测cyclinD1、MMP2、MMP9蛋白表达,以β-actin为内参。一抗cyclinD1工作浓度1∶500,MMP2、MMP9和β-actin工作浓度均1∶1 000,辣根过氧化酶标记的二抗工作浓度1∶5 000。最后ECL发光,X片曝光、显影、定影。用Image J软件分析,以目的条带与内参条带的灰度值比表示蛋白相对表达量。
三、lncRNA FBXL19-AS1和miR-339-3p的靶向关系验证
从Starbase数据库(http://starbase.sysu.edu.cn)搜索lncRNA FBXL19-AS1d的潜在靶向基因,通过双荧光素酶报告基因法验证lncRNA FBXL19-AS1和miR-339-3p的靶向关系。取对数生长期Capan-1细胞,以1.0×105个/孔接种于6孔板,采用LipofectamineTM2000脂质体法,将野生型(wild type,WT)lncRNA FBXL19-AS1和miR-339-3p mimics或miR-NC,突变型(mutant type,MT)lncRNA FBXL19-AS1和miR-339-3p mimics或miR-NC共转染至Capan-1细胞,转染时间为6 h,更换培养液,继续培养24 h,收集细胞并裂解,应用双荧光素酶活性检测试剂盒检测荧光素酶活性,按试剂盒说明书操作。实验重复3次,取均值。
四、统计学处理
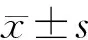
结 果
一、胰腺癌组织和各细胞株lncRNA FBXL19-AS1 和miR-339-3p表达量
胰腺癌组织及其癌旁正常胰腺组织lncRNA FBXL19-AS1表达量分别为2.96±0.21和1.00±0.13,癌组织显著高于癌旁正常胰腺组织,差异有统计学意义(t=67.804,P<0.05)。胰腺癌组织及癌旁正常胰腺组织miR-339-3p表达量分别为0.37±0.05和1.00±0.11,癌组织显著低于癌旁正常胰腺组织,差异有统计学意义(t=44.548,P<0.05)。
Capan-1、SW1990及PaTu8988细胞lncRNA FBXL19-AS1表达量分别为2.43±0.18、1.97±0.13和1.73±0.14,均显著高于hTERT-HPNE细胞的1.00±0.07,miR-339-3p表达量分别为0.42±0.03、0.54±0.03和0.57±0.04,均显著低于hTERT-HPNE细胞的1.00±0.05(F值分别为173.898、391.881,P值均<0.05)。其中以Capan-1细胞的lncRNA FBXL 19-AS1表达量最高, miR-339-3p表达量最低,故选择Capan-1细胞株进行后续实验。
二、敲减Capan-1细胞lncRNA FBXL19-AS1表达可抑制细胞增殖、迁移、侵袭及相关蛋白表达
si-FBXL19-AS1组lncRNA FBXL19-AS1表达水平显著低于si-NC组(0.42±0.02比1.04±0.08,t=22.556,P=0.000),表明抑制lncRNA FBXL19-AS1表达的Capan-1细胞构建成功。
与NC组或si-NC组比较,si-FBXL19-AS1组细胞A450值、迁移细胞数、穿膜细胞数显著下降,cyclinD1、MMP2和MMP9蛋白表达量显著降低,差异均有统计学意义(P值均<0.05),而NC组与si-NC组各检测指标差异均无统计学意义(表1、图1)。提示抑制lncRNA FBXL19-AS1表达可以抑制Capan-1细胞增殖、迁移、侵袭及相关蛋白表达。

表1 正常对照组、si-NC组、si-FBXL19-AS1组Capan-1细胞增殖、迁移、侵袭和相关蛋白表达的比较

图1 正常对照组(1)、si-NC组(2)、si-FBXL19-AS1组(3)Capan-1细胞cyclinD1、MMP2、MMP9蛋白表达
三、miR-339-3p过表达抑制Capan-1细胞增殖、迁移、侵袭及相关蛋白的表达
miR-339-3p组miR-339-3p表达水平显著高于miR-NC组(1.73±0.14比1.00±0.07,t=13.991,P=0.000),表明miR-339-3p过表达的Capan-1细胞株构建成功。与miR-NC组比较,miR-339-3p组Capan-1细胞A450值、迁移细胞数、穿膜细胞数显著下降,cyclinD1、MMP2和MMP9蛋白表达显著降低,差异均有统计学意义(P值均<0.05,图2、表2)。

图2 miR-NC组、miR-339-3p组Capan-1细胞cyclinD1、MMP2、MMP9蛋白表达

表2 miR-NC组与miR-339-3p组Capan-1细胞增殖、迁移、侵袭及相关蛋白表达的比较
四、抑制miR-339-3p可逆转敲减lncRNA FBXL19-AS1对Capan-1细胞增殖、迁移和侵袭的影响
si-FBXL19-AS1+anti-miR-339-3p组miR-339-3p表达水平显著低于si-FBXL19-AS1+anti-miR-NC组(0.47±0.03比1.00±0.07),表明抑制miR-339-3p 表达的si-FBXL19-AS1细胞株构建成功。
与si-FBXL19-AS1+anti-miR-NC组比较,si-FBXL19-AS1+anti-miR-339-3p组细胞A450值、迁移细胞数、穿膜细胞数显著上升,cyclinD1、MMP2和MMP9蛋白表达量显著升高,差异均有统计学意义(P值均<0.05,表3、图3)。提示抑制miR-339-3p可逆转敲减lncRNA FBXL19-AS1对Capan-1细胞增殖、迁移和侵袭的影响。

表3 si-lncRNA FBXL19-AS1+anti-miR-NC组与si-lncRNA FBXL19-AS1+anti-miR-339-3p组Capan-1细胞增殖、迁移、侵袭及相关蛋白表达的比较

图3 si-FBXL19-AS1+anti-miR-NC组(1)、si-FBXL19-AS1+anti-miR-339-3p组(2)Capan-1细胞cyclinD1、MMP2、MMP9蛋白表达
五、lncRNA FBXL19-AS1靶向调控miR-339-3p
通过Starbase生物信息学软件检索到lncRNA FBXL19-AS1与miR-339-3p的核苷酸序列存在连续结合位点(图4)。经双荧光素酶报告基因实验验证结果显示,共转染WT-lncRNA FBXL19-AS1和miR-339-3p mimics组Capan-1细胞的荧光素酶活性显著低于共转染WT-lncRNA FBXL19-AS1和miR-NC组(0.47±0.04比1.00±0.10),差异有统计学意义(t=14.763,P<0.05),而共转染MT-lncRNA FBXL19-AS1和miR-339-3p mimics组与共转染MT-lncRNA FBXL19-AS1和miR-NC组Capan-1细胞的荧光素酶活性分别为1.03±0.11和1.01±0.09,两组差异无统计学意义(t=0.422,P=0.679)。提示野生组存在lncRNA FBXL19-AS1靶向调控miR-339-3p,而突变组沉默了lncRNA FBXL19-AS1表达,故不存在lncRNA FBXL19-AS1靶向调控miR-339-3p。

图4 lncRNA FBXL19-AS1与miR-339-3p的结合位点
讨 论
LncRNA是真核生物中广泛存在的参与调控细胞增殖、分化和凋亡的小分子非编码RNA,在肿瘤的发生、发展中起重要作用。研究表明,CASC19[ 9]、LINP1[10]和NT5E[11]等多种lncRNA在胰腺癌中高表达,促进胰腺癌的发展进程;而STXBP5-AS1[12]和MTSS1- AS[13]等lncRNA在胰腺癌中低表达,在胰腺癌的发展过程中起抑癌基因作用。lncRNA FBXL19-AS1是近年来新发现的一种lncRNA,参与多种肿瘤的发展进程。研究显示,lncRNA FBXL19-AS1在乳腺癌细胞呈高表达,沉默其表达可削弱乳腺癌细胞增殖能力并加剧细胞凋亡,其作用机制与靶向调控miR-876-5p/FOXM1有关[14];肺腺癌组织中lncRNA FBXL19-AS1高表达,且与肺腺癌患者不良预后密切相关,敲减其表达可靶向上调miR-203-3p表达,阻滞肺腺癌细胞的周期进程,并抑制肺腺癌细胞增殖、迁移和侵袭,可作为肺腺癌预后的生物标志物及治疗靶标[15];lncRNA FBXL19-AS1在结直肠癌高表达,敲减其表达可靶向结合并上调miR-203表达,减弱体外结直肠癌细胞增殖、迁移和侵袭,抑制体内肿瘤生长和转移[16]。但目前未见lncRNA FBXL19-AS1影响胰腺癌发生发展的相关报道。
本研究结果显示,胰腺癌组织及Capan-1细胞lncRNA FBXL19-AS1表达升高,提示其可能促进胰腺癌的发展进程;敲减lncRNA FBXL19-AS1可显著降低胰腺癌细胞的增殖、迁移和侵袭能力,提示敲减lncRNA FBXL19-AS1可抑制胰腺癌细胞的恶性表型,延缓胰腺癌发展进程,可作为胰腺癌治疗的潜在的分子靶点。肿瘤细胞增殖、迁移和侵袭受多种基因分子的调控,其中cyclinD1是细胞周期调控分子,可促进细胞周期由G1期向S期转变,加快细胞周期进程,促进细胞增殖[17];MMP2和MMP9是基质金属蛋白酶家族成员,参与降解细胞外基质,促进肿瘤细胞迁移和侵袭[18]。本研究结果显示,敲减lncRNA FBXL19-AS1可抑制胰腺癌细胞cyclinD1、MMP2和MMP9的蛋白表达,提示其可能通过调控cyclinD1、MMP2和MMP9的表达来影响胰腺癌细胞增殖、迁移和侵袭。
研究报道,miR-339-3p在胶质母细胞瘤组织和细胞中表达下调,其可靶向抑制IP6K2的表达,降低胶质母细胞瘤细胞增殖,并促进细胞凋亡[19];miR-339-3p在黑色素瘤细胞系中表达降低,过表达miR-339-3p可靶向抑制MCL1,减弱黑色素瘤细胞的侵袭性,可作为抑制黑色素瘤细胞侵袭的分子靶点[20]。本研究结果显示,胰腺癌组织及细胞系中miR-339-3p的表达明显降低,过表达miR-339-3p对胰腺癌细胞增殖、迁移和侵袭起抑制作用,提示miR-339-3p低表达是胰腺癌发生发展的促进因素,抑制miR-339-3p可逆转敲减lncRNA FBXL19-AS1对胰腺癌细胞增殖、迁移和侵袭的抑制作用,提示lncRNA FBXL19-AS1可能通过靶向负调控miR- 339- 3p来促进胰腺癌细胞的恶性表型,进而促进胰腺癌发展进程。通过Starbase生物信息学软件和双荧光素酶分析证实lncRNA FBXL19-AS1与miR-339-3p的核苷酸序列存在连续结合位点,lncRNA FBXL19-AS1靶向调控miR-339-3p,lncRNA FBXL19-AS1/miR-339-3p轴可能为胰腺癌的靶向治疗提供新的分子靶点。
利益冲突所有作者均声明不存在利益冲突
