肉桂醛缩氨基脲对黄嘌呤氧化酶的抑制作用研究
2021-06-24余雄英廖永翠左爱仁
余雄英,廖永翠,潘 惠,左爱仁
(江西中医药大学 中医学院/生命科学学院,江西 南昌330006)
黄嘌呤氧化酶(xanthine oxidase,XOD)是体内尿酸生成的关键酶,它能催化次黄嘌呤和黄嘌呤转化为尿酸,尿酸过多可导致痛风。全球痛风发病率与日俱增,并呈年轻化趋势,成为第二大威胁人类生命和健康的代谢性疾病[1],因此研发防治痛风、高尿酸血症的药物成为目前医药界的一个研究热点。XOD抑制剂可减少体内尿酸生成,预防痛风病。肉桂醛又称桂皮醛,是斯里兰卡肉桂油、桂皮油、藿香油、风信子油和玫瑰油等精油的重要活性成分。肉桂醛具有杀菌消毒、抗溃疡、抗病毒、抗癌[2]等功能。有研究报道了肉桂挥发油和肉桂醛的体内降尿酸和血清XOD抑制实验[3-4],结果显示肉桂挥发油和肉桂醛具有较好的体内降尿酸活性,肉桂醛体外实验有XOD抑制活性,但活性比阳性药别嘌醇稍弱。另外,Maria等[5]研究表明缩氨基脲类席夫碱类物质有较强的XOD抑制作用。基于肉桂醛与席夫碱均能抑制XOD,本研究采取基团拼合原理,合成肉桂醛缩氨基脲(cinnamic aldehyde semicarbazone)及缩氨基硫脲类席夫碱,并测定其对黄嘌呤氧化酶的抑制作用,探讨其构效关系,旨在筛选出高效低毒的黄嘌呤氧化酶的抑制剂。
1 材料与方法
1.1 实验材料
氧嗪酸钾盐、尿酸、黄嘌呤、别嘌呤醇、黄嘌呤氧化酶:均购自美国Sigma-Aldrich公司;肉桂醛、4-甲基氨基硫脲、4-苯基氨基硫脲、氨基脲、氨基硫脲、Na2HPO4·12 H2O、NaH2PO4·2 H2O、氢氧化钠、EDTA、DMSO:均购自上海国药厂,分析纯;尿酸测定试剂盒:购自南京建成生物工程研究所,生产批号20180530;XOD测定试剂盒:购自南京建成生物工程研究所,生产批号20180720。
1.2 实验仪器
UV-2450紫外分光光度计:购自日本岛津公司;集热式恒温加热磁力搅拌器、精密电子天平BT25S:购自美国热电尼高力公司;旋转蒸发器RE52CS-1:购自上海亚荣生化仪器厂;循环水式多用真空泵SHB-III:购自郑州长城科工贸有限公司;红外光谱仪FTIR Nicolet 5700、高分辨率四级杆-飞行时间质谱仪Agilent 6538、核磁共振仪AV-600:均购自德国Bruker公司。
1.3 实验动物
健康雄性昆明种小鼠40只,体质量18~22 g:由江西中医药大学实验动物科技中心提供,实验动物生产许可证号:SCXK(赣)2018-003。实验前饲养一周,以适应环境。饲养条件:室温(25±2)℃,相对湿度60%~70%。
1.4 实验方法
1.4.1 肉桂醛衍生物的合成 将10 mmol氨基脲或氨基硫脲类物质加入100 mL三颈烧瓶中,准确加入15 mL无水乙醇,加热磁力搅拌器中恒温70℃回流10 min溶解,然后逐滴滴加10 mmol的肉桂醛,溶液逐渐变为黄绿色,加4滴冰乙酸,回流4 h后发现有固体析出,冷却至室温后过滤,重结晶,即可得到产物。其中化合物a是肉桂醛缩氨基脲,cinnamic aldehyde semicarbazone,CAS;化合物b是肉桂醛缩氨基硫脲,cinnamaldehyde thiosemi-carbazide,CT;化合物c是肉桂醛缩甲基氨基硫脲,cinnamaldehyde shrinkage methyl thiosemicarbazide,CSMT;化合物d是肉桂醛缩4-苯基氨基硫脲,cinnamaldehyde shrinkage methyl thiosemicarbazide,CSMT(图1)。
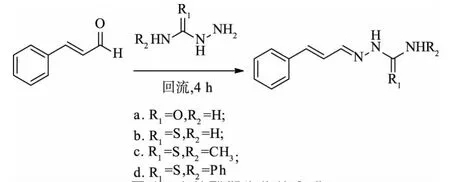
图1 肉桂醛衍生物的合成Fig.1 Synthesis of cinnamylaldehyde derivatives
1.4.2 合成化合物的结构表征 通过UV、IR、1HNMR、ESI-MS进行结构表征。
UV光谱:将肉桂醛衍生物分别溶于无水乙醇,配成浓度为1×10-5mol/L的溶液,测定紫外-可见吸收光谱,测定波长为200~600 nm。
IR光谱:将肉桂醛衍生物1 mg和100 mg KBr充分研磨后压片,在400~4 000 cm-1范围内,扫描32次,分辨率为4 cm-1,测定肉桂醛衍生物的红外吸收光谱。
1H-NMR:样品10 mg加入0.5 mL氘代溶剂溶解。25℃条件下,配备5 mm PABBO探针,在Bruker DRX 400 MHz波谱仪上进行测定,使用MestReNova软件处理数据。参数选择后采样、傅立叶变换、调相位、校正零点、积分、定最大最小值、打印图谱等步骤进行氢谱的测量。
ESI-MS质谱条件:ESI电喷雾离子源,负离子检测,离子源温度120℃。雾化器压力206 850 Pa,干燥气氮气流量7L/min,温度350℃。毛细管电压2.5kV,锥孔电压20 V,锥孔气流量50 L/h,检测电压1 600 V。用Mass Lynx软件处理数据。
1.4.3 化合物对XOD酶抑制机理
1)酶活性测定 在黄嘌呤氧化酶的作用下,黄嘌呤被氧化生成尿酸。实验方法参照Cos等[6]的方法并略有修改。各化合物分别用DMSO溶解,制备样品液。黄嘌呤氧化酶水溶液(0.2 U/mL)用超纯水配制,浓度为0.15 mmol/L的黄嘌呤底物溶液用PBS缓冲溶液配制(pH 7.5)。总反应体系3 mL,先加入PBS缓冲溶液0.85 mL,0.15 mmol/L的黄嘌呤底物溶液2 mL,再加入0.05 mL不同浓度的样品溶液,混匀1分钟。然后加入0.1 mL黄嘌呤氧化酶水溶液,立即摇匀,25℃水浴,于290 nm处测定酶促反应曲线,每隔10 s测一次吸光值,持续200 s。黄嘌呤氧化酶的活性相当于曲线线性期部分的斜率。以样品浓度作横坐标,相对酶活作纵坐标,作图得到黄嘌呤氧化酶活性抑制曲线。重复测定3次,抑制率为:
抑制率(%)=((S0-S1)/S0)×100%
式中:S0是无样品组别的斜率,S1是添加样品组别的斜率。
2)肉桂醛缩氨基脲对XOD的抑制类型 以黄嘌呤为底物,研究肉桂醛缩氨基脲抑制黄嘌呤氧化酶活性的机理,即可逆抑制或者不可逆抑制。在测活体系中,固定底物黄嘌呤浓度,依次加入肉桂醛缩氨基脲浓度0、50、75、100μmol/L,改变XOD酶的质量浓度,测定不同浓度的抑制剂肉桂醛缩氨基脲对XOD催化氧化黄嘌呤能力的影响。以酶促反应的速度对酶质量浓度作图,若得到一系列通过原点的直线,则为可逆抑制;若得到一组平行线,则为不可逆抑制。
3)肉桂醛缩氨基脲对XOD的抑制常数 参照上述酶反应体系,以黄嘌呤为底物,研究肉桂醛缩氨基脲对黄嘌呤氧化酶活性的抑制常数。改变加入黄嘌呤的浓度,固定酶的浓度,测定不同浓度肉桂醛缩氨基脲(0、30、40、60μmol/L)抑制黄嘌呤氧化酶活性的效果。抑制类型由Lineweaver-Burk双倒数作图法来判断。纵坐标是直线的斜率或Y轴的截距,横坐标是各化合物浓度,作图,可计算相应的抑制常数(KI或KIS)[7-8]。
1.4.4 肉桂醛缩氨基脲对小鼠血尿酸质量浓度、血清XOD活性和肝脏XOD活性的影响 参照文献方法[9-10],用氧嗪酸钾和尿酸腹腔注射小鼠,连续2天,造成小鼠高尿酸血症模型。雄性昆明种小鼠适应性饲养一周后,随机分成正常对照组、高尿酸模型组、别嘌呤醇组、肉桂醛缩氨基脲组、肉桂醛组共5组,每组10只。正常对照组和高尿酸模型组,每天按20 mL/kg剂量灌胃生理盐水,持续6天。别嘌呤醇组每天按10 mg/kg剂量灌胃1次,持续6天。肉桂醛组、肉桂醛缩氨基脲组小鼠每天按0.1 g/kg剂量灌胃6天。从给药第5天开始,除正常对照组外,其他各组每天灌胃前1 h均要腹腔注射0.3 g/kg氧嗪酸钾和0.25 g/kg尿酸,每天1次,连续2天进行造模。在第6天灌胃1 h后,小鼠进行断头采血,血样分别置于1.5 mL离心管中,在4℃冰箱中凝固2 h,在4℃下3 000 r/min离心5 min。每份血清进行血尿酸和血清XOD活性测定。采血后,取出肝脏,匀浆处理,离心取上清,测XOD活性。
用尿酸测定试剂盒测定血尿酸质量浓度,用试剂盒法测定小鼠血清XOD和肝脏XOD活性。
1.5 统计学处理
用SPSS19.0软件进行统计分析,计量资料以平均值±标准偏差表示,组间比较用t检验。
2 结果与分析
2.1 化合物结构表征
化合物a(肉桂醛缩氨基脲,cinnamic aldehyde semicarbazone,CAS):无色针晶(CH3OH);UV(MeOH)λmax308,306 nm;IR(KBr)νmax3 282,1 644,1 604 cm-1;1H-NMR(400 MHz,DMSO-d6):δ10.174(s,1H,NH)7.653(s,1H,CH=N),7.49(d,2H,Ph—H),7.345(t,2H,Ph—H),7.265(t,1H,Ph—H),6.852(d,2H,CH=CH),6.26(s,2H,NH2);ESI-MS,m/z Mr=189.23,[M+H]+(C10H11N3O)。其IR、1H-NMR、ESI-MS数据与文献[11]报道一致。
化合物b(肉桂醛缩氨基硫脲,cinnamaldehyde thiosemicarbazide,CT):浅黄色菊花晶(CH3OH);UV(MeOH)λmax352,348 nm;IR(KBr)νmax3 262,1 592 cm-1;1H-NMR(400 MHz,DMSO-d6):δ11.350(s,1H,NH),8.123(s,1H,CH=N),7.859(d,1H,Ph—H),7.539(d,2H,NH2),7.541(d,1H,Ph—CH=),7.341(t,3H,Ph—H),6.998(d,1H,Ph—H),6.838(q,1H,=CH—);ESI-MS,m/z Mr=205.3,[M+H]+(C10H11N3S)。其IR、1H-NMR、ESI-MS数据与文献[12]报道一致。
化合物c(肉桂醛缩甲基氨基硫脲,cinnamaldehyde shrinkage methyl thiosemicarbazide,CSMT):黄色粉末(CH3OH);UV(MeOH)λmax305,358 nm;IR(KBr)νmax3 362,1 552 cm-1;1H-NMR(400 MHz,DMSO-d6):δ11.401(s,1H,NH),8.24(s,1H,CH=N),7.87(d,1H,CH=),7.521(d,2H,Ph—H),7.36(t,2H,Ph—H),7.294(t,1H,Ph—H),6.988(d,1H,CH=),6.833(m,1H,NH),2.942(d,3H,CH3);ESI-MS,m/z Mr=219.32,[M+H]+(C11H13N3S)。
化合物d(肉桂醛缩4-苯基氨基硫脲,cinnamaldehyde shrinkage phenyl thiosemicarbazide,CSPT):无色针晶(CH3OH);UV(MeOH)λmax305,350 nm;IR(KBr)νmax3 313,1 594 cm-1;1HNMR(400 MHz,DMSO-d6):δ11.79(s,1H,NH),9.89(s,1H,NH—Ph),7.98(s,1H,CH=N),6.96(dd,1H,=CH—),7.05(d,1H,Ph-CH=),7.15(d,1H,Ph—H),7.35(m,5H,Ph—H),7.58(dd,4H,Ph—H);ESI-MS,m/z Mr=281.39,[M+H]+(C16H15N3S)。其IR、1H-NMR、ESI-MS数据与文献[13]报道一致。
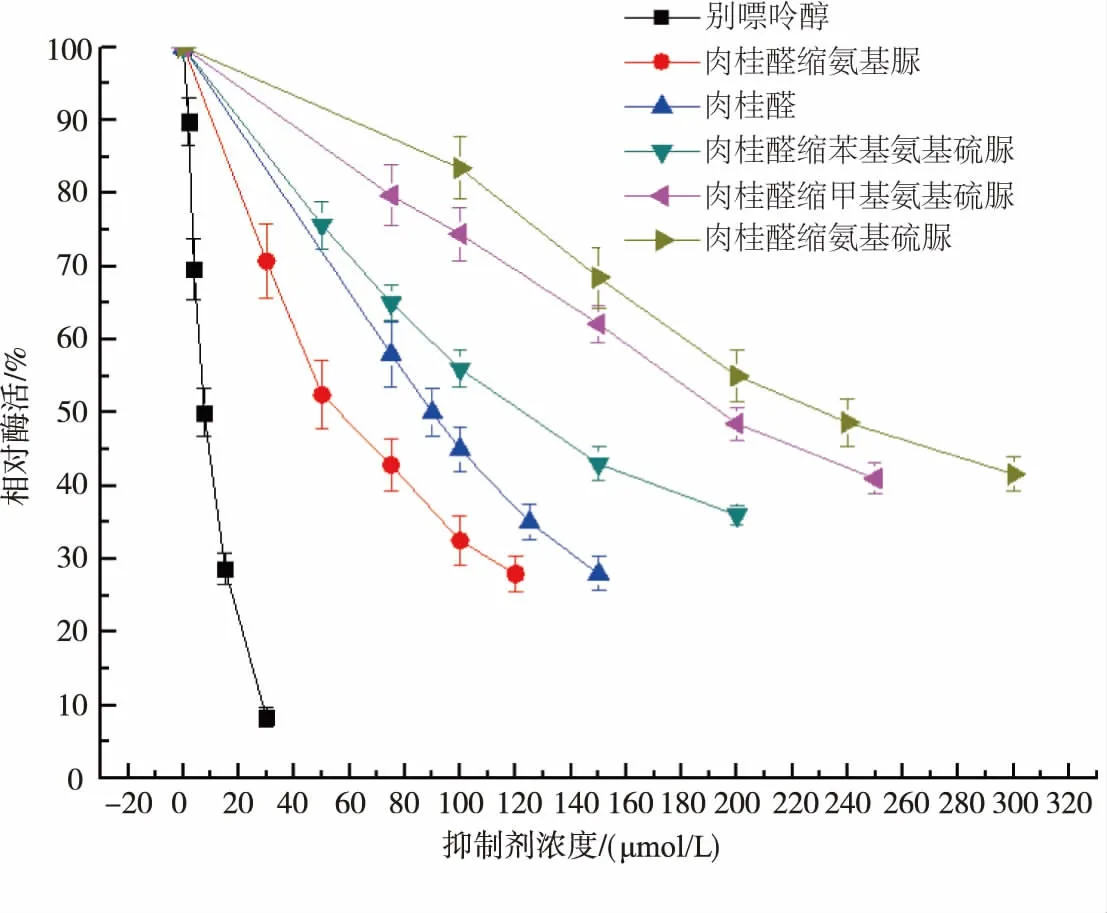
图2 肉桂醛及其衍生物对黄嘌呤氧化酶活性的抑制作用Fig.2 Inhibitory effect of cinnamylaldehyde and its derivatives on the activity of xanthine oxidase
2.2 化合物对XOD抑制活性
肉桂醛及其席夫碱衍生物对XOD的抑制率见图2。其中各折线依次代表抑制剂别嘌呤醇、肉桂醛缩氨基脲、肉桂醛、肉桂醛缩苯基氨基硫脲、肉桂醛缩甲基氨基硫脲、肉桂醛缩氨基硫脲。由图2可知,同一种抑制剂,浓度越大,酶活性越低。别嘌呤醇、肉桂醛缩氨基脲、肉桂醛、肉桂醛缩苯基氨基硫脲、肉桂醛缩甲基氨基硫脲、肉桂醛缩氨基硫脲抑制XOD的IC50值分别是(7.05±0.14)、(55.48±0.54)、(90.93±0.72)、(122.48±0.65)、(201.29±0.88)、(241.57±1.32)μmol/L(n=3)。各化合物活性顺序是别嘌呤醇>肉桂醛缩氨基脲>肉桂醛>肉桂醛缩苯基氨基硫脲>肉桂醛缩甲基氨基硫脲>肉桂醛缩氨基硫脲。
肉桂醛缩氨基脲对XOD抑制活性比肉桂醛强,且活性接近阳性药别嘌醇。肉桂醛缩氨基脲抑制XOD活性比肉桂醛缩氨基硫脲类化合物强,可能与氨基脲上的羰基能与XOD酶上的氨基酸残基形成氢键,而硫脲不能形成氢键有关[5]。抑制XOD活性,苯基取代硫脲>甲基取代硫脲>硫脲。这可能与疏水性有关,苯基的疏水性最大,其次是甲基,然后是无取代基。即疏水性基团越大,抑制活性越好。由于肉桂醛缩氨基脲抑制XOD活性最强,以下测定抑制机理和抑制类型就只研究肉桂醛缩氨基脲。
2.3 肉桂醛缩氨基脲对XOD抑制类型
在测活体系中,固定底物黄嘌呤浓度,改变XOD酶的质量浓度,测定不同浓度的抑制剂肉桂醛缩氨基脲(0、50、75、100μmol/L)对XOD酶活性的影响。由图3可知,以酶促反应的速度对酶质量浓度作图,为一组通过原点的直线,由此判断肉桂醛缩氨基脲对XOD抑制机理为可逆抑制。
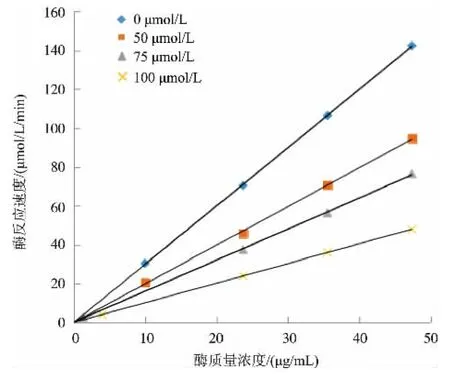
图3 肉桂醛缩氨基脲对黄嘌呤氧化酶的可逆性抑制Fig.3 Reversible inhibitory mechanism of cinnamic aldehyde semicarbazone on xanthine oxidase
2.4 肉桂醛缩氨基脲对XOD抑制常数
以黄嘌呤为底物,研究了肉桂醛缩氨基脲对黄嘌呤氧化酶活性的抑制常数。改变加入黄嘌呤的浓度,加入0.1 mL酶活为0.2 U/mL的黄嘌呤氧化酶,加入肉桂醛缩氨基脲使体系内终浓度分别为0、30、40、60μmol/L,测定不同浓度肉桂醛缩氨基脲对酶活性的影响。抑制类型由Lineweaver-Burk双倒数作图法来判断。纵坐标是反应速率的倒数,横坐标是底物浓度的倒数,作图,试验结果见图4(a),显示一组直线相交于第二象限,推测出肉桂醛缩氨基脲不仅能够与酶底物复合物结合,还能与游离酶结合,说明肉桂醛缩氨基脲抑制黄嘌呤氧化酶活性的类型为混合型抑制作用。纵坐标是直线斜率,横坐标是肉桂醛缩氨基脲浓度,作图,可以计算出肉桂醛缩氨基脲的抑制常数KI,即抑制剂与酶的亲和能力(见图4(b))。纵坐标是Y轴截距,横坐标是肉桂醛缩氨基脲浓度,作图,可以计算出肉桂醛缩氨基脲的抑制常数KIS,即抑制剂对酶底物复合物的亲和能力(见图4(c))。试验结果显示,肉桂醛缩氨基脲抑制黄嘌呤氧化酶活性的类型为混合型可逆抑制,抑制常数KI为27.25μmol/L,KIS为50.30μmol/L。
2.5 肉桂醛缩氨基脲对小鼠血尿酸质量浓度、血清XOD和肝脏XOD活性的影响
由图5可知,模型组与正常对照组相比,造模后小鼠的血尿酸质量浓度显著升高(P<0.05,n=10),表明造模成功。与模型组小鼠相比,肉桂醛缩氨基脲组小鼠的血尿酸质量浓度降低,差异显著(P<0.05,n=10)。活性顺序是:别嘌呤醇>肉桂醛缩氨基脲>肉桂醛。
由图6可知,模型组与正常对照组相比,造模后小鼠血清XOD活性显著升高(P<0.05,n=10),表明造模成功。与模型组小鼠相比,肉桂醛缩氨基脲组小鼠血清XOD活性降低,差异显著(P<0.05,n=10)。活性顺序是:别嘌呤醇>肉桂醛缩氨基脲>肉桂醛。
由图7可知,模型组与正常对照组相比,造模后小鼠肝脏的XOD活性显著升高(P<0.05,n=10),表明造模成功。与模型组小鼠相比,肉桂醛缩氨基脲组小鼠的肝脏的XOD活性降低,差异显著(P<0.05,n=10)。活性顺序是:别嘌呤醇>肉桂醛缩氨基脲>肉桂醛。
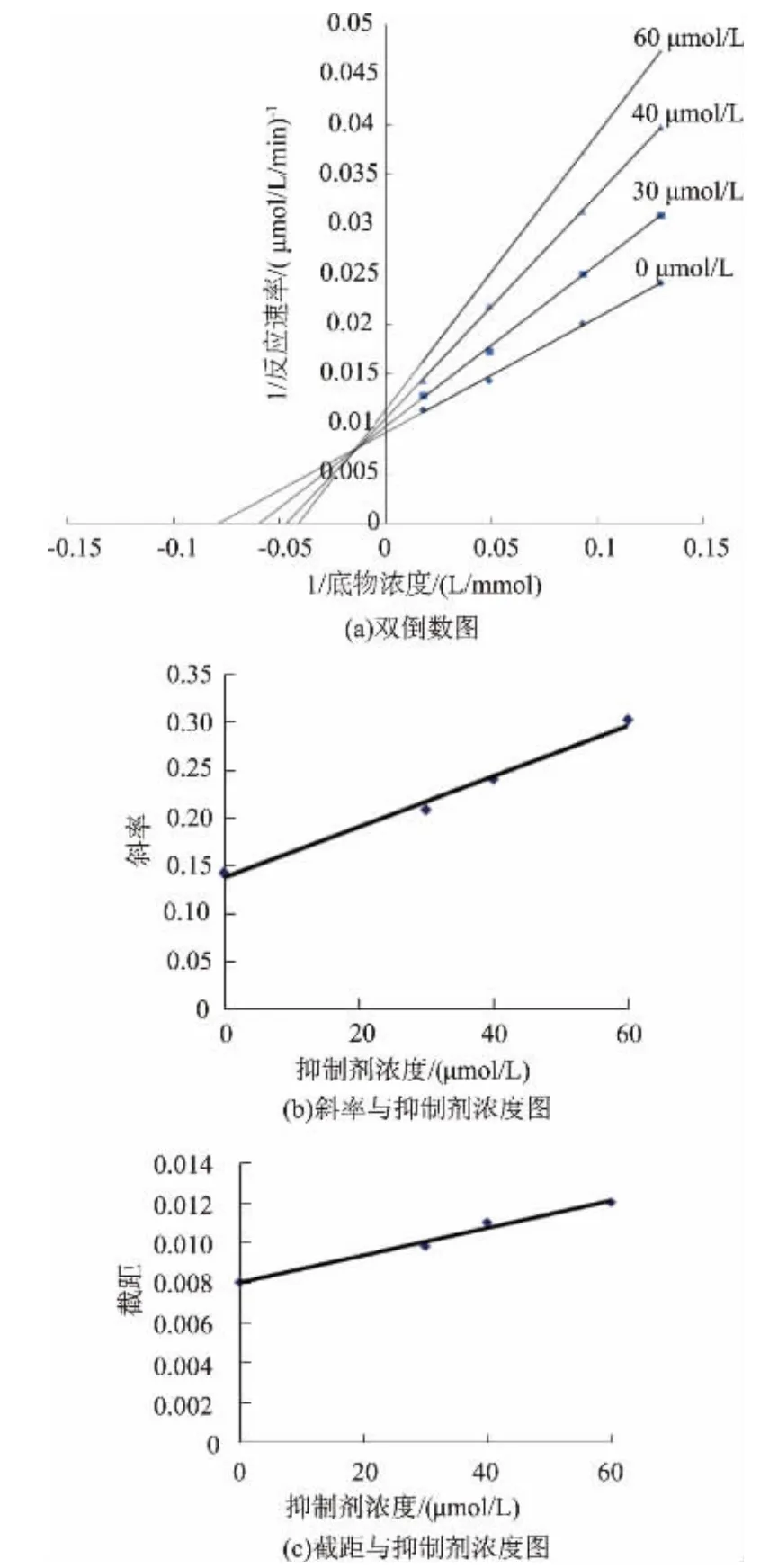
图4 肉桂醛缩氨基脲对黄嘌呤氧化酶抑制常数的测定Fig.4 Determination of the inhibition constant of cinnamic aldehyde semicarbazone on xanthine oxidase
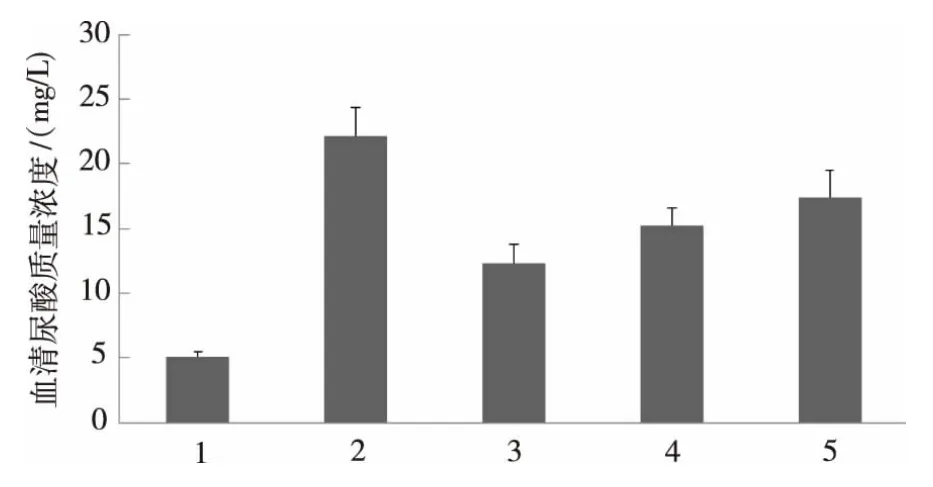
图5 肉桂醛缩氨基脲对小鼠血清尿酸质量浓度的影响Fig.5 Effect of cinnamic aldehyde semicarbazone on the concentration of serum uric acid in mice
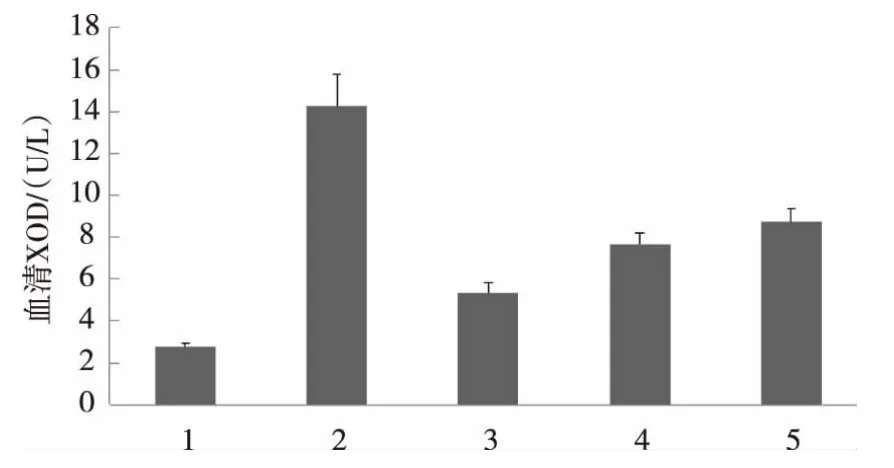
图6 肉桂醛缩氨基脲对小鼠血清黄嘌呤氧化酶活性的影响Fig.6 Effect of cinnamic aldehyde semicarbazone on the activity of serum xanthine oxidase in mice

图7 肉桂醛缩氨基脲对小鼠肝脏黄嘌呤氧化酶活性的影响Fig.7 Effect of cinnamic aldehyde semicarbazone on the activity of liver xanthine oxidase in mice
3 结 语
作者研究了肉桂醛缩氨基脲对黄嘌呤氧化酶的抑制作用。合成、表征了肉桂醛缩氨基脲,以黄嘌呤为底物,测定了肉桂醛缩氨基脲对黄嘌呤氧化酶活性的IC50、抑制类型和抑制常数。研究了肉桂醛缩氨基脲对小鼠血尿酸质量浓度、血清XOD活性和肝脏XOD活性的影响。肉桂醛缩氨基脲对黄嘌呤氧化酶活性抑制效果显著,IC50为55.48μmol/L,是混合型可逆抑制,抑制常数KI为27.25μmol/L,KIS为50.30 μmol/L。与模型组相比,肉桂醛缩氨基脲能显著降低小鼠血尿酸质量浓度、血清XOD活性和肝脏XOD活性,差异显著(P<0.05,n=10)。活性顺序:别嘌呤醇>肉桂醛缩氨基脲>肉桂醛。总之,肉桂醛缩氨基脲对黄嘌呤氧化酶活性抑制效果显著,能显著降低小鼠血尿酸质量浓度、血清XOD活性和肝脏XOD活性,是降低尿酸、防治痛风的候选药物。
