天然蓝色花色苷-亚铁螯合物的制备及稳定性研究
2021-06-24王成涛聂元茜
潘 飞,赵 磊*,周 娜,郝 帅,王成涛,聂元茜
(1.北京工商大学 食品营养与人类健康北京高精尖创新中心,北京100048;2.北京工商大学 北京市食品添加剂工程技术研究中心,北京100048)
当前,食品着色剂广泛应用于食品、保健品、化妆品等领域,由于其能够赋予产品独特的色彩而广受消费者喜爱。食品着色剂根据来源可分为人工合成着色剂和天然着色剂[1]。人工合成着色剂如胭脂红、柠檬黄、亮蓝等常作为染料应用于食品工业,然而一些合成着色剂会对人体健康产生有害影响[2-3]。研究表明,偶氮类染料与儿童的注意缺陷多动障碍(ADHD)有密切关系[4],欧洲委员会要求这些着色剂应用于食品和饮料中时必须加标签,我国也明确禁止在供3岁以下儿童食用的食物中使用这些着色剂[5-6]。随着人们健康意识提高,比起添加人工合成着色剂的食品,消费者更倾向于选择添加天然着色剂的食品,采用天然着色剂替代人工合成着色剂也是食品行业的一个重要发展方向。天然着色剂中,红色素和黄色素资源丰富,如红米红、甜菜红、辣椒红、红曲红、姜黄、栀子黄和胡萝卜素等[7]。相比之下,天然食用蓝色素资源稀缺,仅有栀子蓝色素、藻蓝蛋白和靛蓝3种[3],因此积极开展天然蓝色素的研究开发工作,具有广阔的市场前景。
花色苷是一种天然着色剂,安全、无毒、来源丰富,并有多项保健功能,如清除体内自由基、抗炎、调节血脂等[8-10],常作为天然着色剂和功能因子在食品中添加。花色苷独特的结构赋予其颜色特性,pH<2时,主要以红色的2-苯基苯并吡喃阳离子形式存在;pH 3~6时,以无色的甲醇假碱或查尔酮形式存在;pH>8时,以蓝色的离子化醌式碱形式存在[11]。然而,花色苷在弱碱或碱性条件下稳定性差[12],容易发生降解褪色且难以长期保持蓝色,因此,花色苷在酸性食品基质中的使用受到限制。研究发现,由花色苷、共色素及金属离子按一定比例组成的金属螯合物能在酸性条件下呈蓝色,并可通过调控pH值实现多种颜色变化[13],这项研究为蓝色素的开发带来新的思路。Sigurdson等[14]研究了花色苷-Al3+螯合物作为天然蓝色素的可能性,结果表明,金属盐比例、pH值、花色苷浓度等是决定最终颜色和颜色深浅的关键,在酸性(pH=3.0)溶液中制备的花色苷-Al3+螯合物颜色可呈深紫色或蓝色。Buchweitz等[15]采用Fe3+盐制备花色苷-Fe3+螯合物,并将其作为天然蓝色素应用在多糖凝胶中,结果发现花色苷-Fe3+螯合物在酸性溶液中呈蓝色,多糖凝胶能提高花色苷-Fe3+螯合物的稳定性。然而,金属离子的引入可能会带来健康风险,如Al3+在人体中积累可使人慢性中毒,损害大脑神经元[16],而Fe3+的存在会导致高铁血红蛋白血症,使人红细胞失去携带氧的能力[17],相比之下,Fe2+作为构成血红蛋白、细胞色素的主要成分,有助于人体健康和生长发育[18]。但是,以Fe2+制备花色苷金属螯合物作为天然蓝色素的相关研究较少,尤其是其作为天然蓝色素的稳定性。
本研究选用Fe2+制备蓝色的花色苷-Fe2+螯合物。采用紫外分光光度计及色差仪评价酸性条件(pH=3.0)下Fe2+浓度对花色苷-Fe2+螯合物颜色的影响;将其应用于酸性模拟饮料体系,分别探究在储藏及热处理条件下花色苷-Fe2+螯合物的颜色稳定性;建立降解动力学,进一步评估花色苷-Fe2+螯合物作为天然蓝色素的应用潜力。
1 材料与方法
1.1 材料与试剂
紫茄子:购自北京物美超市。
七水合硫酸亚铁:购自国药集团化学试剂有限公司;XAD-7吸附树脂:购自北京康林科技有限责任公司;黄原胶:购自河北百味生物科技有限公司;其它试剂均为国产分析纯,购自国药集团化学试剂有限公司。
1.2 仪器与设备
台式离心机H1850:购自北京天林恒泰科技有限公司;色差仪CM-3601A:购自柯尼卡美能达办公系统(中国)有限公司;紫外分光光度计UV-2450:购自日本岛津公司;恒温水浴锅HHSY21-Ni4:购自北京市精科华瑞仪器有限公司;真空冷冻干燥机LABCONCO:购自美国Labconco公司;粉碎机JYLC051:购自九阳股份有限公司;超声波清洗仪:购自北京中晟铭科技有限公司;控制型旋转蒸发器RV10:购自广州仪科实验室技术有限公司;可视孔氮吹仪NK200-1B:购自杭州米欧仪器有限公司。
1.3 方法
1.3.1 花色苷的分离纯化 按Zhao等[8]的方法并略有修改:紫茄子剥皮、粉碎,取粉碎后的紫茄子皮30.0 g,按料液质量体积比为1 g∶10 mL加入酸性乙醇(HCl与乙醇的体积比为15:85,pH 2.0),避光超声提取(30 min)两次,将两次的上层提取液混合,旋蒸去除乙醇,将去除乙醇后的花色苷水溶液过滤去除不溶性杂质,用乙酸乙酯萃取。装填XAD-7树脂柱,上样,待吸附完全后,用6倍柱体积的酸性纯水(用HCl调pH至3.0)洗去蛋白质、糖类等杂质,酸性纯水流量为1 mL/min;用1倍柱体积的酸性乙醇(用HCl调pH至3.0)将花色苷洗脱下来,于40℃下旋蒸浓缩至3 mL左右,氮吹至干,得到花色苷提取物粉末,置于离心管中-20℃条件下保存,待用。
1.3.2 花色苷溶液质量浓度测定 用pH示差法[19]测定紫茄子花色苷质量浓度:取一定质量待测样,分别用pH 1.0和pH 4.5的缓冲液将样品稀释数倍,平衡10 min后,以纯水为空白,分别测定样液在515 nm和700 nm下的吸光值,按照(1)方程计算样液中花色苷的质量浓度。

其中M表示花色苷的质量浓度;MW表示矢车菊素-3-O-葡萄糖苷的相对分子质量(449.2 g/mol);DF是稀释倍数;L为光程长,1 cm;ε为矢车菊素-3-O-葡萄糖苷的摩尔消光系数,26 900 L/(mol·cm)。
1.3.3 花色苷-Fe2+螯合物的制备 取一定质量花色苷粉末,溶于1 mL浓度0.1 mol/L柠檬酸钠缓冲液(pH 3.0),根据1.3.2测定花色苷溶液的质量浓度,用柠檬酸钠缓冲液调整花色苷溶液质量浓度为0.2 mg/mL,加入FeSO4·7H2O使花色苷与Fe2+的摩尔比分别为1∶1、1∶75、1∶150、1∶350和1∶700,避光平衡2 h,制备花色苷-Fe2+螯合物。
1.3.4 花色苷-Fe2+螯合物的颜色评价 采用紫外分光光度计在400~700 nm测定花色苷-Fe2+螯合物的最大吸收波长及吸光值,分析其红移及增色效应,并借助色差仪测定颜色变化,确定最优花色苷与Fe2+的摩尔比。
1.3.5 花色苷-Fe2+螯合物在模拟饮料体系中稳定性研究 采用柠檬酸钠缓冲液(pH=3.0)配置模拟饮料体系。对照组的组成为:VC质量分数0.05%、花色苷与Fe2+摩尔比为1∶350,花色苷溶液质量浓度为0.2 mg/mL。模型组的组成为:黄原胶质量分数1%、VC质量分数0.05%、花色苷与Fe2+摩尔比为1∶350,花色苷溶液质量浓度为0.2 mg/mL。
黑暗条件下,对上述模拟饮料体系(对照组和模型组)分别进行储藏和热加工处理。储藏条件:分别在4℃和20℃储藏14 d;热加工条件:分别在80、90、100℃条件下处理30 min;于固定时间取样测定色差。
1.3.6 色差测定 采用色差仪CM-3601A对模型体系测定色差,记录(L*、a*、b*),使用标准白板(L*=97.43,a*=0.01,b*=1.64)校准。根据色差仪计算的L*、a*、b*值,使用颜色在线转化工具(https://www.colortell.com/labto)获得RGB值,并制作仿真颜色。
1.3.7 降解动力学计算 天然色素的降解遵循准一级反应动力学[20],确定颜色损失可得到蓝色花色苷-Fe2+螯合物的降解动力学参数,b*为负表示蓝色,当-b*减少时表示蓝色损失。将(bt*/b0*)的对数与处理时间t作图,图的斜率为降解速率常数k,见方程(2);由此可计算出半衰期值t1/2,见方程(3);活化能Eα计算见方程(4):
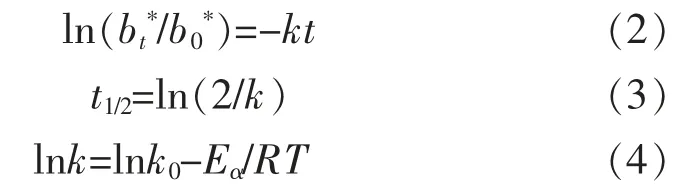
其中bt*为处理t时刻后的b*值;b0*为初始的b*值;k为斜率和降解速率常数;t为处理时间(h);k0为频率常数;R为气体常数8.314×10-3kJ/(mol·K);T为绝对温度(K)。
1.4 数据处理
所有试验均重复3次,结果以平均值±标准偏差表示,数据采用SPSS 19.0、Origin 2018C软件进行分析,以P<0.05表示试验结果具有显著性差异。
2 结果与分析
2.1 Fe2+浓度对花色苷-Fe2+螯合物颜色的影响
Fe2+浓度对花色苷-Fe2+螯合物颜色的影响如图1和图2所示,图1为不同Fe2+浓度下花色苷-Fe2+螯合物的颜色变化。在花色苷与Fe2+的摩尔比为1∶1至1∶75时,溶液颜色逐渐由红色转为粉红色和粉色,这表明花色苷与Fe2+开始发生络合形成金属螯合物,游离花色苷的质量浓度降低使溶液颜色变淡。随着花色苷与Fe2+的摩尔比逐渐增大,颜色又由粉色向蓝紫色和蓝色转变,这可能是在低pH值时,花色苷往往以红色的黄烷结构出现,并与蓝色金属螯合物竞争,使溶液颜色最终呈紫色或蓝紫色[14]。在所选Fe2+浓度范围内,花色苷-Fe2+螯合物的溶液均呈澄清透明,未出现沉淀絮凝现象,而Sigurdson等制备的花色苷-Al3+螯合物和Buchweitz等制备的花色苷-Fe3+螯合物出现少量沉淀絮凝,这是因为Al3+、Fe3+在溶液中发生水解产生氢氧化合物造成的[14,21]。不同Fe2+浓度对溶液的吸光值和最大吸收波长也有影响:与对照组相比,当花色苷与Fe2+的摩尔比处于1∶1和1∶75时,溶液吸光值显著降低(P<0.05)(图2);随花色苷与Fe2+的摩尔比增大,吸光值显著增大(P<0.05);花色苷与Fe2+的摩尔比在1∶350和1∶700之间时,吸光值没有出现显著变化(P>0.05)。Sigurdson等[14]发现,当花色苷浓度为100μmol/L时,Al3+与花色苷的摩尔比处于100~500具有最高吸收强度和最大红移现象,这种现象归结于Al3+与花色苷的醌式碱阴离子结合发生络合,而其余花色苷黄烷阳离子堆积在醌式碱阴离子顶部,并通过π-π堆积造成泛色位移而突显出蓝色;当金属离子浓度增加,促进溶液中醌式碱阴离子百分比增加,而浓度过大则减弱此现象[14,22]。此外,溶液的最大吸收波长由528 nm增至535 nm,这表明:较高Fe2+浓度能够产生增色和红移效应[23],进而导致颜色改变。因此,在不引入高浓度Fe2+前提下,选择花色苷与Fe2+的摩尔比为1∶350配置模拟饮料体系研究其稳定性。

图1 Fe2+浓度对花色苷-Fe2+螯合物的颜色的影响Fig.1 Effect of Fe2+concentration on the color of anthocyanin-Fe2+chelates
2.2 储藏条件对花色苷-Fe2+螯合物颜色稳定性的影响
采用酸性模拟饮料体系研究花色苷-Fe2+螯合物储藏稳定性,结果如图3所示。L*值表示明度值,衡量颜色深浅,0表示黑色,100表示白色[23]。在4℃和20℃,对照组和模拟饮料体系的L*值都增加,对照组从第6天开始L*值达到平衡,而模拟饮料体系逐步增加,且显著低于对照组(P<0.05),这可能有两个原因:其一是花色苷-Fe2+螯合物在储藏过程中形成灰色的氧/羟基络合物,导致L*值增加,而黄原胶能减少此类产物形成[15];其二是花色苷-Fe2+螯合物降解导致蓝色褪去,溶液逐渐呈现Fe2+的颜色(黄绿色)。a*值和b*值表示色品指数,a*值为正表示红色,为负表示绿色,b*值为正表示黄色,b*值为负表示蓝色[24]。在4℃和20℃储藏过程中对照组和模拟饮料体系的a*值和b*值分别出现下降和增加,这可能是在储藏过程中溶液中游离的花色苷及花色苷-Fe2+螯合物发生降解,导致颜色损失[15]。此外,添加黄原胶的模拟饮料体系b*值均小于对照组,说明黄原胶与花色苷-Fe2+螯合物之间可能存在相互作用[24],延缓蓝色的损失,提高花色苷-Fe2+螯合物的储藏稳定性。Buchweitz等[21]报道甜菜果胶可改善花色苷-Al3+螯合物和花色苷-Fe3+螯合物的储藏稳定性,有效防止沉淀产生并获得蓝色。

图2 Fe2+浓度对花色苷-Fe2+螯合物吸光值及最大吸收波长的影响Fig.2 Effect of molar ratio of anthocyanin:Fe2+on the absorption value and maximum absorption wavelength of anthocyanin-Fe2+chelates
2.3 热加工对花色苷-Fe2+螯合物颜色稳定性影响
分别在80、90、100℃的条件下对模拟饮料体系和对照组的花色苷-Fe2+螯合物处理30 min,其颜色变化如图4所示,在加热条件下,模拟饮料体系和对照组的a*值和b*值分别出现下降和增加,a*值下降说明加热使花色苷的黄烷结构发生改变,而b*值增加可能是因为加热导致花色苷-Fe2+螯合物发生氧化、褐变[25]。此外,模拟饮料体系的L*值、a*值显著低于对照组(P<0.05),其变化趋势与储藏条件基本一致,不同的是两组样品在热处理5 min后L*值基本达到平衡。同时,热加工温度对花色苷-Fe2+螯合物的影响存在差异,在80、90℃热加工中模拟饮料体系b*值低于对照组,而在100℃时模拟饮料体系b*值高于对照组,这说明在较高温条件下黄原胶并不能有效提高花色苷-Fe2+螯合物颜色的稳定性,原因是:黄原胶在高温下结构发生改变,容易受到外部自由基攻击[26],失去对花色苷-Fe2+螯合物的保护作用。因此,使用热稳定性较好的多糖可能有助于改善花色苷-Fe2+螯合物的颜色稳定性。总体来看,所制备的花色苷-Fe2+螯合物热稳定性较差,这与此前报道的花色苷-Al3+螯合物和花色苷-Fe3+螯合物的颜色稳定性结果一致[21,27]。高温加快花色苷-Fe2+螯合物颜色损失,黄原胶可改善其在80、90℃热加工条件下的颜色稳定性。

图3 储藏条件对花色苷-Fe2+螯合物颜色稳定性的影响Fig.3 Effect of storage conditions on color stability of anthocyanin-Fe2+chelates
2.4 花色苷-Fe2+螯合物降解动力学研究
按照1.3.7方法建立花色苷-Fe2+螯合物的降解动力学方程,进一步评估花色苷-Fe2+螯合物的稳定性,结果如表1所示。花色苷-Fe2+螯合物在不同温度条件下的降解均符合一级反应动力学(R2>0.80),通过观察降解速率常数和半衰期t1/2可知,对照组在4℃和20℃储藏过程中降解速率变化并不明显,相比之下,模拟饮料体系添加了稳定剂黄原胶,它能有效缓解花色苷-Fe2+螯合物的降解,在4℃储藏效果显著,半衰期增加78.48 h。然而,在热加工条件下,随着加工温度的升高,对照组及模拟饮料体系的降解速率常数k均显著增大(P<0.05),热加工导致花色苷-Fe2+螯合物的降解加快,蓝色损失较大,半衰期时间变短,可能因为温度过高使花色苷-Fe2+螯合物发生解离,导致b*增大(图4),随加热时间延长,蓝色逐渐消失。活化能代表物质发生转变时所需要吸收的能量,能量越高表示物质越稳定[25]。在不同温度下,对照组活化能Eα为46 kJ/moL,低于模拟饮料体系(48 kJ/moL),这表明黄原胶能够提高花色苷-Fe2+螯合物的稳定性,这与Buchweitz等[27]研究报道甜菜果胶提高花色苷-Fe3+螯合物颜色稳定性的结果一致。因此,在实际应用中通过添加多糖稳定剂可减缓花色苷-Fe2+螯合物的降解。

图4 热处理对花色苷-Fe2+螯合物颜色稳定性的影响Fig.4 Effect of thermal treatment on the color stability of anthocyanin-Fe2+chelates
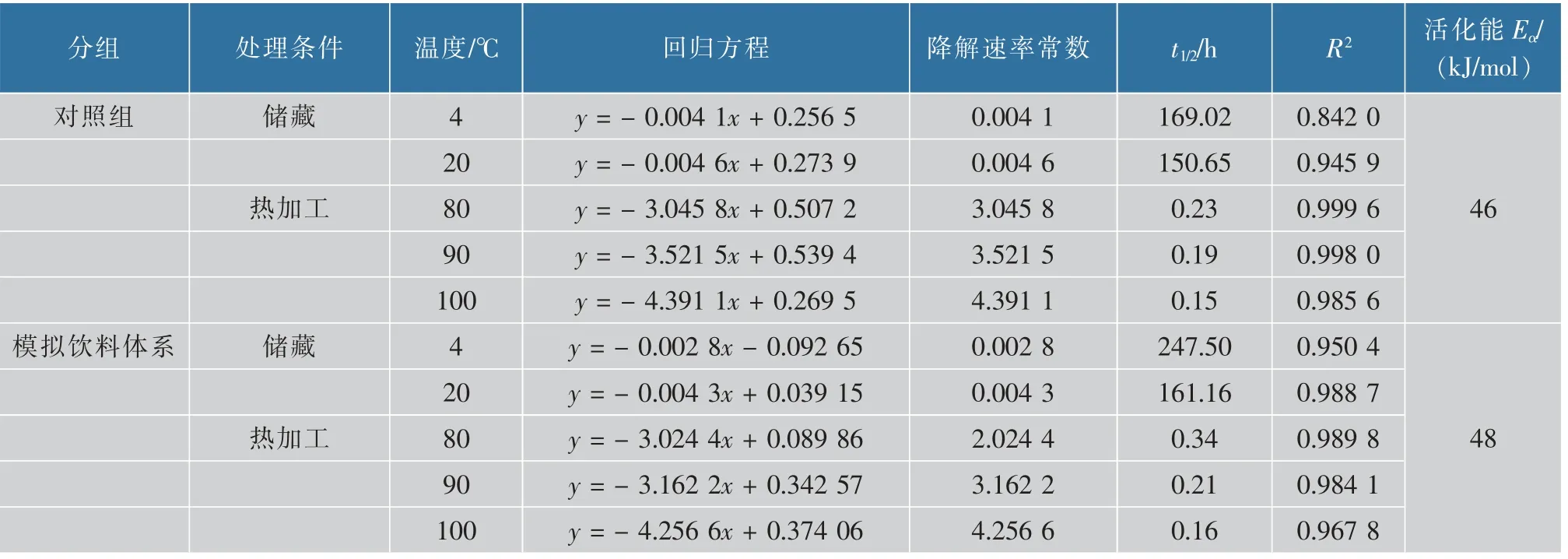
表1 花色苷-Fe2+螯合物的降解动力学参数Table 1 Kinetics parameters of degradation of anthocyanin-Fe2+chelates
3 结 语
本研究讨论了不同Fe2+浓度对花色苷-Fe2+螯合物颜色的影响,确定花色苷与Fe2+的最优摩尔比为1∶350,所制备的花色苷-Fe2+螯合物颜色呈紫蓝色,采用模拟饮料体系(pH=3.0)评估其储藏和热加工颜色稳定性。结果表明:花色苷-Fe2+螯合物的降解遵循一级反应动力学(R2>0.80),在4℃黑暗储藏14 d,花色苷-Fe2+螯合物的颜色稳定性优于20℃条件下处理的螯合物,通过添加黄原胶能够提高花色苷-Fe2+螯合物的半衰期和活化能,进而减缓螯合物降解和蓝色损失。然而,热加工过程中,花色苷-Fe2+螯合物热稳定性较差,高温加速花色苷-Fe2+螯合物降解。因此,该花色苷-Fe2+螯合物的热稳定性还存在不足,仅适用于食品的低温加工和储藏。
