姜黄素抗脑缺血再灌注损伤的药理学研究进展
2021-06-24杨鹏飞
孙 玉 李 鹏 杨鹏飞
新乡医学院药学院,河南省心血管重构与药物干预国际联合实验室,新乡市心血管重构干预与分子靶向治疗重点实验室,新乡,453003,中国
姜黄(turmeric)为常用传统中药,收载于《中华人民共和国药典》,属姜科姜黄属植物姜黄的干燥根茎,具有破血行气、通经止痛的功能,传统中医用于胸胁刺痛、闭经、癫痫、风湿、肩臂疼痛、跌打肿痛。姜黄的活性成分包括挥发油和姜黄素类物质等,其中姜黄素(curcumin)是其主要的生物学成分。动物实验研究发现,姜黄素有抗炎、抗氧化、抗动脉粥样硬化、降血脂等广泛的药理作用[1]。脑卒中具有“发病率高”、“死亡率高”、“致残率高”、“复发率高”、“经济负担高”的典型五高特点,是全球成年人永久性致残的首要元凶,也是第二大死亡原因,给家庭和社会带来沉重的经济负担[2]。脑卒中包括出血性脑卒中和缺血性脑卒中,临床以缺血性脑卒中更为多见。缺血性脑卒中是由脑部供血不足所引起的急性脑血管病变,表现为患者突然出现的单侧肢体软瘫,意识丧失甚至晕倒的现象。在最短的时间内恢复患者的血液供应,是改善脑卒中患者神经系统状况及预后情况的主要手段,但多数情况下,给予及时的药物或手术溶栓灌注治疗后,患者原有的神经损伤并没有恢复,甚至出现坏死和过度凋亡现象,这种现象被称为脑缺血再灌注损伤[3],指由于线粒体功能障碍、氧化应激、炎症浸润、谷氨酸毒性、Ca2+超载、程序性细胞死亡等机制的损伤作用,神经细胞数目大量减少,大脑功能出现明显障碍。脑缺血再灌注损伤的发病机制复杂、临床表现严重,给患者带来巨大的生命威胁和沉重的经济负担,但目前仍缺乏可对其有明显缓解作用的药物。近年来的研究显示,姜黄素的抗炎、抗氧化和调控细胞程序性死亡的药理作用可用来缓解脑缺血再灌注损伤,本文将从脑缺血再灌注损伤的发病机制角度,对姜黄素缓解脑缺血再灌注损伤的药理作用及机理进行系统综述,以期为姜黄素治疗脑缺血再灌注损伤提供理论依据。
1 修复线粒体功能损伤
脑缺血发生后,ATP 合成不足造成的线粒体功能障碍,是脑缺血再灌注损伤的触发因素和重要机制。线粒体是由双层膜结构组成的细胞器,其中线粒体内膜含呼吸链和氧化还原性酶,可以通过三羧酸循环和氧化磷酸化反应分解丙酮酸等供能物质,生成大量的ATP,以保证细胞生理活动的稳定进行,因此被称为细胞的能量工厂[4]。但在某些应激条件下,线粒体也可生成活性氧(reactive oxygen species,ROS)并释放氧化酶,从而激活或介导细胞的凋亡。脑缺血再灌注后,神经细胞由于长时间的缺血,线粒体结构被损伤,引起线粒体外膜通透性增加,促进细胞色素C 等内容物向细胞质的释放,从而诱发细胞凋亡。此外线粒体损伤也可导致呼吸链断裂,氧化磷酸化合成ATP 的功能障碍,加速细胞凋亡的发生[5]。
研究显示,姜黄素能够通过促进线粒体融合蛋白2(mitofusin-2,Mfn-2)的表达,调控线粒体融合的过程,以稳定线粒体的结构和功能[6];此外,氧电极法检测结果显示,姜黄素可以有效降低线粒体的呼吸控制率、呼吸链的损伤、线粒体的氧化磷酸化效率[7];并促进过氧化物酶体增殖物激活受体γ共激活子-1α(peroxisome proliferator-activated receptor-γ coactivator-1α,PGC-1α)、线粒体解偶联蛋白2(uncoupling proteins 2,UCP2)、线粒体转录因子A(mitochondrial transcription factor A,TFAM)及线粒体转录因子B(mitochondria transcription factor B,TFBM)的表达,从而恢复线粒体功能,改善神经系统的损伤[8]。
2 抑制氧化应激
线粒体的内膜内含多种氧化性酶,是氧化磷酸化作用的主要场所,也是应激条件下ROS 生成的主要部位,同时也最易受ROS 的损伤[9]。ROS 是化学性质极为不稳定的一类含氧化合物,包括过氧化氢(hydrogen peroxide,H2O2),超氧阴离子(superoxide anion,O2-)以及一氧化氮(nitric oxide,NO)等[10]。
脑缺血再灌注后,虽病人的氧气供应恢复,但线粒体功能障碍依旧存在,生成的e-数量不足,使再灌注治疗中补充的氧气无法与足够的e-作用(即每个O2可与四个e-反应)直接生成H2O 和大量的ATP,导致中间产物如H2O2及等的生成不断增多,使体内氧自由基的含量不断增加[11]。其次脑缺血再灌注后,Ca2+在细胞内不断蓄积,激活Ca2+依赖性蛋白酶,随后活化的Ca2+依赖性蛋白酶可将黄嘌呤脱氢酶催化为黄嘌呤氧化酶,并诱导次黄嘌呤分解生成尿酸和H2O2,诱发H2O2在体内的蓄积[12]。再次在脑缺血再灌注损伤的早期阶段,机体代偿性通过增加一氧化氮合酶(nitric oxide synthase,NOS)的活性,促进L-精氨酸转化为NO,提高NO 的浓度,以舒张血管从而缓解细胞的缺血缺氧。但随疾病的发展进程,体内NO 的合成不断增加,最终可引起NO 的蓄积[13]。在以上病理过程作用下,体内的ROS 大量累积造成氧化应激反应,损伤细胞膜、溶酶体和内质网膜的完整性,开放线粒体通透性转换孔(mitochondrial permeability transition pore,mPTP),诱导细胞色素C 的释放,激活含半胱氨酸的天冬氨酸蛋白水解酶家族(cysteinyl aspartate specific proteinase,Caspase),最终引起细胞凋亡[14]。众多研究表明姜黄素可以抑制氧化应激反应的发生,其作用机制可分为抑制活性氧生成和增强机体对活性氧的清除作用。
姜黄素及其衍生物均能够通过抑制黄嘌呤氧化酶的活性[15],有效减少体内H2O2的生成。姜黄素还可增强机体对ROS 的清除作用[16]。首先,动物实验的结果表明,姜黄素给药后,大鼠体内过氧化氢酶(catalase,CAT)及谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)的活性明显增强,H2O2的浓度明显降低[17]。此外,姜黄素也能够促进超氧化物歧化酶(superoxide dismutase,SOD)的表达,使得O2-的浓度显著下降[18]。最后,研究发现经过姜黄素干预,核转录因子E2 相关因子2(nuclear factor-E2-related factor 2,Nrf2)及血红素氧合酶-1(heme oxygenase-1,HO-1)的表达明显被增强,SOD 和CAT 及谷胱甘肽过氧化物GSH-Px 等抗氧化酶的活性增强,推测姜黄素可能通过激活Nrf2/抗氧化反应原件(antioxidant response element,ARE)信号通路,以促进抗氧化酶的表达,增强机体清除活性氧的能力,从而有效降低神经系统内的活性氧成分[19]。
3 抑制炎症反应发生
炎症作用与脑缺血再灌注损伤的发展密切相关,在此过程中,小胶质细胞及星形胶质细胞的活化和白细胞的渗出为炎症反应发生的细胞基础。脑缺血后增多的ROS 导致机体出现氧化应激反应,激活位于细胞膜表面的损伤相关分子识别受体,促进炎性介质的分泌,诱导脑内固有的免疫细胞(小胶质细胞)活化并分泌肿瘤坏死因子-α(tumor necrosis factor alpha,TNF-α)和白细胞介素-1β(interleukin-1β,IL-1β)、基质金属蛋白酶(matrix metalloproteinases,MMPs)等[20-21],加速炎性介质在体内的蓄积;另一方面MMPs 尤其是MMP-9的增加能够抑制血脑屏障内皮细胞间的紧密连接蛋白(tight junction proteins,TJPs)的活性,损伤血脑屏障,增加血脑屏障的通透性,促进外周的水分、白细胞及炎症介质进入脑细胞,诱发脑水肿现象[22];而IL-1β能够促进星形胶质细胞的活化和反应性胶质化,活化的星形胶质细胞不仅可以分泌炎性介质,加重神经细胞内炎症介质的蓄积[23],而且能够分泌趋化因子及黏附因子,诱导血管内的白细胞黏附聚集并浸润组织细胞和血脑屏障,加重神经细胞的损伤[24-26]。综上所述,小胶质细胞活性的增强和炎症细胞的浸润推动了脑缺血再灌注期间炎症反应的发生和发展。研究发现,姜黄素给药可以明显抑制炎症介质的生成,有效保护血脑屏障并预防脑水肿的发生(Fig.1)。
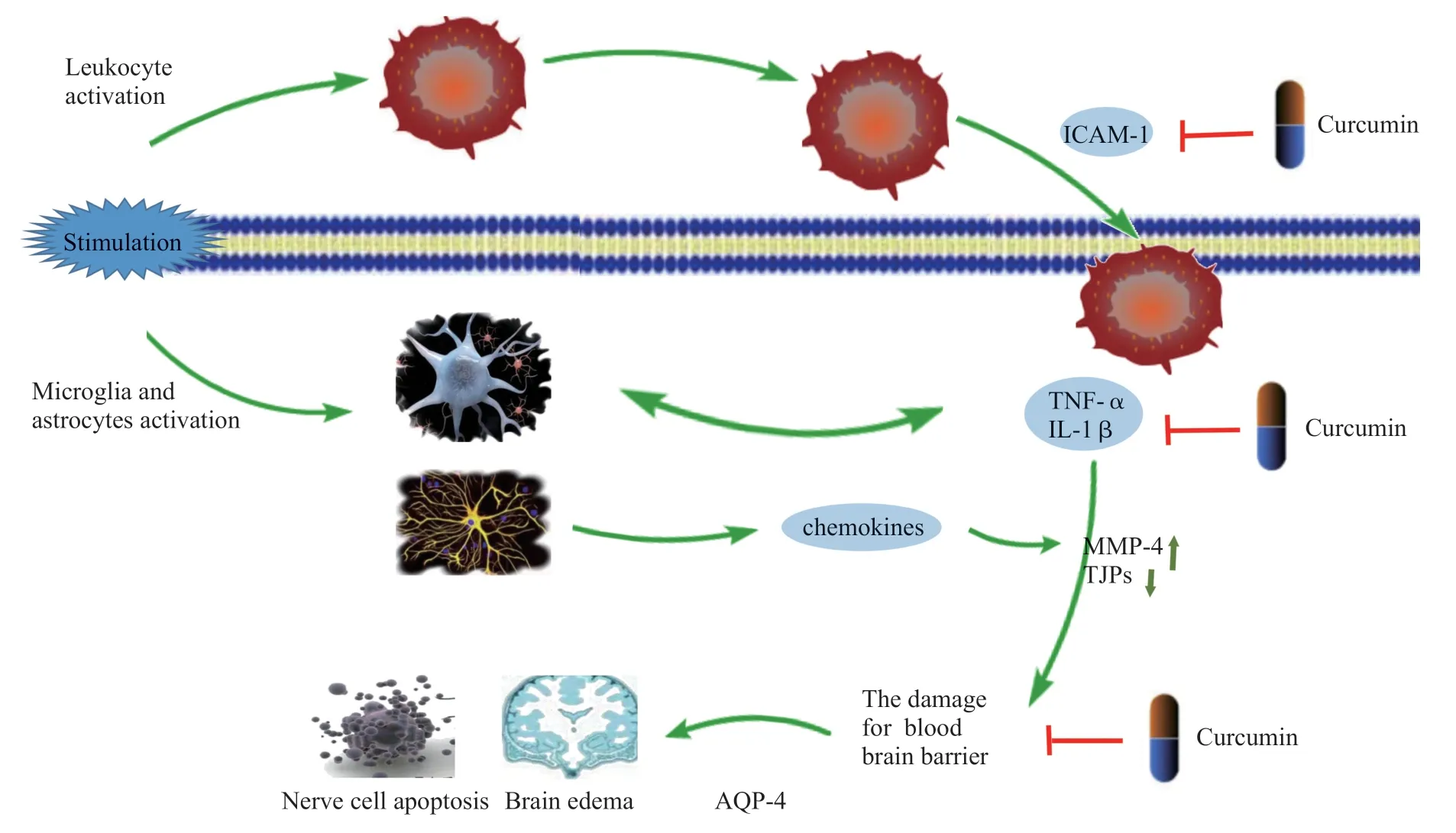
Fig.1 Curcumin plays an anti-inflammatory role by inhibiting glial cell activation and leukocyte infiltration
3.1 调控小胶质细胞的活化
姜黄素能够通过促进miRNA-182(miR-182)的表达,调控小胶质细胞的活化。miR-182 是成人脑中含量非常丰富的micro RNA,在调控小胶质细胞活性方面发挥着重要作用。miR-182 可靶向抑制钟样受体4(tolllike receptor 4,TLR4),以拮抗小胶质细胞的活化[27-28],动物实验表明姜黄素给药后miR-182 的表达增加,小胶质细胞活化程度降低,TNF-α,IL-1β 炎症介质和NO、H2O2、谷氨酸(glutamate,Glu)等细胞毒性物质的分泌减少[29]。姜黄素也可以通过抑制NF-κB 信号通路,调控星形胶质细胞的活化以降低炎性介质、趋化因子的分泌,缓解白细胞对血脑屏障和神经细胞的浸润[30]。
3.2 缓解血脑屏障的损伤
姜黄素同样能够缓解血脑屏障的损伤,减轻神经系统的炎症性反应。在大鼠动物模型实验中发现,姜黄素不仅可以抑制海马区MMP-9、细胞黏附因子-1(intercellular cell adhesion molecule1,ICAM-1)、水 通道蛋白-4(aquapporin-4,AQP-4)及血管间黏附因子-1(vascular cell adhesion molcule-1,VCAM-1)等多种蛋白的分泌,还可以有效上调紧密连接蛋白TJPs 的表达,从而显著降低血脑屏障的通透性,抑制外周淋巴细胞对组织的浸润,保护血脑屏障的完整性[31-33]。
4 降低谷氨基酸毒性
兴奋性氨基酸类神经递质(excitatory amino acids,EAA)是中枢神经系统内主要的兴奋性突触传递递质,包括Glu 和天冬氨酸,其中Glu 在哺乳动物脑内有更为广泛的表达,也是脑缺血发生时引起神经元损伤的关键因素[34],Glu 在体内主要由突触前膜释放,经突触间隙作用于突触后膜。当突触间隙内的Glu 出现少量蓄积时,突触前膜及突触旁星形胶质细胞可对其进行重摄取,并借助谷氨酰胺合成酶(glutamine synthesize,GS)作用将谷氨酸代谢为谷氨酰胺,重新转入神经元细胞,以此形成神经系统内的谷氨酰胺循环。此外,星形胶质细胞对Glu 的重摄取依赖于其膜表面的兴奋性氨基酸转运蛋白(excitatory amino acid transporters,EAAT)的活性。研究显示,EAAT 是机体调控神经系统内兴奋性氨基酸浓度的主要方式,负责90%的谷氨酸的转运,且EAAT 的功能障碍尤其是以EAAT2 活性的降低与谷氨酸毒性反应的发生有着密不可分的联系[35-37]。另外,EAAT 是Na+/K+依赖性神经递质转运体,即星形胶质细胞通过重摄取Glu 维持Glu 稳定的功能,依赖于细胞内外的Na+/K+浓度梯度[38]。研究发现脑缺血再灌注后,神经系统内ATP 合成不足,Na+/K+-ATP功能障碍,细胞内外Na+浓度梯度降低。此外,在缺血再灌注后增加的氧自由基和炎症因子同样对于EAAT的活性也造成了明显的抑制作用[39],导致Glu 大量积聚于突触间隙,从而诱发Glu 毒性作用,并激活Ca2+高度敏感性的Glu 离子型受体N-甲基-D-天门冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDAR),引 起Ca2+的大量内流,加速钙超载现象的发生[40],进一步降低线粒体的膜电势差,引起线粒体通透性转换孔mPTP的开放,最终启动线粒体凋亡级联反应,诱发神经细胞凋亡[41]。
以往的研究发现,姜黄素可以通过缓解EAAT 的损伤,修复机体对Glu 的重摄取能力,以阻止兴奋性氨基酸毒性的发生。其作用机制可总结为以下两点:一方面姜黄素可以降低TNF-α的分泌[42],并呈剂量依赖性地提高Na+/K+-ATP 酶活性,并因此明显增强EAAT 的活性[43],增强机体对Glu 重摄取能力。另一方面,姜黄素也可以提高突触前膜和星形胶质细胞内谷氨酰胺合成酶(glutamine synthetase,GS)的活性,促进被重摄取后Glu 向谷氨酰胺的转化,加快机体对Glu 的降解速度[44]。
5 抑制钙超载
在脑缺血再灌注过程中,钙超载的发生是多种机制共同作用的结果。首先,脑细胞缺血可以增加活性氧的生成,使膜结构的完整性被损伤,生物膜中的糖萼层分离,最终引起生物膜通透性增加,诱发胞外Ca2+的内流运动[45];其次,脑缺血再灌注后,线粒体无氧酵解反应增强,细胞内丙酮酸的含量增多,机体H+-Na+交换被抑制,Na+-Ca2+交换被激活,进一步加剧胞外Ca2+的内流运动[46];再次,在Glu 的毒性作用下,膜Ca2+通道处于持续开放状态[47-48],此外,脑缺血再灌注会引起ATP合成不足并诱发钙泵功能障碍,使得细胞排出Ca2+的能力下降,导致Ca2+在细胞内不断蓄积。综上所述,在脑缺血再灌注期间,Ca2+的内流增加且细胞排除Ca2+的能力障碍,最终引起钙超载[49]。胞质内增多的Ca2+一方面激活磷脂酶、黄嘌呤氧化酶、Ca2+依赖性降解酶的活性,损伤蛋白质及细胞膜的结构和功能损伤[50];另一方面在线粒体内形成磷酸沉积造成线粒体功能障碍进一步降低ATP 的合成;同时增多的Ca2+还可以与亲环素D 结合后诱导线粒体通透性转化孔mPTP 开放,引起细胞色素C 等促凋亡物质的释放,最终诱发或加速细胞凋亡[51]。
药理学研究显示,姜黄素可以抑制脑缺血再灌注损伤过程中钙超载的发生,其机制为姜黄素不仅可以抑制Ca2+的内流,而且可以促进胞浆Ca2+的排出[52]。姜黄素不仅能够呈浓度依赖性地使电压依赖型通道的失活曲线向超极化方向移动,抑制高电压门控通道电流[53];还可以降低G 蛋白偶联受体活性从而抑制受体操纵型Ca2+通道的开放[54]。同时动物实验也发现,姜黄素可以降低内质网表面的1,4,5-三磷酸肌醇受体(inositol 1,4,5-trisphosphate receptor,IP3R)蛋白的活性,抑制其对内质网Ca2+通道开放的促进作用,以上实验研究表明姜黄素可以经过多种途径显著降低胞浆内的Ca2+[55-56]。同时姜黄素也可以通过提高Ca2+-ATP酶的活性,增强ATP 依赖性钙泵的功能,促进机体对Ca2+的清除作用[57]。
6 调控程序性细胞死亡
神经系统内存在多种程序性细胞死亡过程,此过程由基因调控,对维持神经系统内环境的稳态有着重要作用,其形式包括细胞凋亡、细胞焦亡、细胞自噬等[58],姜黄素对于神经元程序性死亡的调控机制如Fig.2 所示。
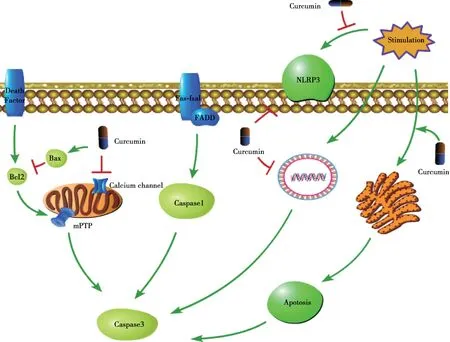
Fig.2 Curcumin protects neurons by inhibiting programmed cell death
6.1 对神经细胞的过度凋亡的抑制作用
脑缺血后,细胞处于强应激状态,体内凋亡相关因子和蛋白的表达被激活,细胞膜间连接消失,胞质内线粒体嵴增多并表现出膨胀空泡化,内质网核糖体脱落,网腔膨胀,细胞骨架紊乱,细胞核内DNA 断裂、染色质聚集形成新月状结构,随后细胞核裂解,形成凋亡小体。同时凋亡小体膜内的磷脂酰丝氨酸外翻,因此当凋亡小体形成脱落后能够及时被吞噬细胞识别吞噬,从而避免诱发炎症反应[59]。脑缺血再灌注后,由于谷氨酸毒性反应、炎症损伤、钙超载等的刺激作用,从而诱发神经细胞的过度的凋亡反应,造成中枢神经系统严重的功能障碍[60]。
姜黄素可以通过降低凋亡相关基因及蛋白的表达、促进损伤DNA 的修复,缓解脑缺血再灌注后过度的细胞凋亡现象。首先,动物实验显示姜黄素给药可以增强Bcl-2 蛋白的表达并抑制Bax 蛋白的活性,恢复线粒体孔道周围的电势差,从而显著降低细胞色素C 的释放[61];此外,姜黄素也可以有效降低凋亡蛋白活化因子-1(apoptosis protease-activating factor 1,Apaf-1)的 表达[62],降低JNK(c-Jun N-terminal kinase)通路的活性,直接减少Caspase-3 的合成和分泌[63]。同时,姜黄素能够增加凋亡抑制因子P53 基因的表达,以修复受损的DNA[64]。综上所述,姜黄素可以有效调控脑缺血再灌注后的过度细胞凋亡,从而缓解再灌注后的脑功能障碍。
6.2 对细胞焦亡的拮抗作用
炎症小体是核苷酸结合寡聚化结构域样受体蛋白3(NOD-like receptor protein 3,NLRP3)参与组装的一种复合物,NLRP3 可广泛表达于神经系统内各细胞间,能特异识别细胞的损伤及免疫信号,对于调控神经系统的免疫反应有重要作用[65]。在脑缺血再灌注后,机体受到损伤相关分子模式的刺激,NLRP3 被激活,随后通过招募Caspase-1,诱导其切割焦亡蛋白GSDMD,引发细胞焦亡反应,造成细胞肿胀裂解死亡,并释放细胞内容物并诱发剧烈的炎症反应[66-67]。动物实验证明,姜黄素给药后脑缺血再灌注大鼠体内Caspase-1、NLRP3、IL-18 的表达明显减少[68],这表明姜黄素可以通过抑制细胞焦亡发挥保护神经元作用。
6.3 对细胞自噬的促进作用
自噬是机体为保护自身内环境的稳态而出现的自我消化过程,即细胞在自身溶酶体的作用下降解细胞内有害的大分子物质及损伤的细胞器的过程[69]。有研究表明在卒中的早期(缺血再灌注的72 h 内),自噬的发生可以降解损伤的线粒体,减轻氧化应激反应,抑制炎症介质的产生并缓解细胞损伤[70]:脑缺血时,转录因子NF-f2 的表达增加,激活小胶质细胞,并增加IL-6 和TNF-α等炎症介质的分泌,机体代偿性启动自噬反应以降低炎症损伤[71],此外脑细胞缺血后也可以激活腺苷酸环化酶激活酶(AMP-activated protein kinase,AMPK)-雷帕霉素靶点蛋白(mechanistic target of rapamycin,mTOR)通路,诱发自噬反应以缓解神经系统的损伤[72]。动物实验表明,姜黄素可以促进细胞自我保护性的自噬反应。PI3K/丝氨酸激酶(serine/threonine kinase,Akt)-mTOR 是调控自噬反应的经典通路,PI3K 的活化可以促进自噬小体的生成[73-74],大鼠实验发现姜黄素给药后PI3K/Akt 磷酸化水平明显增高,自噬因子LC-3、Beclin-1 的表达增加,证明姜黄素可以通过PI3K/Akt 通路促进自噬反应的发生[75-76];此外,姜黄素给药也可将丝裂酶原蛋白激酶激酶(mitogen activated protein kinase,AMPK)活化为磷酸化的丝裂酶原蛋白激酶p-AMPK 表达[77],p-AMPK 随后可以直接磷酸化mTOR 表达的必需物质(tuberous sclerosis complex,TSC1)和TSC2,使有抑制自噬作用的mTORC1 复合物失活,从而促进自噬的发生[78]。
7 促进神经系统功能恢复
研究表明,姜黄素可以从多方面促进神经系统功能的恢复,主要表现为:调控星形胶质细胞的活性、促进多能干细胞和神经干细胞的分化、有效稳定神经细胞的生长坏境。
7.1 抑制星形胶质细胞的过度活化
星形胶质细胞是中枢神经系统内数量最多的细胞,约占总数的50%[79],其对神经系统的恢复有着双面作用,一方面星形胶质细胞既可以储备糖原,为缺血缺氧的神经元提供能量、释放神经营养因子,促进神经元再生和修复[80-82],另一方面,星形胶质细胞受到刺激因素影响后,活化为反应性胶质细胞,并在病灶边界聚集分泌胶质瘢痕,缺血早期胶质瘢痕可以隔离损伤组织,保护正常细胞;但后期过度活化的星形胶质细胞使瘢痕面积逐步扩大,影响新生的神经元细胞进入损伤组织区域、进一步限制缺血区的能量供应,阻碍神经功能的修复[83-84]。近有实验证明,姜黄素可通过下调酪氨酸激酶(janus kinases,JAK)/signal transducers and activator of transcription(STAT3)信号通路调控星形胶质细胞的过度活性,抑制胶质瘢痕的生成,促进神经功能的恢复[85]。
7.2 促进神经干细胞的增殖分化
神经干细胞是中枢神经系统内的有自我更新和增殖能力的母细胞[86],具有分化为神经元和胶质细胞的潜能,而多能干细胞是存在于体细胞内的有着与胚胎干细胞相似的多向分化和自我更新功能的细胞[87]。有文献研究指出姜黄素可以激活Notch 通路促进神经干细胞的增殖,并抑制神经干细胞向小胶质细胞分化[88],还可以通过cAMP-PKA-CREB 信号通路促进多能干细胞向神经干细胞的分化[89]。同时,动物实验发现姜黄素能够通过激活蛋白激酶A(protein kinase A,PKA),促进神经生长因子家族中脑源性神经营养因子(brainderived neurotrophic factor,BDNF)的释放[90],从而促进神经细胞生长。
7.3 稳定细胞骨架,维护细胞生长环境
姜黄素给药可以通过增加载脂蛋白E(apolipoprotein E,ApoE)的分泌,阻止tau 蛋白的去磷酸化,促进tau蛋白与细胞微管相结合稳定细胞骨架,从而促进神经元细胞的生长[91-92]。
8 保护血管内皮细胞
血管功能是保证人体组织细胞正常的血液供应的必备条件,正常生理条件下,血管内皮细胞可分泌内源性的血管物质,以维持血管的弹性及完整性,保证组织细胞的血液供应[93]。脑缺血再灌注后,ROS、炎症因子等细胞毒性物质均可以损伤血管内皮细胞,造成血管舒张功能明显障碍,加剧细胞内缺血缺氧。临床调查数据也显示,血管内皮细胞的损伤程度与脑缺血再灌注损伤发展的严重水平也存在明显相关性,此外及时修复损伤的血管内皮细胞也被认为是恢复血脑屏障功能的重要途径,对于减轻脑缺血再灌注损伤有着积极作用[94]。
研究发现,姜黄素对血管内皮有明显的保护作用,其作用机制有:促进血管内皮细胞的再生、缓解血管内皮细胞的损伤。有文献指出姜黄素能够通过增加音猬因子(sonic hedgehog,Shh)的表达,增强血管内皮生长因子及血管生成素的活性,从而促进血管的再生[95]。同时也有动物实验证明,姜黄素可以抑制氧糖剥夺条件下丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)-p38-核因子-κB(nuclear factor-κB,NFκB)通路,以降低其诱发的炎症反应,进而减轻微小血管内皮细胞受到的炎症损伤[96]。
9 展望
姜黄素来源于传统中药植物姜黄的根茎,有来源广、成本低、副作用小的优点,目前临床上已被应用于口腔义齿炎症和皮肤疾病的治疗,并取得理想的治疗效果[97-98]。根据临床前期的药理学研究结果显示,姜黄素有抗炎、抗氧化、抗凋亡等多种作用,对抑制脑缺血再灌注后的缺血周围区细胞凋亡、保护和修复神经系统的功能有着显著作用(Fig.3),因此对姜黄素对缺血再灌注损伤的保护机制进行综述,希望以此为姜黄素的机制探讨和研发提供基础性理论支持。
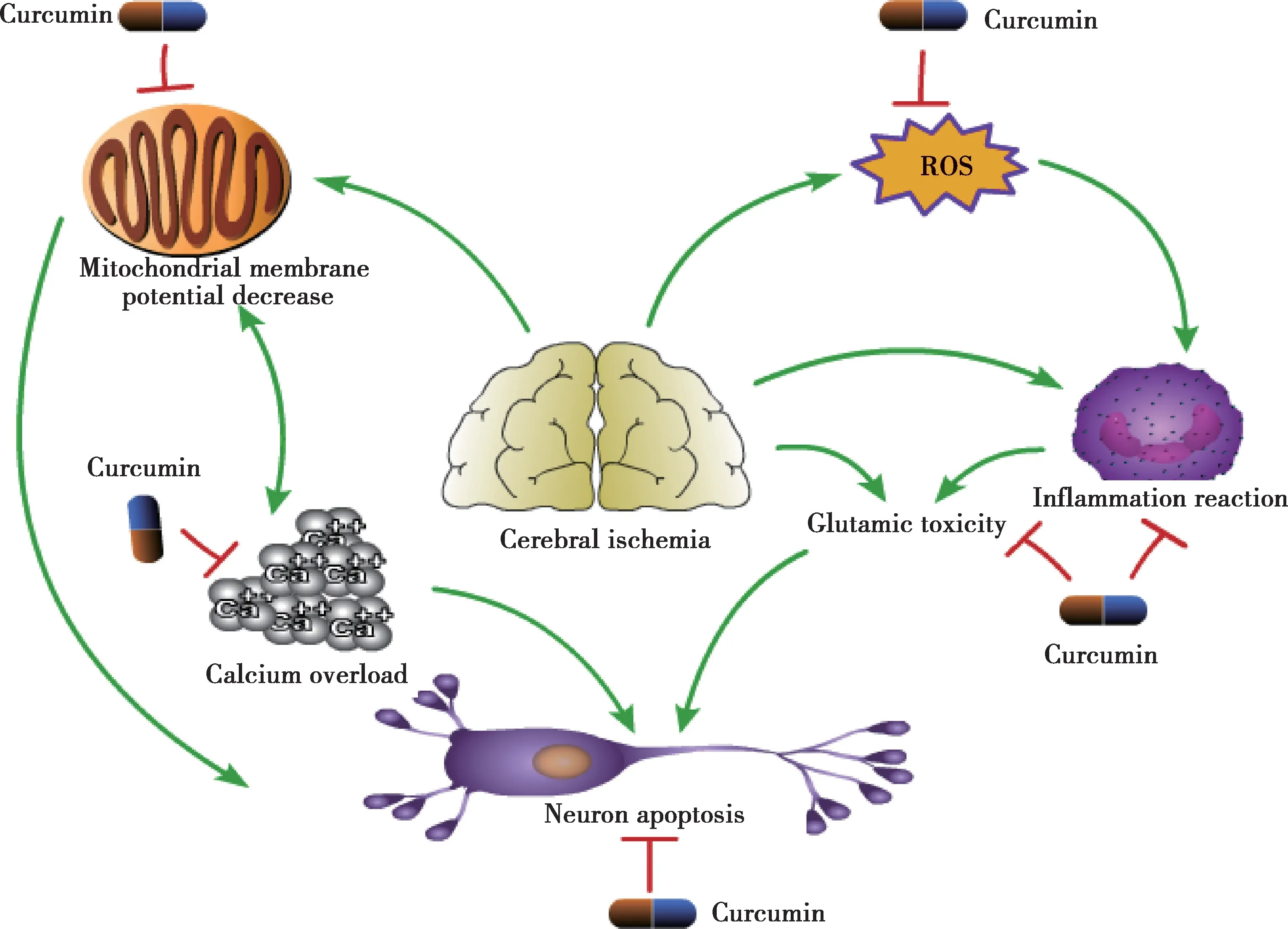
Fig.3 Pharmacological mechanism of curcumin in protecting cerebral ischemia-reperfusion injury
但是,药物代谢动力学研究显示姜黄素应用一定的局限性。一方面神经系统对姜黄素的吸收存在明显障碍,实验室数据显示,经注射给药姜黄素1 小时后,仅0.5%的给药量姜黄素可以定位于脑干、纹状体和海马[99],另一方面姜黄素的水溶性较差,半衰期较短,在体内极易被代谢[100]。在以上因素的综合作用下,姜黄素的生物利用度明显被降低。
近年来经过对姜黄素新剂型的开发,可能部分解决以上问题。研究显示,对比传统口服姜黄素,经鼻给药纳米包装的姜黄素可以有效提高其吸收率[101];这意味着对姜黄素剂型上的创新可以有效提高姜黄素的生物利用度,但调查显示使用过程中的实际装载量会很大程度上影响纳米姜黄素的稳定性:沉淀组中,随载药量的增加而明显升高,纳米乳的稳定性明显下降;晶型比例明显增加[102]。这意味着将姜黄素开发成为中枢神经系统药物还有很长的道路要走。此外,目前对于姜黄素在中枢神经系统疾病治疗上的研究仍停留在动物实验层面,缺乏人体试验的数据,因此,使用多中心、大样本量的临床随机对照实验来验证姜黄素在脑缺血再灌注损伤治疗过程中的作用,进一步确认其药效,并深入探讨其药理作用机制是医药学工作者下一步工作的重点。
