抗坏血酸对动态培养体系中mESCs扩增特性的影响
2021-06-23田连华蔡海波谭文松
田连华,张 童,蔡海波,谭文松
(华东理工大学 生物反应器工程国家重点实验室,上海 200237)
ESCs动态培养过程中,细胞堆积生长形成的聚集体过大,往往会因物质传递阻力,造成其内部营养物质耗竭和代谢废物积累,导致聚集体内部细胞出现老化现象[1-3];此外,动态培养时,搅拌所产生的剪切力也会导致细胞老化[4]。细胞老化是限制ESCs扩增的主要因素之一。细胞老化有99%是由自由基损伤所致[5-6]。众多自由基中超氧阴离子和羟自由基等活性氧自由基(Reactive oxygen species,ROS)对细胞毒作用最为突出[7-8]。抗坏血酸作为广泛应用的天然抗氧化物之一,可以有效调节ROS水平[9-10]。然而,抗坏血酸是否能够调节ESCs的ROS水平,延缓细胞老化进程,促进ESCs的扩增和干性维持,目前尚不明确。因此,以解决细胞老化问题作为切入点,选取mESCs作为研究对象,研究微载体动态悬浮培养过程中细胞老化的解决策略。
1 材料与方法
1.1 材料
mESCs由上海斯丹赛生物技术有限公司干细胞资源库与干细胞研究关键技术平台提供。细胞培养所用的基本培养基为DMEM培养基(Knockout DMEM,Gibco),使用时添加15%胎牛血清(Hyclone)、10 ng/mL白血病抑制因子(Perprotech)、1%青霉素-链霉素(Beyotime)、1%非必须氨基酸(Sigma)、1%谷氨酰胺(Sigma)以及0.1 mmol/L β-巯基乙醇(Sigma)。实验组添加抗坏血酸(Sigma)。微载体Cytodex3(GE Healthcare Biosciences AB),转瓶(Corning)。
1.2 方法
1.2.1 mESCs的动态扩增培养
称取0.08 g/瓶(1 mg/mL,80 mL培养体系)的Cytodex3加PBS室温水合过夜。次日用PBS清洗2次,120 ℃高压蒸汽灭菌50 min,冷却后加至40 mL培养液于37 ℃培养箱中孵育2 h。将mESCs以1×105mL-1的密度接至转瓶中培养,搅拌转速为30 r/min,每隔27 min搅拌3 min,持续8 h以促进细胞贴壁。接种24 h后补加培养液至培养体积为80 mL。研究设对照组和实验组,实验组从第2天起每天向培养体系中添加50 μg/mL抗坏血酸,而对照组不添加。从第3天开始两组均每天半量换液。培养过程中每2天均匀吸取1 mL聚集体悬液,用0.25%胰酶溶液消化成单细胞悬液,用血球计数板计数,换算得出1 mL聚集体悬液中的细胞密度,总细胞扩增倍数计算公式:
总细胞扩增倍数=
[1 mL聚集体悬液细胞密度(mL-1)×80 mL]/
[1×105mL-1×80 mL]。
1.2.2 SSEA-1+细胞比例测定
SSEA-1作为mESCs表面特异性抗原,SSEA-1+细胞的比例可反映培养物中mESCs的数量多少。将取得的细胞样品一分为二,抗体稀释液洗2次,一份样品加入10 μL抗鼠PE-SSEA-1抗体(BD)后混匀,另一份不加抗体作为空白对照。置于4 ℃避光孵育30 min后再用抗体稀释液洗2次,离心后加入500 μL抗体保存液保存。标记好的细胞用流式细胞仪(BD FACSAria I)检测,用FlowJo软件分析结果。SSEA-1+细胞比例和SSEA-1+细胞的扩增倍数计算公式:
SSEA-1+细胞比例=
[样本(Q2+Q3)数值-空白对照(Q2+Q3)数值]×100%
SSEA-1+细胞的扩增倍数=
[SSEA-1+细胞比例(%)×总细胞量]/
[接种时SSEA-1+细胞比例(%)×接种时总细胞量]。
1.2.3 碱性磷酸酶染色
细胞内碱性磷酸酶(Alkaline phosphatase,AKP)的活性越高,AKP染色的着色越深,说明细胞干性维持越强。因此,根据AKP染色结果评判mESCs的细胞质量。将细胞样品用4%多聚甲醛室温固定15 min,按照碱性磷酸酶染色试剂盒(Beyotime)要求染色,在光学显微镜下观察并拍照。
1.2.4 OCT-4蛋白免疫荧光染色
OCT-4蛋白是评价细胞是否为ESCs的指标之一。将细胞样品在4%多聚甲醛溶液中固定15 min,0.1% TritonX-100溶液处理10 min。重组人抗OCT-4单克隆抗体(Millipore,1∶ 200)4 ℃孵育过夜,二抗(Millipore)室温孵育2 h,PBS洗涤3次。DAPI染色液(1∶ 1 000)室温复染10 min,PBS洗涤3次。处理好的细胞用荧光显微镜(Nikon ECLIPSE Ti-S)观察并拍照。
1.2.5 RT-PCR
采用RT-PCR进行全能性基因Sox2的mRNA表达水平测定。细胞用Trizol裂解液裂解,提取细胞RNA,反转录成cDNA,用PCR扩增仪(博华生物科技)扩增cDNA溶液:Ⅰ阶段 94 ℃预变性5 min。Ⅱ阶段94 ℃预变性30 s;58 ℃退火30 s,72 ℃延伸30 s,30个循环。Ⅲ阶段72 ℃延伸7 min。Ⅳ阶段4 ℃再延伸10 min。PCR扩增产物用琼脂糖凝胶电泳仪在120 V恒压条件下进行电泳,用凝胶成像系统进行拍照。RT-PCR过程中所用的引物序列详见表1。
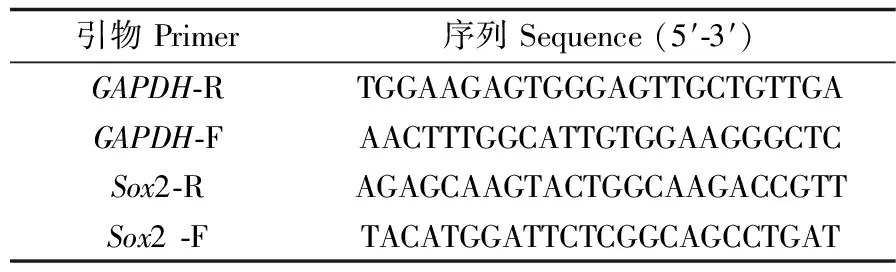
表1 RT-PCR引物序列
1.2.6 SA-β-Gal活性染色(定性检测)
细胞内老化相关的β-半乳糖苷酶(Senescence associated β-galactosidase, SA-β-gal)的活性是反映细胞老化的一个指标。当细胞发生老化,其胞内SA-β-gal的活性上调,可催化β-半乳糖底物生成蓝色的沉积产物。将细胞样品用4%多聚甲醛室温固定15 min,按照SA-β-Gal活性染色试剂盒(GENMED SCIENTIFICS INC.)使用说明书染色,在光学显微镜下观察并拍照。
1.2.7 SA-β-Gal酶活力测定(定量检测)
采用比色法定量测定细胞裂解悬液制备样品中的β-半乳糖苷酶活性,用于评价细胞衰老状况。按照SA-β-Gal定量检测试剂盒(GENMED SCIENTIFICS INC.)使用说明书进行活性测定,计算公式:SA-β-Gal酶活力(IU/cells)=(OD×0.072×V×ρ)/(6×5.5×0.6×t×n),其中,OD为使用分光光度计(Beckman)在570 nm波长处测得的样品吸光度值,0.072为反应体系总体积0.072 mL,V为5×105cells细胞裂解的悬液体积0.05 mL,ρ为使用BCA试剂盒(Beyotime)测定的细胞裂解悬液的蛋白浓度μg/mL,6为测定酶活时取等量蛋白量6 μg,5.5为mmol吸光系数,0.6为所用分光光度计的光径距离,t为反应时间min,n为取样细胞数5×105cells。
1.2.8 细胞内ROS水平测定
使用活性氧检测试剂盒(Beyotime)检测细胞内ROS水平[11],用荧光酶标仪(BioTek)测定吸收波长525 nm处的 OD 值,以此来表征细胞内的ROS水平。
1.2.9 统计学分析

2 结果与分析
2.1 动态培养过程中抗坏血酸对mESCs老化状态和胞内ROS水平的影响
鉴于细胞发生老化时,胞内SA-β-Gal活性明显上升,采用动态微载体悬浮培养体系培养mESCs 10 d,每2天取样定量检测SA-β-Gal酶活力[图1(a)],并对培养8 d的mESCs 胞内SA-β-Gal活性进行定性分析[图1(b)]。从图1(a)中可以看出,对照组从第6天起mESCs胞内SA-β-Gal酶活力与0 d相比有显著上升(P<0.05),而实验组培养到第10天时胞内的SA-β-Gal酶活力才出现显著上升(P<0.05);同时,在培养6~10 d时实验组的SA-β-Gal酶活力均低于对照组。此外,从图1(b)中也可以看出,当培养进行到第8天时,实验组细胞染色呈蓝色的细胞明显少于对照组。可见,添加抗坏血酸延缓了培养过程中细胞发生老化的时间。

(a)mESCs单位细胞内SA-β-Gal酶活力测定(与0 d比较,*P<0.05,**P<0.01);(b)mESCs的SA-β-Gal活性染色(100×,8 d)
进一步检测培养6~10 d期间mESCs胞内ROS水平,结果见图2。从图2中可以看出,实验组mESCs胞内ROS水平均低于对照组,两组之间8~9 d时呈现显著性差异(P<0.05)。可见,添加抗坏血酸后显著降低了培养过程中mESCs胞内ROS水平。

*表示和对照组比较P<0.05
2.2 动态培养过程中抗坏血酸对mESCs扩增特性的影响
mESCs在动态培养过程中细胞的扩增情况如图3所示。从图3(a)中可以看出,培养第6天时实验组的总细胞扩增倍数与对照组有显著差异(P<0.05),而在第8天时,两组的细胞扩增倍数之间呈现极显著差异,实验组细胞最大扩增倍数为53.9±1.5,极显著高于对照组的41.3±0.9(P<0.01)。从图3(b)细胞形态观察中也发现,培养第8天时实验组中空载微载体数量少,且微载体上细胞量要多于对照组,而到第10天时,两组均出现了聚集体涣散的情况。可见,添加抗坏血酸促进了mESCs在动态培养条件下的扩增。
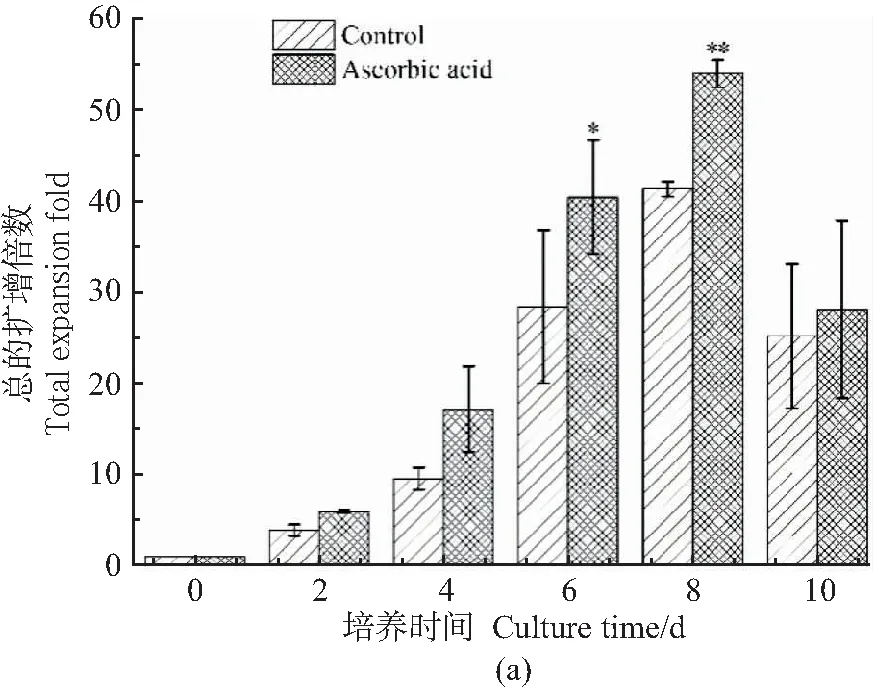
(a)mESCs的扩增倍数(与对照组比较,*P<0.05,**P<0.01);(b)mESCs形态镜检视野(100×)
培养过程中,进一步采用流式细胞术检测培养物中SSEA-1+细胞比例的变化[图4(a)、(b)],并计算其扩增倍数[图4(c)]。从图4(b)中可以看出,实验组和对照组之间的SSEA-1+细胞比例没有显著差异;从图4(c)中可以看出,培养到第8 天时实验组的SSEA-1+细胞扩增倍数可达到51.9±6.3,极显著高于对照组的40.1±3.9(P<0.01)。说明添加抗坏血酸有利于促进SSEA-1+细胞的扩增。

(a)SSEA-1+细胞比例流式分析图;(b)SSEA-1+细胞比例;(c)SSEA-1+细胞扩增倍数(和对照组比较,*P<0.05,**P<0.01)
为了评价扩增后mESCs的全能性,对培养后的细胞进行AKP活性、OCT-4蛋白免疫荧光染色及Sox2转录因子表达的全能性指标检测。从结果(图5)可以看出,实验组及对照组所培养细胞的AKP染色均呈现深紫红色[图5(a)],为AKP高活性;且OCT-4均呈阳性表达[图5(b)],说明所培养的细胞仍具有mESCs的标志。进一步检测培养所获得细胞中mESCs特异性表达的核内转录因子Sox2的表达水平,从图5(c)的RT-PCR凝胶电泳图可以看出两组培养获得的细胞中Sox2均呈阳性表达,两组细胞Sox2的条带面积均和看家基因GAPDH的相比形成半定量分析图[图5(e)],实验组Sox2相对表达量和对照组的相比[图5(d)]落在0.5~2.0倍线之间,无显著差异。可见,两种条件下培养所获得的细胞均保有mESCs全能性标记。
3 讨论
当细胞发生老化时,溶酶体膨胀、增多,位于溶酶体中的β-半乳糖苷酶随之增多[12],因此测定SA-β-Gal活性来表征mESCs老化情况[图1(a)、(b)]。在动态培养体系中添加抗酸血酸后,培养过程中胞内SA-β-Gal酶活力显著升高的时间从培养6 d延迟到了10 d[图1(a)],表明抗坏血酸延缓了细胞出现老化的时间。通过对培养过程中胞内ROS水平的测定发现,在培养6~10 d实验组胞内ROS水平均低于对照组,两组之间在培养8~9 d时呈显著性差异(图2),表明添加抗坏血酸后,显著降低了胞内ROS水平。这与目前文献[13-16]所报道的抗坏血酸具有调节ROS水平的作用一致。鉴于细胞老化发生原因之一普遍被认为是自由基损伤所导致[5-6],因此,结果提示培养过程中细胞老化状态与细胞内ROS水平之间存在对应联系。
从图3(b)的动态培养的mESCs的扩增效果看,添加抗坏血酸后培养体系中空载微载体的数量减少;由图3(a)可知,培养到8 d时实验组mESCs的扩增倍数可达53.9±1.5,显著高于对照组的41.3±0.9。同时,实验组和对照组之间mESCs表面特异性抗原SSEA-1+细胞的比例没有显著差别[图4(b)],培养8 d时实验组的SSEA-1+细胞扩增倍数可达51.9±6.3,显著高于对照组的40.1±3.9[图4(c)]。从mESCs的干性指标分析结果可以看出,两种条件下培养所获得细胞均保有mESCs全能性标记[图5(a)至(e)]。可见,添加抗坏血酸有利于mESCs的体外扩增。

(a)mESCs内AKP染色镜检视野(100×,8 d);(b)mESCs内OCT-4蛋白的免疫荧光染色镜检视野(100×,8 d);(c)mESCs中Sox2基因的RT-PCR凝胶电泳视野;(d)mESCs中Sox2基因的相对表达量(和对照组相比);(e)mESCs中Sox2基因的半定量分析(与GAPDH相比)
在动态培养体系中,通过在培养过程中不断向培养液添加抗坏血酸,可显著降低胞内ROS水平,明显改善mESCs老化状态,进而促进mESCs的体外扩增。研究结果为解决胚胎干细胞规模化培养过程中细胞老化问题提供了一种解决思路。
