人类胚胎干细胞分化与功能研究进展
2021-06-23董一港
董 毅,董一港
(1.华东师范大学 青少年健康评价与运动干预教育部重点实验室,上海 200241;2.华东师范大学 体育与健康学院,上海 200241)
2017年,中国科学院北京动物研究所周琪院士领衔的科研人员与郑州大学第一附属医院外科医生将400 万个人类胚胎干细胞(human embryonic stem cell,hESC)衍生的未成熟神经元(神经前体细胞)注入帕金森病(PD)患者的大脑,标志着国内外使用hESC治疗帕金森病临床试验的开始,这也是干细胞应用领域的又一次突破性进展[1]。人体内具有自我更新能力和分化潜能的细胞群体,称为干细胞(stem cell),它能够产生表现型与基因型和自己完全相同的子细胞,并分化成为机体内各类祖细胞[2]。干细胞有多种分类方式,根据来源不同,可以将其分为胚胎干细胞(embryonic stem cell,ESC)和成体干细胞(adult stem cell)[3]。
胚胎干细胞是指哺乳动物胚胎发育早期的多能性干细胞[4-5],它区别于其他组织特异性干细胞的特征包括在长时间培养过程中可以无限增殖的同时还能保持其正常核型和多能性,后者表现为体外培养的胚胎干细胞在一定条件下,可以分化为3个胚层的任一细胞:内胚层、中胚层和外胚层[6-7]。目前为止,科学家利用不同的方法分离、培养hESCs并取得了一定的成果,在基础研究和临床应用等领域都具有很大的贡献,然而在干细胞诱导分化神经细胞功能方面,仍有大量的问题有待研究。因此在本篇综述中,我们首先简要总结了成功分离、培养和分化为特定细胞系的各种策略,着重从单细胞、突触传递以及神经回路等层面概述hESC诱导分化的神经元在体内及体外研究中的作用。
1 人类胚胎干细胞概述
被公认为人类胚胎干细胞之父以及该领域未来研究预测者的James Thomson,在描述hESC时说:人类胚胎干细胞的发育可塑性使其在基础研究和再生医学领域具有无限的可能。研究发现来源于胚胎的细胞虽然很原始,但却可以表现出自我调节行为:一个着床前的胚胎,如果被切成两半,仍可以单独形成两个不同的胚胎;如果两个处于不同发育阶段的胚胎融合在一起,所产生的单集合胚胎则又会再次正常发育,并包含来自4个不同亲本的遗传信息。这说明这种发育可塑性使胚胎细胞不仅能够在不同的发育阶段混合,而且还保持着正常发育的能力。
实际上从Thomson等[8]1998年第一次成功分离出人类胚胎干细胞之后,人们发现一旦将hESC从胚泡中取出并在特定因子条件下进行诱导,它们就会开始繁殖并分化成各种细胞群。hESC也因其能够无限增殖以及可以分化为全身各类细胞的特性吸引了大量研究者的兴趣。从那时起,有关人类胚胎干细胞如何分离、培养以及分化成各类型细胞的问题成为大家争相攻克的课题。
1.1 人类胚胎干细胞的发现和获得
在卵子受精和二倍体合子形成之后,受精卵经过一系列的卵裂产生了一组称为卵裂球的细胞,这些细胞进一步分裂并重新排列形成囊胚,囊胚由称为胚结的内层细胞和称为滋养层的外层细胞组成[9]。胚结还被称为内细胞团(inner cell mass,ICM),其中的细胞最终可以发育成机体所有组织和器官,因此ICM是胚胎干细胞的最好来源。然而Sherman等在小鼠胚泡早期发育的研究中检测了滋养层细胞的生长、分化以及长期培养过程中内细胞团的增殖状况,但最终并未在体外分化为所有3个胚层[10]。随后几年内,科学家利用已建立的胚胎癌干细胞培养物开发出合适的培养条件并确定了多能胚胎干细胞分离的最佳阶段,从而于1981年成功分离出世界上第一个稳定的小鼠胚胎干细胞系[4-5,11]。基于小鼠胚胎干细胞系的开创性工作,以及Thomson在后来培养非人灵长类胚胎干细胞系的贡献[12-13],最终促成Thomson和Reubinoff成功分离并培养出了人类胚胎干细胞系[8,14]。
hESC的第一个困难和挑战即是如何从人类胚胎中分离出干细胞,hESC通常从着床前或着床周期人类囊胚的ICM中获得。研究人员最初通过机械解剖[15]或免疫外科手术[8,14,16]的方法去除透明带和营养外胚层进而分离出胚胎干细胞。但是免疫外科手术需要使用动物源性产品,如含有豚鼠血清的培养基;而暴露于动物源性产品则可能会导致一些病原体转移到hESC,从而无法获得临床级的hESC系[17]。因此,使用机械压力或酶分离ICM与营养外胚层,可以避免ICM与动物产品在衍生过程中的接触,有利于之后的研究和应用[15,18]。随着研究的深入,科学家还开发出其他分离hESC的方法,如Turetsky等[19]通过使用激光束在透明带上形成一个开口从而分离胚胎干细胞,这说明激光辅助显微操作的方法也是ICM无异种分离中最有前途的技术之一[19-20]。
然而ICM的分离会导致胚胎被破坏,这引起了严重的伦理和政治问题[21]。为了解决这个问题,许多研究者致力于从胚胎发育的早期阶段分离出细胞。Chung和 Klimanskaya等[22-23]在胚胎着床前的基因检测期间,从患者体内获得携带单卵裂球的胚胎活检,并且成功从单卵裂球活检中获得5个hESC系。来自单卵裂球的hESCs由于不会妨碍剩余卵裂球形成正常胚胎的能力避开了伦理争议。同样,由于既没有产生胚胎也没有破坏胚胎,通过人工授精产生的孤雌生殖胚胎,也已经成为hESC理想的来源[24-26]。近年来,还有研究者尝试利用体细胞核移植技术(SCNT)获得hESC,如Chung等[27]将2名健康的35岁和75岁男性的皮肤成纤维细胞转移到预先去除细胞核的卵母细胞内,使体细胞重编程为干细胞。到目前为止,世界范围内的科学家们已经使用各种方法从不同的胚胎来源中获得并建立了数百个hESC株系,这些hESC现已应用于基础和临床研究。
1.2 人类胚胎干细胞的培养
hESC通常可以采用动物源性血清或血清替代物在小鼠胚胎成纤维细胞制成的饲养层细胞上培养[8,14]。有研究证明添加无血清培养基和成纤维细胞生长因子(bFGF)亦可增强hESC的增殖并防止hESC发生分化[28];近些年来研究人员还通过控制细胞代谢在本质上调节干细胞的分子特征,影响干细胞的增殖和分化[29]。尽管培养的方法有很多,但是一个合格hESC培养基的最基本条件即是在促进hESC无限分裂增殖的同时维持hESC的未分化状态。接下来将简要概述用于改善hESC产生数量和质量的各种培养条件。
1.2.1 动物源饲养层培养体系
饲养层培养体系是ESC体外培养建系中最常用的一种技术方法。目前最常用的饲养层是小鼠胚胎成纤维细胞(MEF),它被认为是hESC培养过程中重要的成分。MEF可以促进hESC的生长和扩增,并且MEF分泌的生长因子和细胞因子对干细胞维持多能性也是必需的[8,14]。制备饲养层需要在MEF中加入胎牛血清,然而伴随着hESC与MEF和动物血清的接触,一系列健康问题也随之而来:Cobo等[30]研究发现,MEF细胞中存在能够感染hESC的病毒颗粒;Llewelyn等[31]在使用牛血清培养hESC时,发现动物源性血清可能在培养过程中传播朊病毒或其他动物病毒。还有报道称,基于动物的细胞和血清可以在体外培养过程中通过细胞间的相互作用将病毒或其他病原体传播到胚胎干细胞中[32-33]。因此,使用含有动物细胞或血清的培养基可能会将动物来源的感染性病原体传播给hESC,从而可能给患者带来巨大危险。
1.2.2 非动物源饲养层培养体系
为了避免病毒传播和跨物种污染,研究人员开发出不含动物成分同时可以支持hESC生长和扩增的培养基。研究发现使用人类细胞制成的饲养层也可以产生碱性成纤维细胞生长因子(bFGF)、转化生长因子-β(TGF-β)和激活素A,进而促进hESC的增殖并维持其多能性,因此可用于hESC的培养[34-35]。如Cho等[36]在实验中曾使用脐带基质细胞制成的饲养层系统成功培养了hESC;Gao等[37]也通过实验证明了子宫内膜细胞在hESC生长和分化方面比小鼠胚胎成纤维细胞具有更好的作用。此外人类输卵管细胞[38]、胎儿包皮[39]、骨髓[40]以及胎盘细胞等[37]也可在培养hESC的过程中发挥重要作用。上述事实都证明了可以使用非动物饲养细胞培养基培养hESC,但其依然存在许多诸如使用包皮、胎儿或骨髓来源的饲养层引发的伦理限制以及由于饲养细胞群之间的差异太大,使得饲养层的维持非常困难,在实际操作过程中耗时费力等问题。
1.2.3 无饲养层培养体系
由于动物和人类饲养细胞都具有局限性,越来越多的实验室在培养hESCs时选择使用无饲养层的化学培养基。研究者将细胞外基质蛋白或重组蛋白以及生长因子(包括激活素A、bFGF以及TGF-β1等)加入到化学培养基中,从而为干细胞创造体外培养条件[41-42]。在这些蛋白质中,最常用的方法是将Matrigel(基底膜基质)与生长因子或条件培养基联合使用以培养hESC[43];除Matrigel外,Fu等[44]还将纤维连接蛋白、层粘连蛋白和IV型胶原蛋白用于hESC的无异种培养中。毫无疑问,化学培养基与蛋白质的使用显著改善了hESC的培养条件。
1.2.4 3D培养体系
在培养hESC时,其细胞间的相互作用以及旁分泌或自分泌信号在维持hESC的未分化状态中也起着重要作用,因此通过将hESC包封在特定尺寸的支架中以控制可扩展培养物中细胞间相互作用的方法越来越受关注。Nur-E-Kamal等[45]曾使用合成聚酰胺基质支架模拟基底膜的纤维网络培养hESC,发现这样的培养体系通过激活小GTP酶Rac以及磷酸肌醇3-激酶(PI3K)途径增加了hESC的增殖能力;Gerecht等[46]使用透明质酸(HA)水凝胶组成的基质来培养hESC,通过外部刺激对水凝胶的结构进行修饰从而操纵生物活性分子的时间和空间可用性。此外,Yim等[47]也通过实验证明,hESC在3D培养中通过加强细胞间相互作用使增殖能力得以提高,说明与二维培养(2D)相比,三维(3D)培养更接近hESC在体内的生存环境,从而更利于培养[48]。
1.3 人类胚胎干细胞的特性及测定
hESC具有两大特性:(1)高度的分化潜能(pluripotency)。hESC可以在细胞培养的任何阶段分化为3个胚胎生殖层中的任何一个[14,49]。(2)自我更新能力(self-renew)。hESC能够在维持多能性的同时不断增殖,因此可在体外培养条件下建立稳定的细胞系。
1.3.1 hESC的形态特征和分子标记
形态学上,hESC可在培养基中形成致密的球形细胞集落,集落内的单个hESC则表现出高核质比和大核仁的特点,说明在hESC增殖过程中,转录和蛋白质合成非常活跃(图1)。hESC的特征还在于能够表达许多细胞表面标志物和转录因子,包括阶段特异性胚胎抗原-4(SSEA-4)、SSEA-3、畸胎瘤衍生生长因子1(TDGF1)、生长分化因子3(GDF3)、TRA抗原、Oct3/4以及Nanog等[50-53]。这使研究人员能够在体内外监测hESC的分化和发育行为。
在hESC的各种标记中,OCT4(也称OCT3或OCT3/4)在早期胚胎细胞的维持和交流方面的作用是独一无二的:OCT4是早期胚胎细胞中特有表达的一种定向转录因子,由Pou5f1基因编码,可以在维持内细胞团细胞增殖的同时抑制细胞分化[52,54-55]。Wang等[56]发现与OCT4共同作用的还有SOX2和NANOG:OCT4可以和SOX2在sox-oct原件处形成一个复合体共同发挥作用;而NANOG则能够通过与OCT4和SOX2各自的基因Pou5f1和Sox2相互作用来维持OCT4和SOX2的表达[56]。除OCT4外,Qi等[57]在将外源性BMP4导入BMP4缺失的胚胎干细胞后发现细胞外受体激酶(ERK)和p38有丝分裂激活蛋白激酶(MAPK)活性都显著降低,说明BMP4可以通过抑制ERK和MAPK诱导与细胞分裂以及细胞分化有关的有丝分裂原和生长因子(如LIF、FGF和BMP)的下游信号传导,进而协助维持hESC的多能性和自我更新能力[57]。另外,转化TGFβ通路的成员LEFTY1、LEFTY2以及GDF3也可以在多能干细胞中表达[58]。
1.3.2 hESC多能性的测定
hESC的多能性可以通过建立相应的体内和体外技术进行检测。到目前为止,在体内检测hESC最常用的方法是将未分化的hESC移植到免疫缺陷小鼠体内,检测其是否会形成畸胎瘤[14,59-60];畸胎瘤是由3个胚层组织构成的一种良性肿瘤,对植入hESC从而形成畸胎瘤的分析是用来确定其分化潜能的金标准。此外,还有学者提出了体外检测胚状体(EB)的方法:EB是不黏附的hESCs的球形聚集体[图1(b)],包含所有3个胚胎生殖层的细胞群;研究人员首先在体外培养hESCs,使其分化为胚状体(EB),随后对其进行免疫细胞化学分析,或通过RT-PCR检测与3个胚层相关基因的表达情况从而确定hESC分化为各种细胞类型的能力。

(a)在小鼠胚胎成纤维细胞培养基中培养的hESC的紧密集落;(b)诱导分化后3 d的EB;(c)将EB铺在涂有明胶的培养皿上48 h后出现分化组织
2 人类胚胎干细胞功能
2.1 hESC在疾病研究和应用中的功能
人类胚胎干细胞可以在适当的培养条件下先分化成3个胚层继而分化成体内各种细胞,如胰岛细胞、肝细胞、肺泡细胞、心肌细胞、血细胞以及神经细胞等;hESCs的这种多谱系潜力为治疗众多退行性疾病提供了新思路。
2.1.1 hESC诱导分化的内胚层细胞
内胚层衍生物主要包括在肺、肝、胰腺、膀胱、甲状腺及消化系统中的各类细胞。产生内胚层细胞的首要步骤是形成定形内胚层,D’Amour等[62-63]在实验中发现,在低血清条件下,可以通过添加高浓度的激活素A和Wnt3a,以阶段特异性的方式将hESC选择性诱导分化为定形内胚层。定性内胚层形成后,进而分化为特定的祖细胞群,如胰岛β细胞[64]、肺泡上皮细胞和肝细胞等,并在临床上用于开发糖尿病、肺部疾病和急性肝衰竭/肝炎等疾病的细胞替代疗法。
Kroon等[65]成功获得了hESC诱导分化的胰岛祖细胞,他们把hESC依次暴露于激活素A和Wnt3a中,然后添加角质细胞生长因子或FGF7以诱导原肠管形成;随后,向培养基中加入视黄酸和Noggin以抑制Shh和TGFβ信号通路,进而诱导分化为胰岛细胞祖细胞的来源——前肠后端(posterior foregut)细胞;最后再将这些细胞进一步培养以产生胰腺内胚层细胞。Kroon等[65]将得到的细胞移植到免疫缺陷小鼠体内,发现它们能够表现出胰岛β细胞的组织学结构特征,并具有产生胰岛素的能力。在最近的研究中,Nair等[66]还发现通过分离和重新聚集未成熟的β细胞可以生成β细胞样细胞簇(enriched β-clusters,eBC)从而在体外获得功能性胰岛β细胞,在治疗糖尿病方面取得了重大进展。
以类似的方式,在hESC分化成定形内胚层后还可以进一步诱导分化为肝细胞[67]。Agarwal等[68]在实验中发现,将胶原蛋白I基质和肝分化因子(包括FGF4、BMP4、肝细胞生长因子和地塞米松)依次添加到低血清培养基中,可以产生高度稳定的功能性肝细胞群,这些细胞能够表达已知的成熟肝细胞特征标志物,并发挥相应的功能;在最新的研究中,Feng等[69]在体外构建了一种可扩展的无血清悬浮培养系统,该系统能够通过使用人内胚层干细胞作为前体,大规模产生功能性可移植肝细胞,极大程度上满足了肝细胞不断增长的治疗和药物需求。
hESC分化的另一个目标是肺泡上皮细胞,这些细胞可用于肺部慢性呼吸系统疾病的研究和治疗。Wang等[70-71]使用表面活性蛋白C启动子控制的新霉素转基因非病毒转染hESC,并获得了几乎纯净的肺泡上皮细胞,在hESC诱导分化为肺泡上皮细胞群方面取得了显著成功;此外,Strikoudis等[72]在体外使用hESC产生的肺类器官模拟肺纤维化并探究了肺纤维化的发病机制,这为探究纤维化肺病的治疗方法提供了理论依据。
2.1.2 hESC诱导分化的中胚层细胞
中胚层衍生的细胞已经成功被科学家获得,研究发现hESC直接诱导分化为中胚层需要激活TGFβ信号传导通路,而这需要通过逐步添加激活素A、BMP4和生长因子(如血管内皮生长因子和bFGF等)得以实现[73]。还有研究发现可以使hESC首先自发分化为EB进而获得各种中胚层衍生物:随着EB的形成,研究人员在无血清条件下实现了hESC向造血谱系细胞的有效分化,其可产生几乎所有类型的血细胞和免疫细胞[74]。Chadwick等[75]提出通过在无血清培养基中添加白介素3、白介素6以及BMP4等细胞因子可以促进EB形成后hESC分化为造血细胞;Montel-Hagen及其同事也开发了一种用于诱导干细胞衍生的中胚层分化为幼稚T细胞的3D类器官系统,研究发现通过该方法得到的T细胞在体内外均可显现出抗肿瘤效果[76]。因此,hESC分化的造血谱系细胞有望改善需要血细胞移植的现有疗法并通过细胞移植的方法治疗免疫缺陷等疾病。
另一种中胚层衍生物心肌细胞已经可以通过一些方法从hESC分化而来[77]。Laflamme等[78]研究发现,使用激活素A和BMP4处理致密单层hESCs,可以使其定向分化为心肌细胞;更重要的是当研究人员将这些细胞移植到心脏受损的大鼠体内后,其可形成功能性心肌细胞并改善受损心脏的功能。另一项研究则使用了额外的培养基补充剂(如VEGF、DKK1以及bFGF等),以促进EB向心肌细胞的分化[79]。随着研究的深入,Bargehr等[80]还测试了hESC分化的心外膜细胞在体外增强心脏组织结构和功能的能力,他们发现如果将hESC分化的心外膜细胞和心肌细胞共同移植至动物体内,心肌细胞的增殖速率加倍,心脏移植物尺寸增加,收缩功能也能够得到有效改善,从而更加有助于心脏病患者的治疗。
上文提到将hESC移植到小鼠体内可能会形成畸胎瘤,研究人员从中得到启示,认为hESC也可以是结缔组织(骨和软骨等)替代疗法的有效细胞来源。研究人员利用3D培养系统将hESC和BMP2在高密度环境下共同培养从而诱导分化为软骨细胞[81];Wang等[82]也通过实验证明了当使用无血清培养基诱导hESC产生软骨细胞时,用BMP2替代BMP4能够使软骨形成基因SOX5的表达增加并且更好地驱动hESC分化为软骨细胞,增强软骨细胞聚集体的形成。通过定向培养hESC所得到的这些细胞可用于治疗关节中软骨破坏或骨密度低下所导致的骨质疏松症和骨关节炎等疾病。
2.1.3 hESC诱导分化的外胚层细胞
在hESCs的培养中,最主要的分化途径是形成外胚层进而分化为各种神经元或神经胶质细胞以及视网膜色素上皮(retinal pigment epithelium,RPE)细胞等。研究发现,hESC可以被诱导分化为感觉神经元[83]、多巴胺能神经元[84]、GABA能神经元[85]、胆碱能神经元[86]、运动神经元[87]以及少突胶质细胞[88]等众多神经系统组分并参与各种神经退行性疾病的治疗(表1)。

表1 hESC分化的神经细胞类型及临床功能
在得到第一个hESC株系后不久,Reubinoff等[14]在体外高密度培养4~7周的hESCs中发现了可扩增的神经前体细胞(neural precursor cell,NPC)。研究人员将其放置于无血清培养基中作为神经球体扩增,然后通过把球体铺在涂有聚-D-赖氨酸和层粘连蛋白的盖玻片上成功实现了神经诱导。结果显示:培养基中出现了表达神经元标记物β-微管蛋白和MAP2的细胞;Reubinoff及其同事还通过添加B27补充剂、人重组表皮因子EGF和bFGF来促进NPC的扩增,而扩增的NPC能够在体外以及移植到小鼠体内后分化为主要的神经谱系——神经元、星形胶质细胞和少突胶质细胞[91]。与此同时,Zhang等[92]使用了一种不同的方法将hESC诱导分化为NPC,在该研究中,研究人员使用胰岛素、转铁蛋白、孕酮、肝素和bFGF共同处理EB,使其在培养基中形成单层管状玫瑰花样神经结构,随后使用分散酶进行酶处理分离得到NPC;与Reubinoff的研究结果类似,产生的NPC也能够在体内体外形成少突胶质细胞、星形胶质细胞和成熟神经元。这些结果都证实了hESC衍生的NPC的分化潜能,这些细胞为将来可能用于治疗多种中枢神经系统疾病的不同神经元表型的选择性分化奠定了基础。
神经玫瑰花结(neural rosettes)是NPC能够分化成各种神经细胞的重要标志,因此多项研究都探索了增强神经玫瑰花结形成的方法,以产生更多类型的神经细胞。有研究报道,通过使用基质细胞系培养hESC即可为其提供神经诱导所需的外胚层信号因子,进而促进神经玫瑰花结的形成[93-94]。当神经玫瑰花结产生后,添加FGF2、EGF以及其他细胞因子可以使它分化为特定的神经亚型。例如:来源于神经玫瑰花结的神经嵴干细胞可以通过添加BDNF、GDNF和dbcAMP,或在CNTF、neuregulin 1β和dbcAMP共同培养的条件下分化为周围交感神经和感觉神经元[95]。Li等[87]获得了第一例hESC衍生的运动神经元(motoneurons,MNs),他们使用先前描述的方法生成NPC之后,通过向培养基中添加视黄酸以诱导其分化为MNs,Shh则促进了有丝分裂后运动神经元的进一步成熟。随着研究的深入,Du等[96]开发出了一种在短时间内获取高纯度成熟MNs的方法,他们首先使用调节多种信号通路的小分子组合,将hESC诱导分化为高纯度的运动神经元祖细胞,随后利用NOTCH抑制剂Cpd E将其引导为功能成熟的MNs富集群体。MNs的获得为脊髓损伤和相关退行性疾病(如ALS等)的细胞替代疗法提供了细胞来源。此外,实验人员在对ALS疾病模型的研究中还发现非神经元细胞,如少突胶质细胞和施旺细胞的缺失也是ALS的发病原因之一[97]。因此他们将hESC体外分化为少突胶质细胞并移植至脊髓损伤的大鼠体内,结果显示,移植到体内的少突胶质细胞能够促进运动神经元的髓鞘再生进而恢复其运动功能[88,98]。
除了神经元和神经胶质细胞外,hESCs衍生的外胚层还包括对人类视觉功能有着巨大贡献的RPE细胞。有报道称,RPE细胞能够通过清除并更新视紫红质的光感受器外段来支持神经视网膜,因此RPE细胞的丧失或功能障碍会导致黄斑变性——人类失明的最主要原因之一。为了诱导hESC分化为RPE细胞,Idelson等[99]将其放置于添加烟酰胺和激活素A的无血清培养基中进行诱导,并成功获得了RPE细胞;此后,研究人员将这些细胞转移至黄斑变性的动物模型中,发现它们可以表现出相应的形态和功能特性以发挥挽救视力的作用。
2.2 hESC诱导分化的神经元的功能研究进展
hESCs诱导分化的神经元不仅能够通过移植到患者体内执行功能,也可以在体外的研究中发挥其特性。
2.2.1 hESC诱导分化的神经元功能特性及其移植体内后的作用
(1)5-羟色胺能神经元。位于后脑中缝核的5-羟色胺能神经元在调节脑功能方面起关键作用,它能够参与情绪、认知、饱腹感等多种自主神经功能的调节,且涉及多种精神疾病(如抑郁症等)。因此,为了促进其在体内外的研究,越来越多的科学家致力于将hESC诱导分化为5-羟色胺能神经元。Lu等[100]描述了一种通过激活WNT和Shh信号通路诱导hESC分化为5-羟色胺能神经元的方法,他们首先将hESC放置于含有SB431542(TGF-β抑制剂)、DMH1(BMP抑制剂)和CHIR99021(GSK3-β抑制剂)的SDC培养基中使其分化成为后脑神经干细胞;随后用Shh和FGF4共同处理培养物使其腹侧化并获得5-羟色胺能神经元祖细胞。
研究人员进一步确定细胞的分化潜能,发现得到的神经元能够释放5-羟色胺,且其他标志物(包括FEV、SERT和LMX 1β)的表达均上调,这标志着中枢5-羟色胺能神经元的成功分化。为了评估神经元的功能是否成熟,研究人员在细胞培养第6周使用了电生理全细胞记录对15个神经元进行了测试。实验结果印证了5-羟色胺能神经元的电生理特征:通过从-40 pA到+100 pA的电流注入可以触发其动作电位,且当注入电流低至+10 pA时还能够诱发频率与注入电流大小正相关的动作电位;在记录的神经元中,80%都出现了兴奋性(向下)及抑制性(向上)突触后自发电流,这表明其能够与周围神经元形成功能性突触网络。此外,5-羟色胺能神经元还显示出自发动作电位尖峰低,具有亚阈值振荡电位,且神经元在大动作电位和超极化后,超极化持续时间长的特性[100][图2(a)]。
(2)胆碱能神经元。有关hESC分化为胆碱能神经元(BFCN)的研究有助于探索与学习记忆障碍相关疾病(如AD)的发病机制和细胞治疗。Liu等[101]使用了一种新的策略。他们首先将hESC在体外分化为原始神经上皮细胞,随后在培养基中加入Shh并持续培养一周,从而引导其生成内侧神经节隆起(MGE)祖细胞。在这个过程中,FOXG1表达的增加是MGE祖细胞成功分化的重要标志;在获得MGE祖细胞后,研究人员将它们铺在hESC衍生的星形胶质细胞上并加入神经生长因子、cAMP及BDNF共同培养,一段时间后,所有神经元均表达乙酰胆碱转移酶(ChAT)、NKX2.1、以及囊泡乙酰胆碱转运蛋白(VAChT),标志着成熟BFCN的产生。
研究人员使用全细胞膜片钳记录了分化8~10周的神经元以确定其电生理特性,结果显示神经元在+20 pA至+80 pA电流注入下能够诱导动作电位,并且除了具有正常的膜特性外,还具有内向Na+和外向K+电流以及能够观察到自发突触电流的特征[图2(b)]。
为了探究hESC衍生的神经元在体内能否发挥功能及其机制,Liu的实验团队将分化的MGE样祖细胞移植至学习和记忆丧失的小鼠模型体内,发现移植后的第一周,ChAT+胆碱能神经元很少被发现,然而随着时间的推移,这些神经元在CA3区域的锥体细胞层中的数量和细胞大小显著增加,且能够表达胆碱能标记物:VAChT和人特异性突触素等,这表明移植的胆碱能神经元能够和小鼠锥体神经元之间形成突触接触并发挥作用;研究人员进一步通过行为学实验发现,在移植了hESC衍生的神经元两个月后,损伤模型小鼠在识别隐藏平台方面开始表现出减少的潜伏期并且具有更好的表现[101]。这说明hESCs诱导分化的胆碱能神经元具有改善学习、记忆和空间认知缺陷的功能。
(3)谷氨酸能神经元。谷氨酸能神经元是中枢神经系统内最重要的兴奋性神经元,能够调控许多诸如睡眠和摄食等重要的人类活动。Li等[102]使用hESC在体外诱导分化为谷氨酸能神经元并探究了该亚型神经元的功能特性。首先在没有外源形态发生素的条件下通过添加RA将hESC分化为具有背侧同一性的端脑祖细胞,接着加入WNT3A培养基以确定它们的背侧表型(GLI3的高水平表达),最后将这些细胞铺在Neurobasal培养基中进而分化为谷氨酸能神经元。
在对获得的谷氨酸能神经元进行蛋白质印迹分析后发现,分化6周的神经元能够表达谷氨酸能转录因子TBR1和CTIP2;且随着时间的推移,在这些神经元中可以观察到成熟谷氨酸能神经元标志物——囊泡谷氨酸转运蛋白1(VGLUT1)的表达。随后,研究人员还通过分化后10~12周的膜片钳记录分析了hESC产生的谷氨酸能神经元的功能特征,结果显示谷氨酸能神经元在电流注入后能够以较大的幅度和较短的持续时间激发强烈的动作电位[图2(c)ⅲ],并且在分化第10周神经元的记录中还偶尔观察到了第二个动作电位;此外,在电压钳模式中还记录到了内向Na+和向外的K+电流,且内向电流可被1 μmol/L的河豚毒素阻断[102-103][图2(c)ⅰ,ⅱ]。
(4)γ-氨基丁酸能(GABA)神经元。GABA能神经元是人脑内最常见的中间神经元,其通过释放抑制性神经递质γ-氨基丁酸调节多种脑内活动,具有同BFCN相似的功能,可以用于改善与学习和认知障碍相关的疾病。基底前脑神经元,包括BFCN和GABA中间神经元,起源于端脑腹侧部分的MGE和视前区(POa),因此将hESC诱导分化为GABA能神经元的最初步骤与BFCN相同[101]。Liu等[101]在培养基中添加Shh从而使hESC分化为NKX2.1+的POa祖细胞,随后将其铺在星形胶质细胞上并加入神经生长因子持续培养一段时间,即分化为成熟的GABA能中间神经元。
研究发现,GABA能神经元能够释放GABA且表达DARPP32(投射GABA能神经元的标记物)和GAD65(GABA能神经元的另一种标记),因此这可以作为hESC成功分化为GABA能神经元的重要标志。在另一项研究当中,研究人员使用电生理膜片钳技术揭示了GABA能神经元的电生理活性:具有自发的动作电位[图2(d)ⅰ],通常显示为“bursting”模式,且当使用荷包牡丹碱时,GABA受体活性被消除,突触活动被阻断;此外,与谷氨酸能神经元相比,GABA能神经元具有更窄的峰值和更尖锐的复极化的特点[101,103][图2(d)ⅱ]。
在体外实验基础的上,Liu等[101]将神经祖细胞移植到内侧隔膜损伤进而导致海马GABA能神经元去神经支配的小鼠体内6个月后,发现小鼠体内分化的神经元群体主要为GABA能神经元,且这些神经元被细胞体和纤维中的vGLU+斑点包围,表明移植体内的GABA能神经元与潜在的谷氨酸能神经元建立了联系并被整合到了局部神经回路中。与此同时,在评估神经元移植前后小鼠的学习记忆能力的实验中,研究人员证实,移植的GABA能神经元能够改善小鼠的学习能力,有助于功能恢复。
(5)多巴胺能神经元。hESC衍生的中脑多巴胺能(DA)神经元能够为PD的细胞替代疗法提供无限细胞来源。Kawasaki等[105]发现某些小鼠基质细胞系具有促进小鼠ESC神经发生的能力,进而诱导其分化为中脑多巴胺能(DA)神经元。除了经过充分研究的常规DA神经元外,Lammel等[104]还在实验中发现了DA神经元的非典型快速放电亚型,两种神经元具有不同的分子和功能特性。他们将干细胞诱导分化为DA神经元,随后对神经元进行免疫组化鉴定,发现所有细胞都能够表达重要的DA标记基因酪氨酸羟化酶(TH)和质膜多巴胺转运蛋白(DAT),而快速放电亚型的DA神经元却对DAT的表达非常低。研究人员利用全细胞和穿孔膜片钳技术记录了体外脑切片从而确定这两种不同DA神经元的基本电生理特性。研究发现,在电流钳模式下,纹状体DA神经元具有缓慢的规则放电、典型的低阈值、宽动作电位(AP)和显著的后超极化(AHP)等特点[图 2(e)ⅰ];而皮层DA神经元相较于传统的纹状体DA神经元,则表现出更快的自发放电频率、更长的AP持续时间以及没有AHP的宽AP波形和下垂组件的特性[图2(e)ⅱ]。
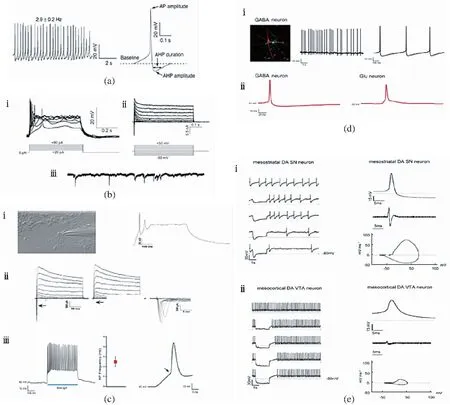
(a)用电生理学测定5-羟色胺能神经元(左图神经元自发动作电位尖峰低;右图神经元在AP和AHP后,AHP的持续时间较长)。(b)胆碱能神经元的电生理特性(ⅰ通过电流注入诱导的动作电位;ⅱ在电压阶跃下触发的内向和外向电流;ⅲ记录到的自发突触电流)。(c)谷氨酸能神经元的电生理特性[ⅰ在神经元中注射20 pA电流时引发动作电位;ⅱ电压阶跃(-50 mV至50 mV)会引发内向和外向电流,且1 μmol/L河豚毒素能够消除Na+电流(箭头);ⅲ左图在2 s、470 nm光刺激期间细胞的电流钳记录;中图AP的平均频率(n=7);右图电流钳记录通过清晰的阈值偏转(箭头)显示了动作电位的存在]。(d)GABA能神经元的特性[ⅰ左图GABA能神经元的神经生物素染色(红色);中、右图神经元中的自发动作电位;ⅱ GABA能神经元与谷氨酸能神经元动作电位的差异]。(e)两种不同功能表型的中脑多巴胺能神经元的电生理特性[ⅰ左图电流钳模式下,纹状体DA神经元放电缓慢有序且具有明显的后超极化;右图典型的AP波形及其相位图(mVms-1/mV);ⅱ左图电流钳模式下,皮层DA神经元快速放电且无AHP;右图显示了没有AHP的宽AP波形,且与ⅰ相比幅度较小以及具有较小最大去极化和复极化速度的AP的相位图(mVms-1/mV)]
在最新研究中,Chen等[106]将经过编程表达DREADDs系统(designer receptors exclusively activated by designer drugs,只由特定药物激活的受体)的DA神经元前体细胞移植到PD模型小鼠的纹状体内,通过特定激活该系统的药物CNO控制所移植细胞的激活,进而可以规避由于移植数量不可控所造成的功能影响(图3)。在此研究的基础上,Xiong等[107]进一步将hESC分化的DA神经前体细胞移植到PD小鼠受损的黑质脑区,结果发现移植的DA神经元能够长出大量神经纤维并与纹状体细胞形成神经连接,其重建的黑质-纹状体神经连接在结构和功能上都与内源神经连接高度一致,从而有助于对PD的治疗作用。
图3 可控hESCs诱导分化的DA能神经元移植
2.2.2 hESC诱导分化的神经元在体外研究中的功能
(1)单细胞层面。hESC衍生的神经元还可以作为各种体外研究的原材料以发挥其功能,如确定某种神经元的功能特性从而加强对它们的认识、探讨某些因子对神经细胞的作用和机制以及研究神经元和神经网络的关系以探究人类大脑早期发育过程等。
hESCs分化的各种神经元能够为体外确定某种因子或病毒对机体影响的研究提供便捷的工具。研究发现,双酚A(BPA)由于能通过血脑屏障,与多种神经退行性疾病有关;科学家利用hESC衍生的人皮质神经元,将其在体外与BPA共同培养14 d并检测BPA对神经元形态、细胞内钙稳态以及神经标志物的影响从而评估BPA对人体不利的神经毒性作用及机制[108]。此外,还有研究人员为更深入了解水痘带状疱疹病毒(VZV),在体外比较了hESC衍生的神经元和MRC-5细胞内VZV的感染性、生长特性及病毒形态等,发现神经元被感染性更高,且在研究VZV的发病机理和获得高滴度病毒储备方面更具优势[109]。
hESC诱导分化的各种类型神经元还可在体外被用于确定自身功能特性并优化其分化策略。例如:Young等[83]使用群体和单细胞技术相结合的方法对来自hESC的感觉神经元进行了详细分析,进而确定了这类细胞特殊的功能并由此优化了感觉神经元的分化方案。在实验中研究人员首先对干细胞分化过程中5个时间点的细胞进行了单细胞qPCR,记录其基因表达变化并评估了培养物中细胞的同质性;随后利用膜片钳和药理学等相关技术确定了分化的感觉神经元所表达的离子通道亚单位以及其产生动作电位的性质[83]。实验结果首次证明了体外细胞和人体背根神经节细胞之间的相似性,为疼痛生物学的研究开辟了前景。
除了能够确定神经元的功能之外,研究人员还可以在单个神经元水平上研究hESCs衍生的神经网络中同步活动的出现从而探索早期发育大脑电活动的形成过程。大脑通过电活动执行认知功能,这是由单个神经元之间相互交流产生的,然而异步神经元之间是如何引起神经网络的同步活动却不清楚,hESC的出现使研究人员可以更方便地在体外研究这一过程。Mäkinen等[110]将hESCs衍生的神经元在体外进行培养,在其自发形成神经网络的过程中添加GABA激动剂和拮抗剂等药物,并在单神经元分辨率下用钙成像和微电极阵列(MEAs)测量各神经元活动及其相互间的交流情况,通过比较记录的结果并采用大规模单细胞分析,将单神经元反应与网络反应联系起来;研究人员展示了单细胞分布是如何引起GABA及GABA受体激动剂的网络效应,并证明了最早形式的同步神经元活动是依赖于GABA诱导的去极化减少,而不由内源性GABA介导。
(2)突触传递及神经回路层面。除了能够利用hESC分化的神经元在单细胞层面进行研究之外,本课题组还使用hESC诱导分化的神经元在体外成功模拟了神经皮质回路并应用于研究当中,开创了hESC衍生物在突触传递和神经回路层面的功能突破[103]。
研究发现,学习和记忆是通过改变同时活跃的神经元之间的突触强度而形成的心理活动[111],通过脑片分析可以得出其电生理学基础是长时程增强(LTP)和长时程抑制(LTD),这依赖于突触可塑性[112-113];具体的生理化学过程是通过激活AMPA受体以及突触后的N-甲基-D-天冬氨酸(NMDA)受体,从而导致钙浓度升高以激活蛋白激酶C等细胞内信号级联反应,最终改变突触效应。在以往的研究中,LTP和LTD在手术切除的脑组织中被发现过[114-115],并且也可以通过人类听觉诱发电位的长期增加以及视觉棋盘诱导的视觉诱发电位的快速重复呈现间接被观察到[116-117];然而这是非常少见的现象,很难进行机制研究,并且由于取材的限制,人类脑神经网络实验难以全面深入研究,在体外想要分析人类生理和病理条件下神经可塑性的变化不容易实现。鉴于大量hESC的可用性,课题组利用hESCs诱导分化的神经元在体外设计了一种便捷且通用的模型,用于评估人类神经可塑性。
将hESC在Shh拮抗剂环巴胺的存在下诱导分化为可表达光敏感通道蛋白(ChR2)的谷氨酸能神经元,并与hESC衍生的GABA能神经元在培养基中按照2∶ 1的比例共培养,在体外模拟皮质回路[118](图4)。随后使用蓝光对培养的神经元进行刺激,在蓝光刺激下(2 s,470 nm,0.4 mW/mm2),谷氨酸能神经元产生了强动作电位,且引发内向电流,为使记录的结果完全是通过ChR2所诱导的电流,使用1 μmol/L的河豚毒素处理神经元以消除其他作用电流;接着评估谷氨酸能神经元和GABA能神经元之间的突触相互作用,结果发现相较于光刺激之前,光刺激谷氨酸能神经元可以使GABA能神经元的兴奋性突触后电流(EPSCs)的平均频率显著增加,并且光刺激可以增加突触前谷氨酸能神经元向GABA能神经元释放的谷氨酸数量从而对突触前末端有促进作用。

图4 hESCs分化的谷氨酸能神经元和GABA能神经元在体外共培养[103]
通过光刺激能够调节神经元之间的突触传递,实验中分别使用了重复光照(刺激时间 200 ms)和低频(900脉冲,3 Hz)蓝光刺激表达ChR2的谷氨酸能神经元,并同时记录不表达ChR2的GABA能神经元的eEPSCs。结果显示在使用重复光照刺激谷氨酸能神经元时,GABA能神经元eEPSC的振幅和mEPSC的频率都显著增加;而通过低频光刺激神经元时,EPSCs的幅度和频率则显著下降,表明实验中出现了类似LTP[图5(a)]和LTD[图5(b)]的行为。我们的研究不仅首次发现了构建具有学习记忆功能的人类体外神经网络的方法,还进一步采用光遗传和特殊的光刺激程序创造性地解决了体外神经网络中无法寻找神经回路的难题,为研究人类学习和记忆以及建立电路学习和记忆的计算模型提供了研究平台。

(a)重复光刺激前后GABA能神经元中eEPSC的变化;(b)低频光刺激前后GABA能神经元EPSC的幅度变化
3 hESC的挑战与展望
hESC诱导分化的各种细胞在癌症、帕金森病、阿尔茨海默病及糖尿病等各种疾病的治疗中具有巨大的潜力,并且还能够应用于多种体外研究中,为不同领域提供新的思路和工具。然而这其中依然存在很多问题和挑战:尽管体内体外研究表明,在未来有希望利用hESC治疗多种疾病,但这首先取决于分化的成熟功能性细胞的数量和可用性,近年来无饲养层培养体系逐渐成为主流,然而使用2D培养存在一些局限性,大多数2D培养的hESC在细胞移植后立即死亡,并且存活下来的细胞也不能起到修复组织的作用,因此为了获得成熟的功能性细胞,需要研究人员尝试建立更加成熟和简便的3D培养系统。其次,还需避免移植细胞在发挥其治疗作用之外引起免疫排斥以及形成肿瘤,与创伤形成和免疫排斥有关的问题也是hESC成功应用的瓶颈,虽然这可以通过沉默触发肿瘤形成和免疫排斥的基因、分子途径或使用诱导多能干细胞来实现,但仍然需要研究人员进一步探索。最后,在hESC诱导分化的神经细胞功能方面仍有大量的问题有待研究。
展望未来,与生物工具平行的工程方法也应被纳入到包括人类在内的哺乳动物的研究当中,用于设计、分析和操纵生物过程。例如,使用合成Notch受体设计细胞的定制传感和响应行为以及使用组合抗原传感电路精确识别肿瘤等合成生物学的应用[118-120];还有hESC诱导分化的神经元利用CRISPR和光遗传等方法在体外成功构建具有学习和记忆功能的人类神经网络,为建立电路学习和记忆的计算模型提供新方法等[103]。应该更多地将工程方法与hESC相结合,实现将人类生物学的基本知识转化为实际应用的梦想。
