人腺病毒感染防治进展
2021-06-23李国强
徐 磊,李国强
1952年冬季,美国军营中暴发了呼吸道疾病,一些士兵出现了非典型肺炎,他们在患者咽部分泌物中分离出一种新的病原体[1]。随后Rowe W P[2]和他的同事在人腺样组织中也发现这种病原体,命名为“RI-67”。后被证实是一种新型病毒,1956年命名为腺病毒[3]。七十年来,人们对腺病毒认识逐步加深[4]。见图1。
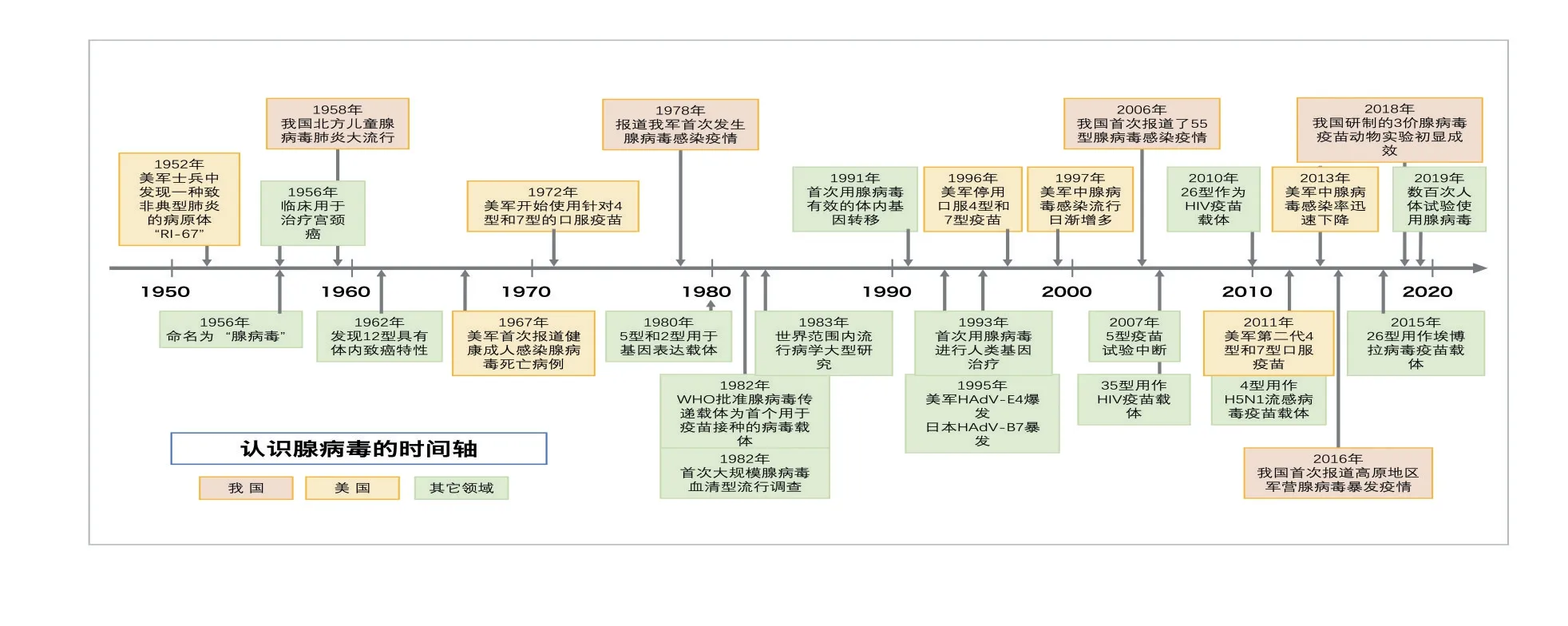
图1 人类认识腺病毒的时间轴
1 病毒特征
人腺病毒是双链线性DNA病毒,由一个二十面体衣壳和核蛋白组成。衣壳结构包含三种多肽,即Hex⁃on、Penton碱基和纤维突,它们共同包围约35000个碱基对的基因组。Hexon高变区的抗原决定簇决定腺病毒的血清分型。已有52种血清型、约70种基因型[5]被鉴定,分为A-G组。突变与同源重组可产生新的腺病毒类型[6],不同类型病毒可有不同的组织取向和不同毒性[7]。腺病毒5型和44型对乙烯毗咯烷酮碘的敏感性较低,对过氧乙酸和甲醛的抗性最强[8];紫外线对B55型腺病毒有抑制作用[9]。
2 致病机制
腺病毒首先通过其纤维突和宿主上皮细胞表面的cAMP受体及整合素结合,随后在细胞表面移动,脱去纤维突和六邻体,释放Ca2+导致溶酶体释放水解酶,损伤胞膜形成一凹陷,即经细胸内吞作用进入胞内,在神经酰胺引导在胞质内运行,脱去微管结构,与细胞核表面NPC受体结合,释放核酸进入核内,完成病毒基因扩增,释放入细胞质重组成新病毒体[10]。在此过程中,宿主免疫系统做了积极的应对反应,巨噬细胞、树突状细胞、中性粒细胞、补体系统以及IgG均积极对抗,通过释放自由基、C3、热休克蛋白等阻止病毒暴露和进入[10]。通过多种通路募集细胞因子促发炎症反应。腺病毒还能编码一些蛋白以及两个与病毒相关的非编码RNA来调节抗病毒自噬的功能,对抗宿主天然防御[11],也是腺病毒可成为科研中常用病毒载体的原因之一。腺病毒和免疫系统相互作用的结果决定了患者的临床表现[10,12]。见图2。

图2 腺病毒进入人体后的不同结局
3 流行特征
腺病毒全球流行,四季均可致病,冬季和春季为发病高峰。幼儿、密集社区、学校、军事营区人群以及免疫功能受损的个体均是易感者,暴发感染较常见。腺病毒主要经呼吸道传播,也可通过接触传播,粪口传播,还可通过污染的器具传播。腺病毒也可潜伏体内致机会性感染[13]。不同国家或地区,不同时期主要流行的腺病毒型别可发生变化[14]。因大多数病例是自限性的,腺病毒感染的确切流行率和发病率未知[15]。我国流行的腺病毒类型包括1~7型、11型、14型、55型,其中以7型和3型为主[16]。腺病毒感染大流行最先发生在我国儿童当中[17]。近六十年来,我国幼儿园、中小学校多次暴发感染疫情,以肺炎、咽结合膜热疫情常见。1983年我国首次报道了发生在军营中的疫情[18],自2010年以来军营中的腺病毒暴发疫情报道增多。2006年我国首次报道了B55型腺病毒引起的暴发感染[19],该型别近年来在我国军营及平民中流行愈发多见,在2016年首次在青藏高原地区出现了流行[9],已在游泳池、健身房、家庭内部、医院内等场所发生暴发感染,重症及死亡病例不少见[20]。
4 临床表现
腺病毒感染平均潜伏期约为5-12天,传染期可持续数周甚至数月[4]。患者多为轻微自限性感染,部分为无症状的病毒携带状态。不同型别可有不同的组织取向而有不同的临床特点[4,14,21,22](见表1)。以呼吸道感染最多见,急性胃肠炎和流行性角膜结膜炎可见,心肌炎、肝炎、膀胱炎、结肠炎或脑膜脑炎较少见。6%-20%的下呼吸道感染[23]与10%-23%急性胃肠炎[24]的住院患儿为腺病毒感染。6月至2岁的儿童、老年人、免疫缺陷者如移植受者或HIV感染者易发生严重的致命感染[25]。健康成人亦可见重症肺炎,发展为(acute respiratory dis⁃tresssyndrome,ARDS)ARDS,死亡率为27%-45%[26]。重症肺炎和ARDS通常是由B、C和E组病毒所致,可能与病毒突变或重组使毒性增强有关[27]。见表1。

表1 人腺病毒分组分型、临床特点
5 重症患者评估
早期识别重症感染有益于防治和挽救患者生命。患者严重程度可能与病毒载量[28]和血清型密切相关[28];初始单核细胞减少可能有助于预测是否发生呼吸衰竭[29];IL-6和ESR可能与HAdV-7感染严重程度有关[30];混合病毒细菌感染[31]可能与死亡率增加有关;中性粒细胞比例高、淋巴细胞减少以及IL-17+CD4+细胞水平明显升高,IL-17+CD8+细胞水平降低,IFN-γ、IL-4、IL-10和IFN-α2水平升高是重症患者的血清学特点[32]。实际上影响病毒性肺炎死亡率的因素很复杂[33],仅凭单一的指标并不能完全指导临床,多个评分量表可提高预测准确度。
6 疾病管理
轻症患者具有自限性,治疗包括对症、支持治疗和并发症管理。重症感染者需以维持生命体征平稳为基石[34]。(extracorporeal membrane oxygenation,EC⁃MO)ECMO近年来用于重症腺病毒肺炎患者的抢救[35]。当前已有针对细胞因子风暴的靶向治疗,如激素仍然是当前国际脓毒症治疗指南的一部分,但证据水平较低[36];静脉注射免疫球蛋白能够通过Fc依赖性抗炎机制阻断T细胞活化,并含有超抗原中和抗体,因此具有直接的抗毒作用;抗TNF或抗IL-1制剂抑制内源性细胞因子在国际大型RCT中并未显示疗效。血浆吸附吸疗法有临床应用的报告[37]。
7 抗病毒药物
目前尚无被批准用于抗腺病毒的药物。抗腺病毒药物主要靶点为抑制病毒吸附、病毒侵入、病毒复制[38]。唾液酸衍生物可抑制腺病毒吸附,但仅尝试用于治疗腺病毒感染引起的流行性角结膜炎[39],多价态唾液酸类衍生物抑制剂显示较好的前景[40]。腺病毒半胱氨酸蛋白酶抑制剂理论上可抑制病毒入侵,相关合成物正在研制中[41]。病毒复制抑制剂有嘌呤类、嘧啶类和哌嗪脲类等。嘌呤类如利巴韦林[42]已有成功治愈的案例。嘧啶类如西多福韦在许多移植患者感染者中使用,但其生物利用度较低且存在肾毒性。布罗福韦酯是西多福韦的脂联衍生物,肾毒性低,但因出现胃肠道反应及肝损害和死亡事件而未通过III期临床试验[43]。哌嗪脲类抑制剂如三取代哌嗪-2-酮苗头化合物及其衍生物具有较强的抗腺病毒活性[44]。国外一些团队已虚拟筛选出一些化学制剂可能会推进抗腺病毒药物的研制[38]。
8 腺病毒疫苗
接种疫苗是防治腺病毒最可靠的手段。美国是全球唯一成功开发并运用腺病毒疫苗的国家。第一代针对4型和7型腺病毒的口服疫苗于1971年开始适用于美国士兵,取得了巨大的防治成效[45]。美军于1999年停止接种,此后腺病毒感染疫情在美军内部再次大量暴发[46]。2011年第二代4型和7型腺病毒口服疫苗运用,美军腺病毒感染率随即大幅度下降[47]。我国腺病毒疫苗研发已有一定深度。海南大学[48]研发了一种人4/7型双价腺病毒候选疫苗株,对小鼠有一定的保护作用。广州医科大学团队[49]构建了一种重组三价腺病毒候选疫苗和一种针对3,-7,-14和-55型腺病毒的四价候选疫苗[50],在动物实验中均对小鼠产生了保护作用。
9 总结与展望
从预防、治疗再运用到科研,人们对腺病毒的认识已经颇具深度。流行病学检测、大规模暴发感染、重症感染、疫苗研发是腺病毒防治的重难点。因此今后对人腺病毒在病毒学与免疫学、临床与治疗、疾病控制方面的研究需进一步加深。
