直肠超声双重造影对直肠癌血管生成的评估价值
2021-06-22陆文明郭碧萍
嵇 辉 陆文明 郭碧萍
直肠癌是消化道常见恶性肿瘤之一,起病隐匿,早期无明显临床症状[1],大部分患者因便血而就诊,被确诊时病程多已进展至中晚期,错失最佳治疗时期。直肠癌具有高度侵袭特性,极易复发和转移[2]。外科手术是直肠癌常见治疗方式,其术式选择与疾病术前分期、病灶浸润深度、血管生成情况以及转移情况相关。经腹超声检查是直肠癌常用术前检查,但患者肠内容物、肠道蠕动等因素可干扰结果,导致诊断价值受限[3]。经直肠灌注造影和静脉超声造影合称双重超声造影,可清晰显示肠壁各层结构,又可微循环灌注显像直肠癌组织。基于此,本研究采用经直肠灌注造影联合静脉超声造影对80 例直肠癌患者进行检查,探讨双重超声造影在评估直肠癌血管生成中的应用价值。
1 资料与方法
1.1一般资料 选取2019 年3 月—2020 年3 月浙江省湖州市第一人民医院、浙江省湖州市南浔区菱湖人民医院收治的直肠癌患者80 例为研究对象,男46 例,女34 例;年龄36~79(56.41±8.32)岁;临床表现为便血,其中伴腹痛15 例,伴里急后重47 例,伴大便性状改变13 例。本研究获得入选患者及其家属同意并签署知情同意书。本研究符合《赫尔辛基宣言》伦理原则,并通过浙江省湖州市第一人民医院医学伦理委员会审核(批件号2018ky0231 号)、浙江省湖州市南浔区菱湖人民医院医学伦理委员会审核(批件号2018ky014 号)。
1.2纳入及排除标准 纳入标准:(1)符合直肠癌诊断标准,并经病理学检查确诊[4];(2)无经直肠灌注造影和静脉超声造影检查禁忌证;(3)临床资料齐全。排除标准:(1)入组前6 个月内有炎症性肠病史或肠道手术史者;(2)对造影剂过敏者;(3)有增生性肠病史,结肠高度扩张或伴梗阻、腹膜炎及可疑肠穿孔者;(4)检查前有过放化疗等治疗史者;(5)伴肝、肾、肺功能障碍者。
1.3仪器与试剂 使用彩色多普勒超声诊断仪(美国GE 公司,型号:LOGIQE9)进行检查,探头频率:腹部凸阵3.5MHz、直肠腔内7.5MHz。检查过程所用试剂有胃肠超声助显剂(湖州东亚公司)和SonoVue(声诺维)静脉超声造影剂(意大利Bracco 公司)。造影剂使用前进行预处理,注入5mL 0.9%生理盐水混匀待用。助显剂使用前进行预处理,加入600mL 沸水搅拌成混悬液,冷却至室温备用。
1.4方法 术前10 天内对所有入选对象进行常规经腹超声检查、经直肠灌注造影检查和静脉超声造影检查。常规经腹超声:在检查前2h 对患者进行清洁灌肠,并嘱患者憋尿,为后续检查做准备。患者取仰卧位,在探头下找到充盈膀胱并以此为声窗扫查直肠区域,观察和记录病灶位置、回声、边界以及血流信号强度,并常规探查腹盆腔了解远处转移情况。超声双重造影:(1)患者取左侧屈膝位,经肛管缓慢向直肠腔内灌注助显剂,边操作边询问患者耐受情况,保证患者耐受良好。上段直肠癌灌注约250~300mL,中下段直肠癌灌注量为100~150mL。(2)灌注完成后涂少许耦合剂于探头表面,套上橡胶套,缓慢推进肛门。(3)转动探头方向,观察肠腔充盈状况,是否存在狭窄,并记录肛缘距肿瘤距离(在肿瘤下缘放置探头顶端,于肛缘处在探头上做标志,测量探头顶端距标志的距离即可)。(4)多角度观察病灶范围、大小、形态、回声特征、肠壁厚度、肠壁浸润深度、血流信号、肠周淋巴结等。(5)调节二维图像,选取最佳显示切面,切换到造影模式,双幅显示。(6)保持体位不变,经肘静脉团注造影剂2.5~3.0mL,在造影剂注入的同时启动计时器,动态连续观察感兴趣区域3min 并存储动态图像。(7)结合二维图像与造影剂微循环灌注情况,综合分析病灶范围、肠壁浸润深度及与周围组织的关系。
1.5判定标准 浸润深度的病理及超声TNM 分期诊断标准[5]:以手术病理检查结果为金标准将其分期为(1)T1 期:肿瘤局限于黏膜、黏膜下层内,造影显示固有肌层低或无增强,病灶高增强,超声检查显示第2 层高回声带完整;(2)T2 期:肿瘤向外浸润,侵犯固有肌层但未突破浆膜层,造影显示病灶及固有肌层局部或全部早期高增强,晚期低增强,超声检查显示肌层低回声增厚、病灶局部第2 层带状高回声破坏,第3 层带状高回声完整;(3)T3 期:肿瘤穿透固有肌层侵及浆膜层并浸润肠周围纤维脂肪组织,造影显示病灶及直肠壁全层早期高增强,并向周围不规则突出,晚期低或无增强,累及肠周组织,超声检查显示病灶局部第3 层高回声带破坏,肠壁正常层次消失,可见低回声不规则毛刺状、锯齿状突起;(4)T4期:肿瘤侵蚀邻近器官或组织,造影显示病灶高增强且延续至周边脏器,超声检查显示周围脏器边缘高回声带消失,与肿瘤低回声带无分界。
血流分级标准[6]:以Adler 血流半定量分级法为分级依据,对血流进行分级,(1)肿瘤内部及周边无血流信号为0 级;(2)结节内可见2 个点状血流信号,亦或是肿瘤周边有点状、线状血流信号为Ⅰ级;(3)肿瘤内1~2 条穿支血管或有3~4 个点状血流信号为Ⅱ级;(4)肿瘤内超过3 条血管或血管互交织成网状为Ⅲ级。Ⅱ~Ⅲ级表示血流信号丰富,0~Ⅰ级表示血流信号不丰富。
定位诊断标准[4]:(1)下段直肠癌:距肛缘<5cm;(2)中段直肠癌:距肛缘5~<10cm;(3)上段直肠癌:距肛缘10~15cm。
1.6统计学方法 应用SPSS 21.0 软件对数据进行分析,计量资料以均数±标准差(±s) 表示,计数资料以百分率(%)表示,分别采用t 检验和χ2检验,诊断准确率定位准确率比较采用一致性检验,P<0.05 认为差异有统计学意义。
2 结果
2.1病理结果、常规超声表现与超声双重造影表现比较 术后病理学检查结果显示,80 例直肠癌患者病理类型均为腺癌,其TNM 分期为T1 期17 例、T2期22 例、T3 期31 例、T4 期10 例,不同T 分期直肠超声双重造影血流信号见图1-4;分化程度为低分化25 例,中分化42 例,高分化13 例。常规经腹超声检查显示,表现为位置固定,边界模糊的“假肾征”者有68 例,肠壁局限性增厚者12 例,靶环征4 例,肝脏转移灶6 例,低回声结节3 例,肠腔狭窄变形47 例,局部肠壁层次紊乱22 例。病灶处血流信号显示为点状、线状,少部分血流信号交织成网状。超声双重造影检查显示,直肠癌患者总体呈现肠腔狭窄、肠壁不规则低回声增厚突起、蠕动消失的图像特征。其中增厚肠壁可见凹状溃疡有15 例,回声影呈菜花状有11例,呈环状或半月形13 例。肿瘤入侵的肠壁层次结构紊乱,可累及周围组织,导致其相互粘黏、边界不清。增强初期可见树枝状粗大血管影,静脉相迅速消退为低或无增强,动脉相病灶为不均匀高增强。

图1 直肠下段癌(T1,CDFI 血供I 级;增强超声呈中等血供不均匀高增强)
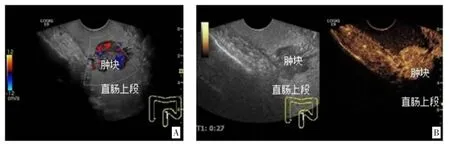
图2 直肠上段癌(T2,CDFI 血供Ⅲ级;增强超声呈富血供不均匀高增强)
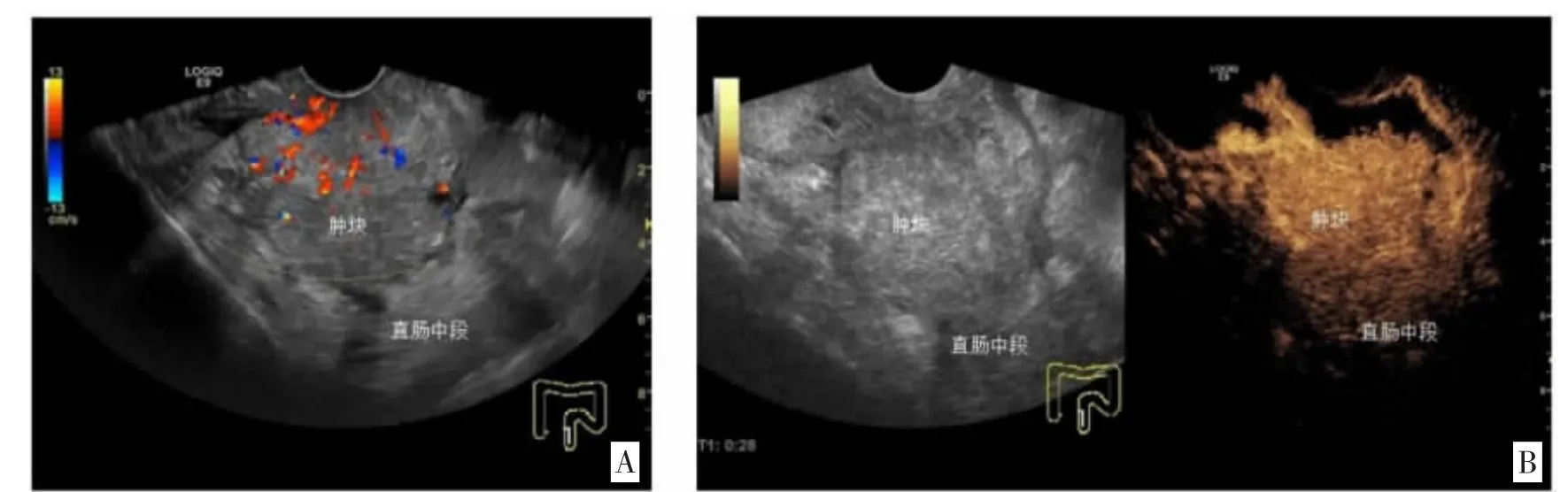
图3 直肠中段癌(T3,CDFI 血供Ⅲ级;增强超声呈富血供不均匀高增强)

图4 直肠下段癌(T4,CDFI 血供Ⅱ级;增强超声呈中等血供不均匀增强伴点片状低、无增强区)
2.2两种方法与病理检查结果TNM 分期比较 常规经腹超声结果显示,诊断不足8 例,诊断过度7例,诊断准确率为81.25%,一致性检验结果显示,该检查方式与病理结果一致性一般(kappa=0.684,P<0.01)。超声双重造影结果显示,诊断不足5 例,诊断过度3 例,诊断准确率为91.25%,一致性检验结果显示,该检查方式与病理结果一致性满意(kappa=0.931,P<0.01)。见表1。
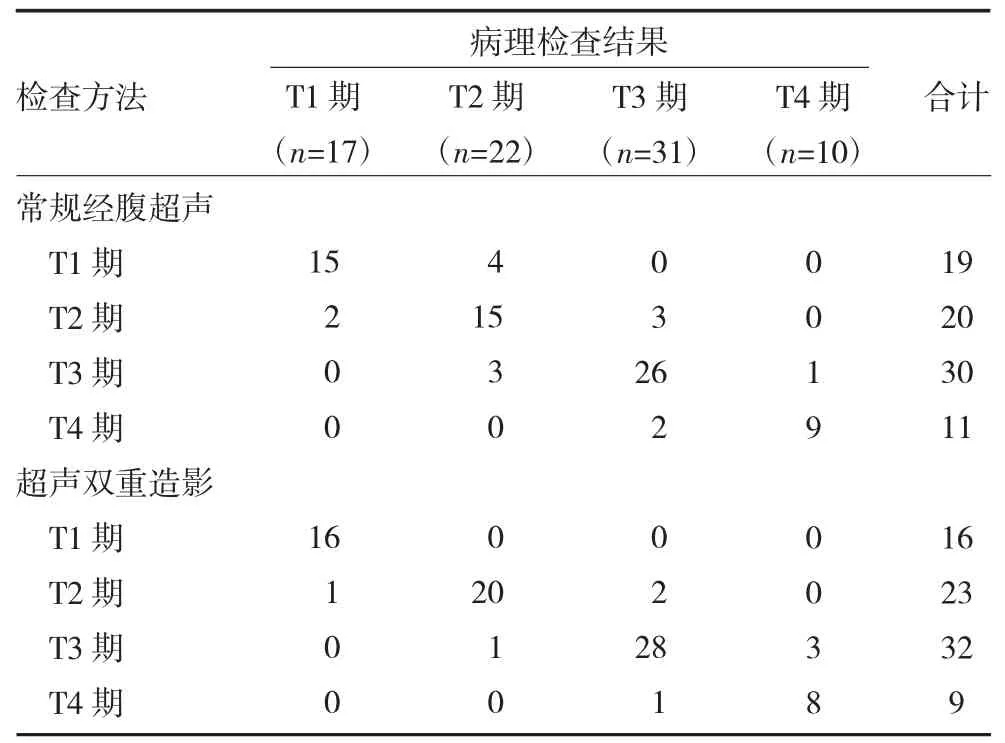
表1 两种方法与病理检查结果TNM 分期比较(例)
2.3两种方法肿瘤定位准确率比较 病理结果显示80 例患者下段癌22 例,中段癌30 例,上段癌28 例,常规经腹超声显示下段癌20 例,中段癌31 例,上段癌29 例,错误定位8 例,定位准确率90.00%,一致性检验结果显示,与病理结果一致性满意(kappa=0.853,P<0.01)。双重超声造影显示下段癌21 例,中段癌30 例,上段癌29 例,错误定位2 例,定位准确率97.50%,一致性检验结果显示,与病理结果一致性满意(kappa=0.974,P<0.01),且双重超声造影定位准备率明显高于常规经腹超声(χ2=4.800,P=0.028),见表2。

表2 两种方法与病理结果肿瘤定位准确率比较(例)
3 讨论
有研究显示,我国直肠癌患者5 年生存率在50%~60%,转移和复发风险大,预后较差[7]。直肠癌治疗原则以外科手术为主,辅以化疗、放疗的综合治疗,对早期患者而言手术效果最佳。微血管形成是为肿瘤细胞提供营养物质,促进其恶性增殖的重要病理学变化,是导致疾病预后不良的重要原因,若能在术前掌握患者血管生成情况对手术方案的制定和预后极为有利。目前,临床上评估恶性肿瘤血管生成情况一般采用免疫组织化学染色法,但该方法具有一定的局限性,主要体现在两个方面[8]:(1)该检查方法为有创检查,需要活检或手术多次取材,患者接受度较低;(2)一般多在手术时取样,术后检查,无法在术前全面评估肿瘤生物学特征,无法为外科手术治疗方案选取和预后情况提前进行预见性分析。因此,若能及早诊断直肠癌并明确血管生成情况对疾病治疗方案的选取和预后至关重要。
影像检查是临床用于明确诊断和指导治疗的重要手段,在恶性肿瘤的诊断中发挥重要作用。常规经腹超声检查易受肠内容物、肠道蠕动等因素影响,对肿瘤新生血管形成情况和肿瘤病理分期的显影效果较差。直肠双重超声造影(经直肠灌注造影联合和静脉超声造影)在直肠癌术前评估上优势显著[9-10]:(1)超声探头可直接接触到腔内肿瘤组织,进而准确、直观地获得对肿瘤位置和肠壁浸润深度的评价;(2)使用回声型助显剂,排空慢,伪像少,可形成良好声窗,克服肠道内气体、粪渣等因素影响,显影区域可达到距肛缘约15cm 处,增加了观察范围,增强了周围邻近器官的清晰度;(3)静脉造影剂的应用可对肿瘤血供及微循环情况进行更客观的评价。
本结果显示,直肠癌在常规经腹超声和超声双重造影检查下的影像学表现分别为肠壁局限性增厚、肠腔内突起“假肾征”;肠壁不规则低回声增厚、肿块突起。常规经腹超声与病理检查结果一致性一般,而双重超声造影结果与病理检查结果一致性满意,提示直肠癌患者多具有上述影像学征象。有文献报道,正常直肠壁在超声下有三高两低回声带,从外向内依次为:高回声带浆膜层(或外膜)、低回声固有肌层、高回声黏膜下层、低回声黏膜肌层、高回声黏膜层[11]。本研究发现,在超声双重造影模式下正常直肠壁可见3 层结构,足以满足临床对病灶位置和浸润程度的评估;且肿瘤与正常组织的微循环灌注模式差异不仅可明确患者血管生成情况,亦是直肠癌准确进行TNM 分期的重要依据。超声双重造影血流图像显示,病灶周围血管分布杂乱,走行迂回,相互交错成网,对血管走向和分布呈现清晰。双重超声造影扩大了观察范围,病灶定位准确率为97.50%,且对TNM 分期结果与病理结果一致性满意。超声双重造影检查由于主观性较强,TNM 分期与病理检查结果亦存在差异。本研究显示,超声双重造影TNM 分期诊断不足5 例,诊断过度3 例,诊断准确率为91.25%,明显高于常规经腹超声。探讨其原因,可能与超声双重造影对肿瘤显影更强,可准确掌握肿瘤侵袭范围和血管分布有关。进一步分析双重超声造影在早期的T1、T2 分期准确度较高,这可能与直肠腹膜返折解剖结构复杂难以准确判断,超声医师经验不足有关。此外,直肠癌疾病进展形成的新生血管周围存在炎症反应,从而引起肠壁增厚与肠壁结构紊乱,病灶范围扩大,导致声像图与肿瘤浸润难以区分,亦是造成分期不准确的主要原因[12]。
综上所述,直肠超声双重造影在直肠癌早期诊断中可评估患者血管生成情况和T 分期,具有较高的定位和TNM 分期准确度;可排除胃肠道气体、粪渣的干扰,对手术方案的选取和预后指导具有重要临床价值。
