粪菌移植对慢加急性肝衰竭小鼠模型肠道菌群的影响
2021-06-22徐玉静陆圣威甘建和
高 安,徐玉静,陆圣威,孙 蔚,甘建和
苏州大学附属第一医院 感染科,江苏 苏州 215000
慢加急性肝衰竭(ACLF)为慢性肝病基础上,短期内出现急性肝功能失代偿和肝衰竭的表现[1]。ACLF会导致肠道菌群失调、肠屏障功能受损、免疫功能下降[2],越来越多的证据[3]说明慢性肝病与肠道菌群失调有关。近年来,肠道菌群在人体健康和疾病中起着至关重要的作用,并参与肠道内外慢性疾病的病理生理学[4]。基于肠肝轴理论,推测改善菌群失调对ACLF有保护意义,本实验通过建立ACLF小鼠模型,研究ACLF小鼠肠道菌群变化及粪菌移植(fecal microbiota transplantation,FMT)对ACLF小鼠的安全性及保护作用。
1 材料与方法
1.1 实验动物 选用40只SPF级雄性C57BL/6小鼠,3~4周龄,实验动物生产许可证编号为SCXK(苏)2018-0006。实验动物使用许可证编号为SYXK(苏)2017-0042。实验垫料、饲料经过辐照杀菌处理,饮用水经高压灭菌处理,符合SPF级动物使用标准,温度(24±2) ℃,湿度55%,小鼠自由摄取饲料和饮用水,光照与黑暗各12 h循环。
1.2 主要试剂 CCl4购自江苏强盛功能化学股份有限公司,橄榄油购自国药试剂网,D-氨基半乳糖(D-GalN)与脂多糖(LPS) 购自美国Sigma公司。
1.3 实验方法
1.3.1 ACLF小鼠模型建立 将40只小鼠按随机数字表法分为四组,每组10只。本研究采用CCl4联合D-GalN和LPS建立ACLF模型[5-6]。正常组(CON组)作为正常对照组进行观察。模型组(MOD组)小鼠按5 ml/kg腹腔注射20% CCl4(橄榄油稀释) ,2次/周,共12周,10 d后给予一次性腹腔联合注射(LPS 0.5 mg/kg、D-Gal 400 mg/kg),建立ACLF模型,48 h后处死。粪菌移植组(FMT组)小鼠造模同MOD组,在第12周予以制备的正常组(CON组)小鼠粪菌液200 μl/只灌胃,持续3 d。模型小鼠粪菌移植组(ANFMT组)小鼠,在第12周予以制备的模型组(MOD组)小鼠粪菌液200 μl/只灌胃,持续3 d外。CON组小鼠给予腹腔注射同等剂量的橄榄油、生理盐水,同等剂量生理盐水灌胃。MOD组予以同等剂量生理盐水灌胃。4组小鼠同时处死。
1.3.2 标本采集与粪菌液制作 粪便标本采集采用刺激小鼠肛门的方法收集新鲜排出的小鼠粪便装于EP管中,装好的标本迅速转移至-80 ℃冰箱冻存。称重后用无水乙醚麻醉,眼球取血放入采血管(含有肝素锂),1500 r/min离心5 min,取上清液,-80 ℃冰箱保存。眼球取血后的小鼠颈椎脱臼处死后解剖,取出肝脏,每只小鼠在肝右叶同一位置切取2块0.5 cm×0.5 cm×0.3 cm大小肝组织,放进10%福尔马林溶液,用于病理检测。
参照相关文献制备粪菌液[7-8],具体步骤如下:(1)分别选取CON组和MOD组小鼠粪便;(2)稀释,粪便称重后放于搅拌器中,加入5倍粪便重量的无菌生理盐水进行搅拌混匀;(3)过滤,将粪便混悬液先后经过直径约1、0.5、0.25 mm的自制灭菌不锈钢滤网过滤;(4)离心,将悬液用15 ml离心管分装置于离心机中(2000 r/min、5 min),弃上清液;(5)洗涤,将菌液加生理盐水至原悬液的量并摇匀,再次离心(2000 r/min、5 min)重复3次;(6)冻存。按照50 ml菌液加甘油(100%)5 ml的比例摇匀,分装于2 ml冻存管中,放入-80 ℃冰箱。
1.4 各项指标检测 肝功能指标:采用全自动生化仪检测ALT、AST水平。病理HE染色:肝组织在10%福尔马林溶液中固定1 d后取出,进行梯度浓度乙醇逐级脱水,二甲苯透明,并包埋在石蜡里,行组织切片及HE染色,最后中性树胶封片,显微镜下观察并拍照、保存。粪便肠道菌群检测:粪便样品按照试剂盒说明书提取DNA,将DNA样品在Illumina NovaSeq平台对小鼠粪便肠道菌群进行高通量测序,获得16SrDNA数据。构建类OTU( Operational Taxonomic Units)表,获得最终的feature特征表以及特征序列,进一步进行Venn图、α多样性分析、β多样性分析、观察在门、属水平相对丰度较高的物种并进行差异分析等。
1.5 伦理学审查 本研究方案经由苏州大学实验动物伦理委员会审批,批号:SUDA20201208A03,符合实验室动物管理与使用准则。

2 结果
2.1 小鼠体质量和肝功能的变化 4组小鼠体质量变化如图1所示,在进行粪菌灌胃3 d内,ANFMT组与FMT组小鼠体质量均下降。与CON组相比,MOD组小鼠体质量显著下降,差异有统计学意义(P<0.05)。MOD组与FMT组在CCl4腹腔注射及灌粪菌液期间均未出现小鼠死亡,在末次联合注射LPS与D-GalN,MOD组死亡4只,FMT组死亡2只,2组病死率差异无统计学意义(P>0.05)。与CON组相比,ANFMT组、MOD组、FMT组AST水平均显著升高(P值均<0.05),MOD组ALT水平显著升高(P<0.05)。与MOD组相比,FMT组AST、ALT均显著下降(P<0.05)(表1)。

表1 4组小鼠体质量与肝功能水平比较
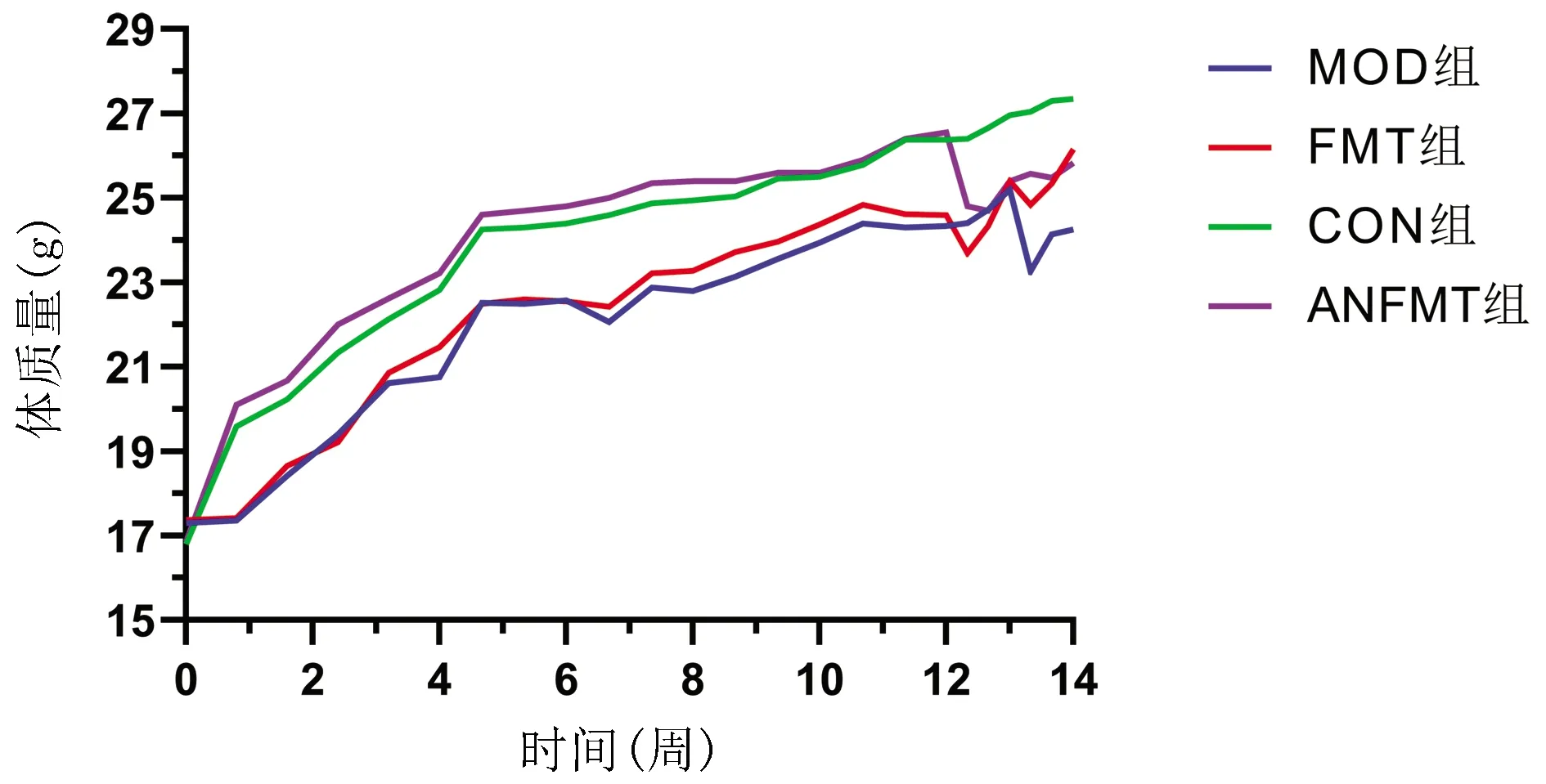
图1 4组小鼠体质量变化
2.2 小鼠肝组织病理结果 如图2所示,CON组小鼠肝小叶形态结构正常,肝细胞无变性、坏死,无炎性细胞浸润;MOD组小鼠肝小叶结构严重破坏,排列紊乱,肝细胞大片状坏死并伴炎性细胞浸润;与CON组相比,ANFMT组肝细胞肿胀,轻微气球样变,炎性浸润增多;FMT组弥漫性肝细胞肿胀,明显气球样变、坏死轻于MOD组。
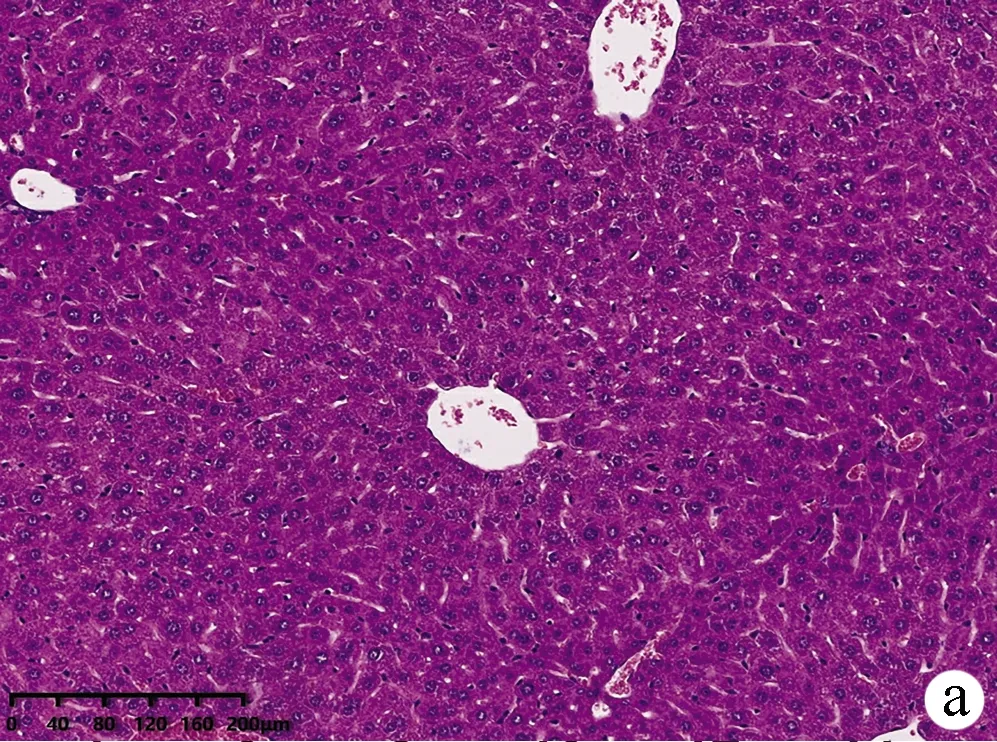
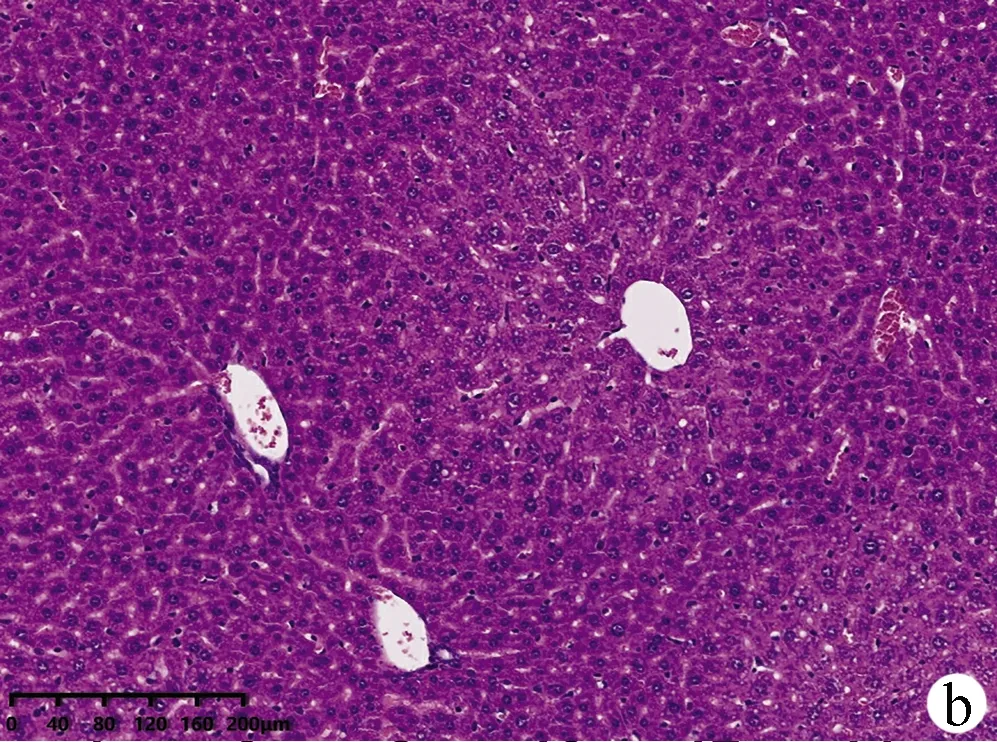
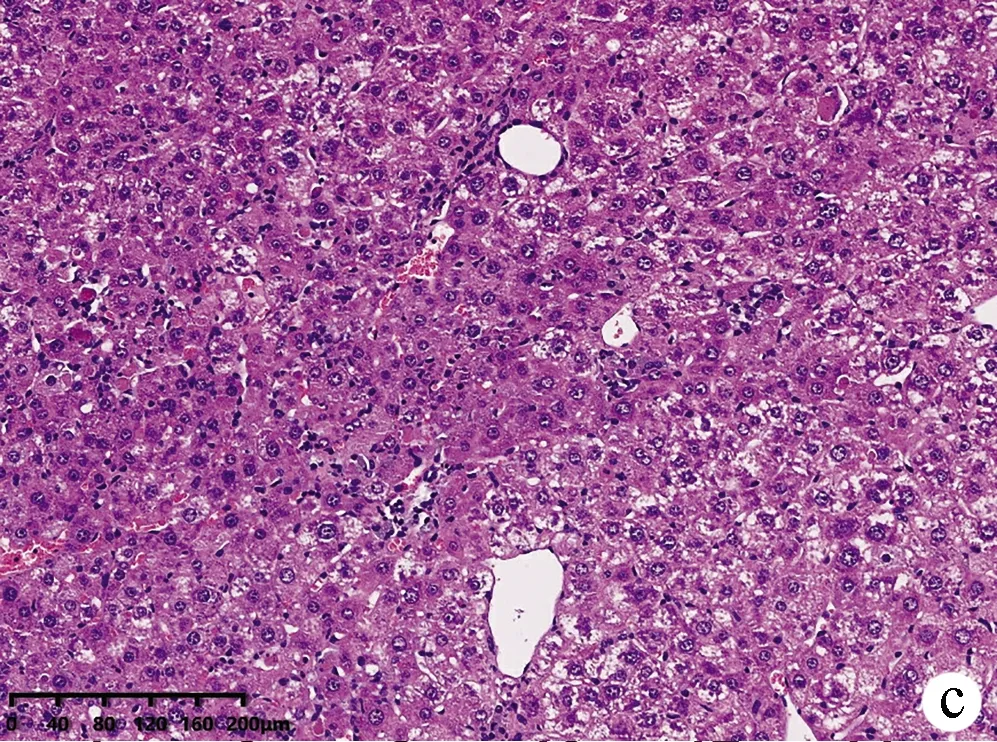
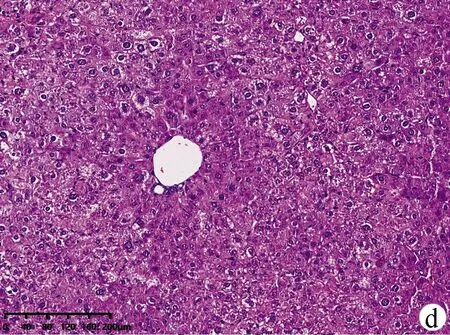
注:a,CON组;b,ANFMT组;c,MOD组;d,FMT组。图2 各组小鼠肝组织病理(HE染色,×200)
2.3 测序结果质量分析
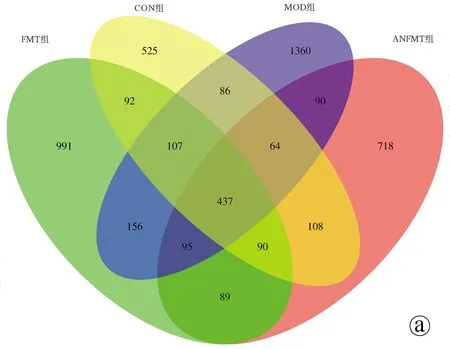
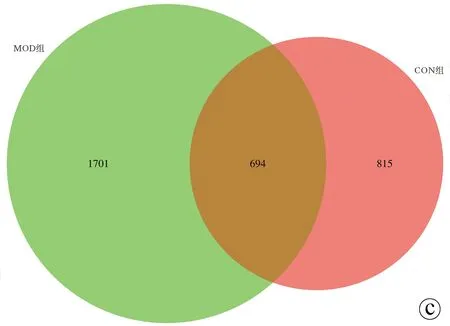
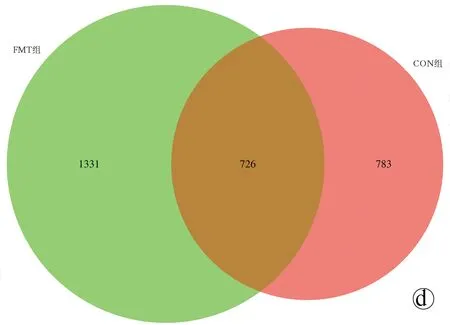
2.3.1 feature分布Venn图 基于各组样本的OTU数量绘制了可直观显示差异的Venn图。CON组有525个独有的OTU,ANFMT组有718个独有的OTU,MOD组有1360个独有的OTU,FMT组有991个独有的OTU(图3a)。与CON组相比,MOD组有1701个独有的OTU,ANFMT组有992个独有的OTU,FMT组有1331个独有的OTU(图3b~d)。
2.3.2 α多样性分析 各样本稀释曲线均趋于平坦(图4),表明本实验取样量合理且物种组成丰富度高,可进一步分析。α多样性分析中observed_OTUs指数(χ2=1.42,P=0.70)、Shannon指数(χ2=1.71,P=0.63)、Simpson指数(χ2=1.25,P=0.74)在各组差异无明显统计学意义。
2.3.3 β多样性分析 主成分分析(PCA)表明,与CON组相比,MOD组、FMT组、ANFMT组大鼠肠道菌群组成结构均发生显著变化(P<0.01)(图5)。基于Weighted_UniFrac NMDS分析显示,4组肠道菌群存在差异(P<0.01)(图6)。主坐标分析(PCoA分析)显示,4组各样本间距离较大,差异有统计学意义(P<0.01)(图7)。基于Weighted_Unifrac anosiom相似性分析:R=0.286,P=0.001;基于Weighted_Unifrac adonis多元分析:R2=0.263,P=0.02,表明组间差异大于组内差异,4个不同分组样品存在差异,可信度高。

注: a,4组比较;b,CON组 vs ANFMT组;c,CON组 vs MOD组;d,CON组 vs FMT组。
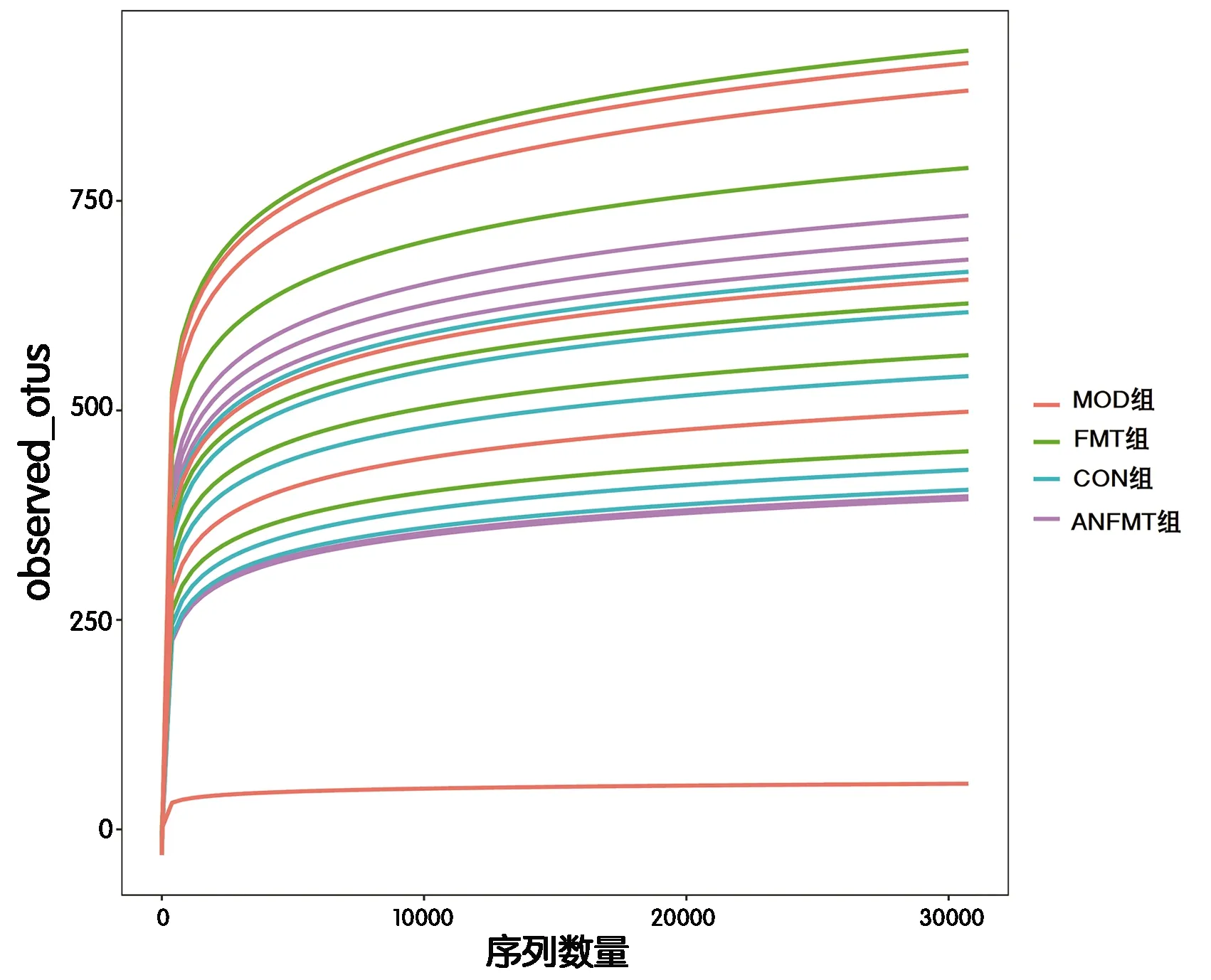

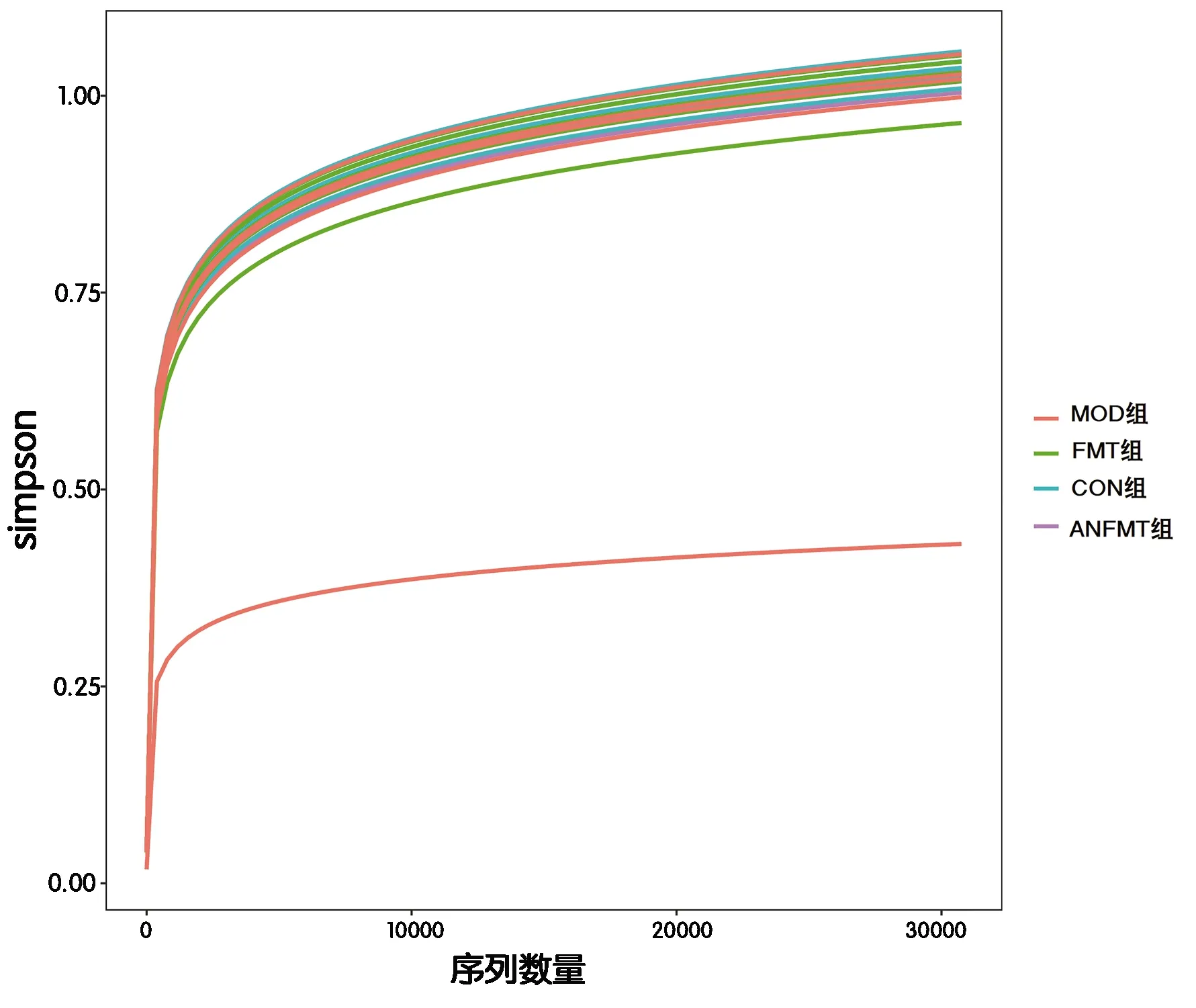
图4 各组粪便菌群稀释曲线图
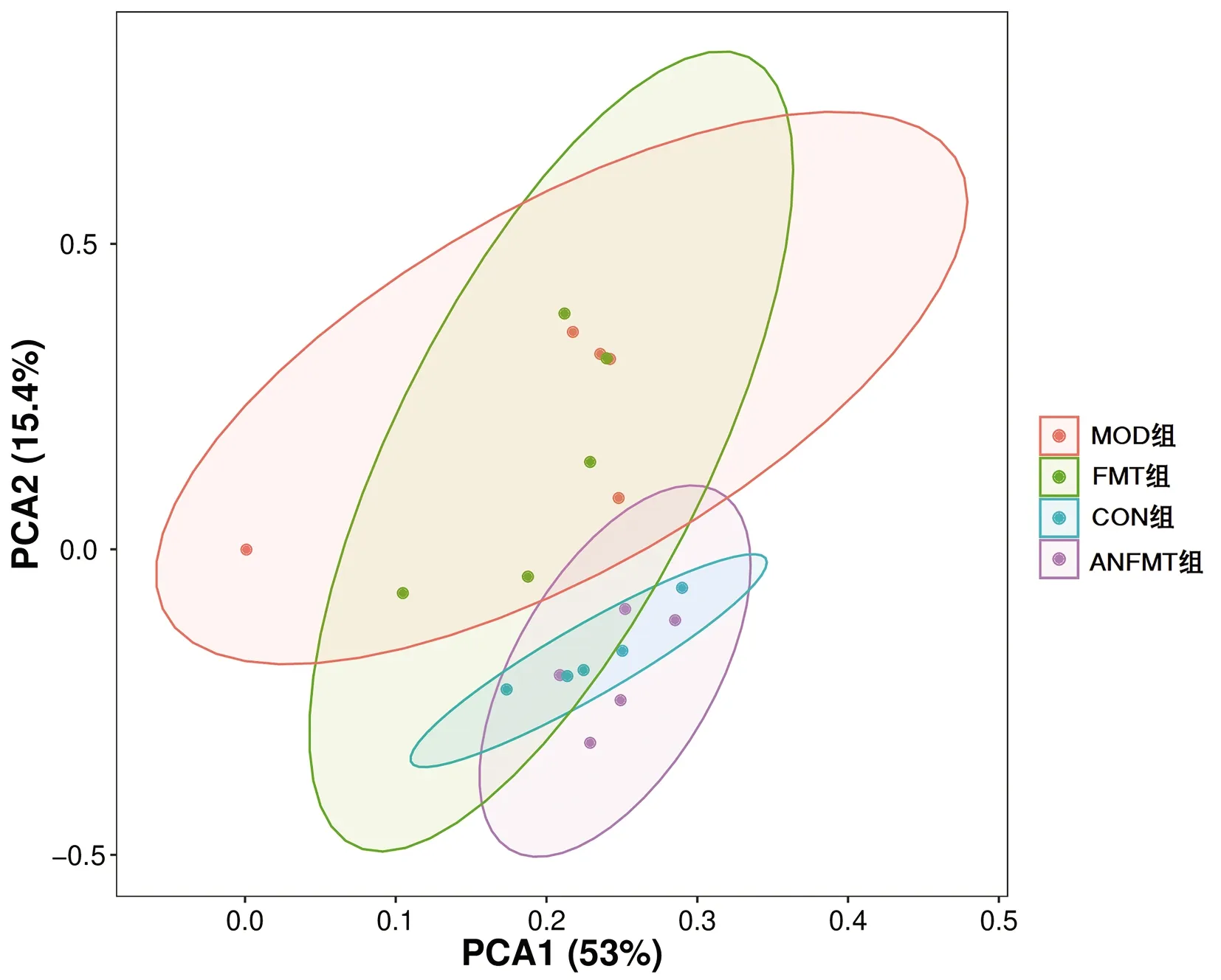
图5 4组肠道菌群PCA分析

图6 4组肠道菌群NMDS分析
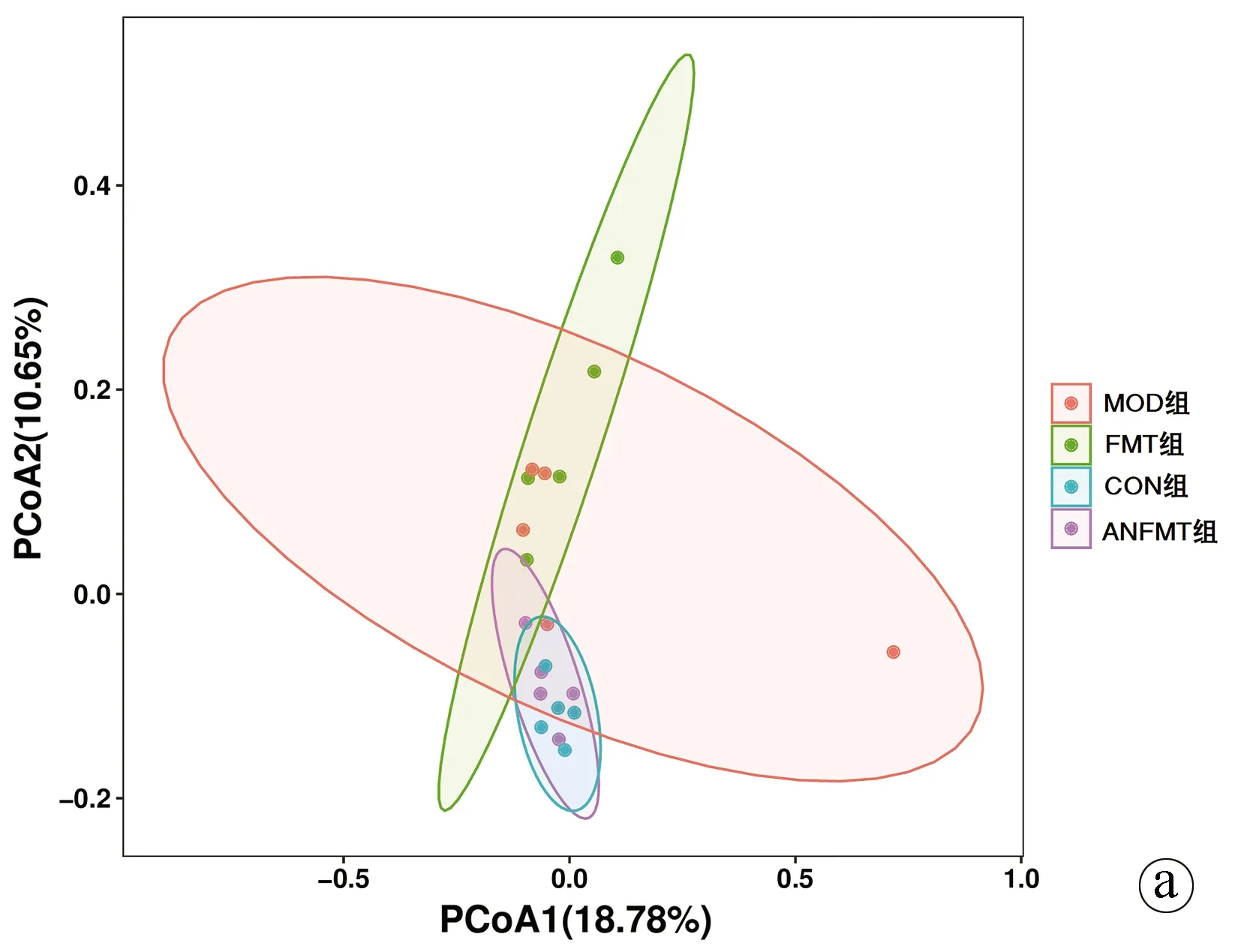

注: a,基于unweighted unifrac分析;b,基于 weighted unifrac分析。图7 4组肠道菌群PCoA分析
2.3.4 小鼠肠道菌群物种组成分析
2.3.4.1 门水平肠道菌群结构分析 基于门水平样本物种组成结构和差异性聚类分析发现,小鼠粪便菌群组成以拟杆菌门(Bacteroidetes)、厚壁菌门(Fimicutes)、疣微菌门(Verrucomicrobia)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)为主,Bacteroidetes和Fimicutes为主要优势菌群(图8a)。在柱状图的基础上,还可以根据样品物种组成距离对样品进行聚类分析,采用Bray-Curtis距离,ANFMT组各菌门丰度虽与CON组相近,但菌门平均丰度上升或下降与MOD组相似;FMT组菌群较MOD组有一定程度的恢复(图8b)。对同一生物学重复组内取均值进行热图绘制(图9),门水平差异检验显示,与CON组相比,MOD组小鼠Verrucomicrobia上升,差异有统计学意义(P<0.05);与CON组相比,ANFMT组小鼠未分类(unclassified)升高,Patescibacteria、脱铁杆菌门(Deferribacteres)下降,差异均有统计学意义(P值均<0.05);与MOD组相比,FMT组小鼠厚壁菌门(Fimicutes)下降,差异有统计学意义(P<0.05)。


注: a,门水平柱状图; b,样品聚类分析图。图8 四组菌群门水平分布情况
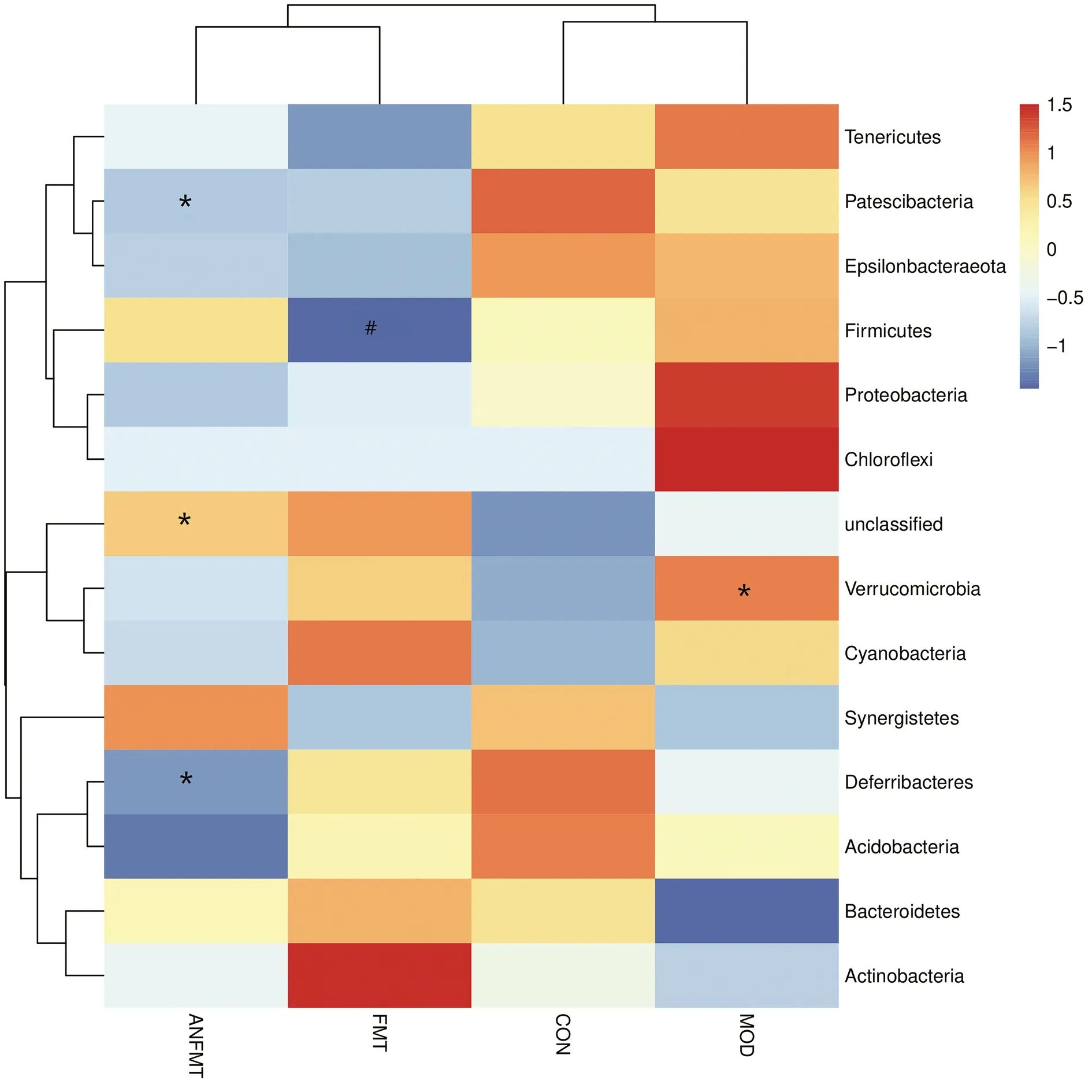
注:与CON组相比,*P<0.05;与MOD组相比,#P<0.05;蓝色表示丰度低,红色表示丰度高。
2.3.4.2 属水平肠道菌群结构分析 各组菌群菌属相对丰度上存在明显差异,且优势菌群发生变化。CON组中Muribaculaceae_unclassified、Dubosiella在肠道菌群中占比最高,MOD组中,Muribaculaceae_unclassified、链球菌属(Streptococcus)阿克曼菌属(Akkermansia)在肠道菌群中占比最高(图10a)。聚类分析显示,ANFMT组在菌属水平丰度虽与CON组相近,各菌属丰度变化较MOD组菌属变化相似;FMT组菌群与MOD组比有一定程度的恢复(图10b)。对同一生物学重复组内取均值进行热图绘制(图11),属水平差异检验显示,与CON组相比,ANFMT组小鼠unclassified、Faecalibaculum上升,Muribaculum、Candidatus_Saccharimonas、理研菌属(Rikenella)、Odoribacter、Mucispirillum、Lachnospiraceae_unclassified下降,差异均有统计学意义(P值均<0.05)。与CON组相比,MOD组小鼠Akkermansia属、Erysipelatoclostridium上升,Dubosiella、Duncaniella下降,差异均有统计学意义(P值均<0.05)。与MOD组相比,FMT组小鼠Paramuribaculum、嗜胆菌属(Bilophila)上升,Rikenella、Absiella下降,差异均有统计学意义(P值均<0.05)。
2.3.5 各组菌群差异 LEfSe(LDA Effect Size)差异分析旨在找到不同组间丰度上有显著性差异的物种。根据LDA值大小(LDA>4),在门属水平上,MOD组中Fimicutes占优势;ANFMT组中Dubosiella占优势,CON组中奈瑟菌属(Neisseria)占优势(图12)。

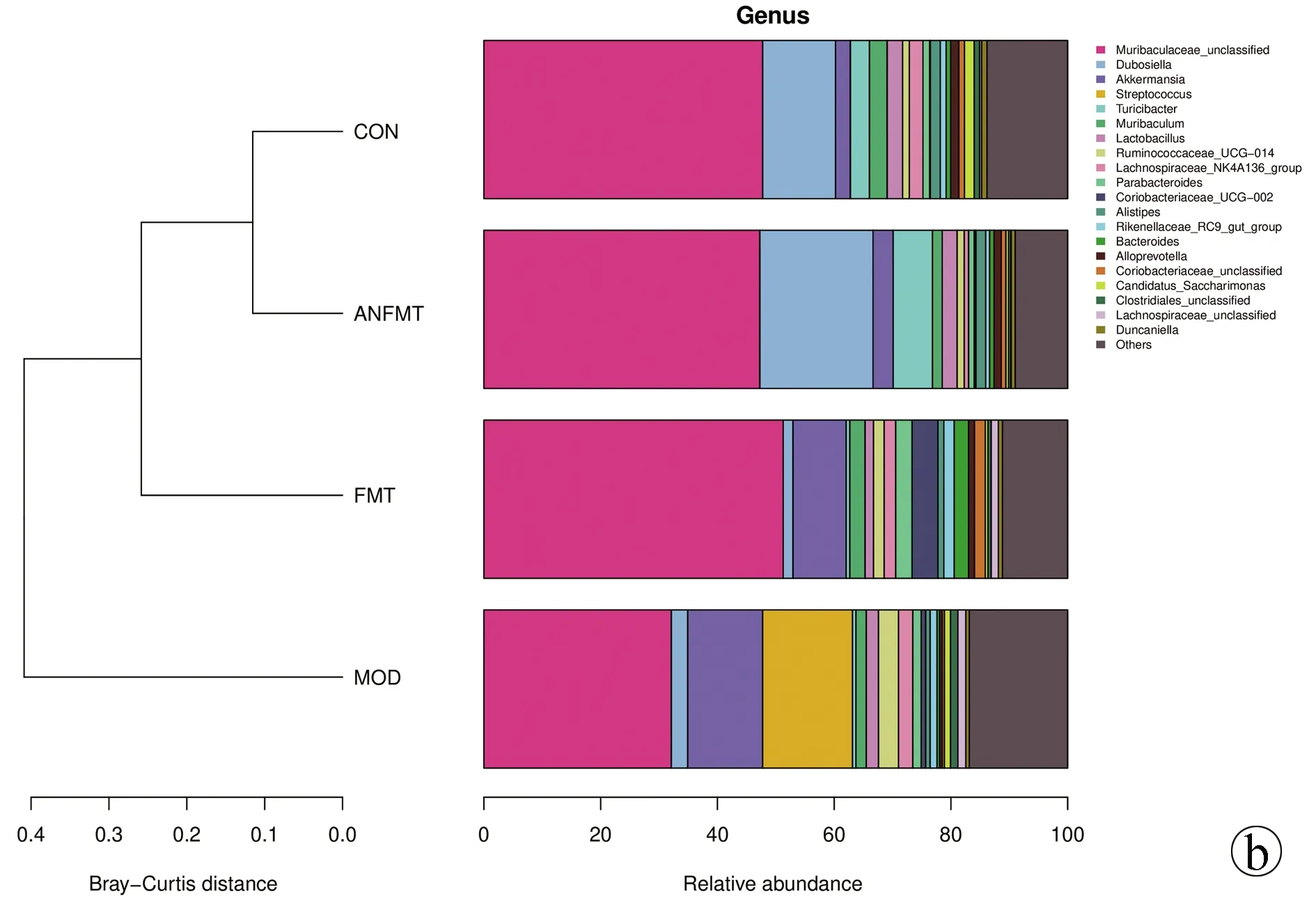
注: a,属水平柱状图;b,样品聚类分析图。图10 四组菌群属水平分布情况
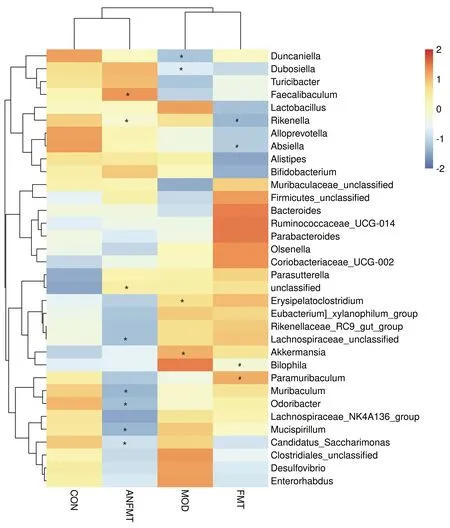
注:与CON组相比,*P<0.05;与MOD组相比,#P<0.05。
3 讨论
肠道微生物群定居于人类肠道,肠道细菌数量超过100万亿,其复杂基因组比人类基因组多150倍[9]。肠肝轴为肠道与肝脏之间形成解剖和功能上的紧密联系。一方面细菌或代谢物进入门静脉血循环,与免疫细胞相互作用,到达肝脏微循环,与非实质性和实质性肝细胞相互作用。另一方面,肝脏还分泌胆汁酸,胆汁酸反过来改变肠道微生物群,同时也作为肝脏、肠道微生物群和肠道之间的信号分子[10]。
目前,ACLF仍有较高的发病率与病死率。肝硬化患者一旦发生急性失代偿,15%的住院患者将进一步发展为ACLF,其中40%将在90天内死亡[11]。Qin等[10]认为健康对照者相比,肝硬化患者肠道微生物拟杆菌门与厚壁菌门水平降低,而链球菌属和韦荣球菌属升高,微生物群的变化是随着肝硬化的发展而发生的。最近Bajaj等[12]的研究证实了肠道微生物与肝硬化之间的联系,该研究表明,在1例严重肝硬化患者肝移植后,肠道微生物的多样性和共生性显著提高。在另一篇文献中,Bajaj等[13]研究认为通过饮食获得的不同肠道微生物与肝硬化的进展和住院风险有关。Chen等[2]发现肠道微生物组成变化与肝病的严重程度相关,与ACLF患者发病前相比,ACLF患者拟杆菌门、瘤胃菌科、紫单胞菌科、毛螺旋菌科水平下降,而厚壁菌门水平上升。有足够的证据[14-16]表明,微生物群的变化会影响肝病的进展。
由于人和鼠存在的异源性,本研究选取小鼠粪便作为粪菌群供体,而非人类粪便。结果显示,在进行粪菌移植时,FMT组与ANFMT组小鼠体质量均出现下降,可能与菌群定植反应有关;与CON组小鼠相比,MOD组小鼠体质量明显下降,肝细胞大片坏死,造模成功。FMT组小鼠肠道菌群改善,体质量恢复,ALT、AST明显降低,肝细胞坏死减轻,从而进一步说明了改善肠道菌群对ACLF小鼠具有保护作用。ANFMT组小鼠AST明显升高,肝细胞轻微气球样变和炎性细胞浸润,说明菌群紊乱导致肝损伤;而同时MOD组小鼠肝损伤引起菌群改变,可见肝脏与肠道菌群互为因果。
Zhang等[17]研究发现因给予大肠杆菌、鼠伤寒上门氏菌和肠球菌出现菌群失调从而导致肝硬化大鼠细菌易位和AST水平显著增高。LPS通过CD14、Toll-样受体4、核因子κB和TNFα信号通路以及其他信号通路诱导肝细胞凋亡[18]。然而,LPS主要通过Kupffer细胞在肝脏中清除,因此肝衰竭直接导致的Kupffer细胞功能障碍可能导致血浆LPS异常。Kupffer细胞功能状态与肝损伤程度之间存在相关性[19]。 当肝功能受损时,持续的免疫激活、炎症、Kupffer细胞功能受损和不受控制的内毒素血症可引起活性氧(ROS)刺激[20-21]。由于内毒素血症、免疫功能紊乱和Toll样受体4介导的炎症,导致肠道细菌过度生长[22]。总之,肠道菌群失调可通过以下机制加速ACLF的进展[23-24]:(1)肠道通透性增加和肠道细菌易位增强;(2)菌群失调的微生物促进炎症反应,导致了黏膜损伤。虽然肠道微生物在ACLF的发病机制和并发症中的作用尚不完全清楚,但这些发现为通过调节肠道微生物来治疗ACLF提供了希望。
综上所述,ACLF小鼠会出现肠道菌群失调,而FMT可以调节肠道菌群,减轻肝损伤,对ACLF小鼠具有保护作用。干扰正常小鼠的肠道微生态后,菌群失调会进一步导致肝损伤。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:高安负责课题设计,实施研究,资料分析,撰写论文;徐玉静、陆圣威参与收集及分析数据;孙蔚负责拟定写作思路,修改论文;甘建和负责指导撰写文章并最后定稿。
