理性设计降低碱性蛋白酶的胶原降解活力
2021-06-22李家霖朱宝悦刘佳萌刘逸寒路福平
李 玉,李家霖,朱宝悦,刘佳萌,刘逸寒,路福平
(天津科技大学生物工程学院,天津300457)
蛋白酶是一种具有复杂结构与功能的水解酶,能够裂解肽键产生短肽或氨基酸[1].按照最适pH的不同,蛋白酶可分为3种类型:酸性蛋白酶,最适pH为2.0~5.0,主要来源于真菌;中性蛋白酶,最适pH为7.0,主要来源于植物;碱性蛋白酶,最适pH为8.0及以上[2],主要来源于微生物.蛋白酶作为最重要的工业酶制剂之一,销售额占所有酶制剂销售量的60%以上,在洗涤剂、医药、食品、皮革、丝绸、摄影等领域有着广泛的应用[1,3-5].
在皮革工业中,脱毛是皮革加工的主要步骤,即去除皮革上的毛发、表皮、非胶原蛋白和其他黏合物质[6].传统的脱毛工艺使用的是硫化钠,产生的大量含硫废弃物导致了严重的污染问题[7-8],此外,在制革鞣前准备中,大量的化工材料添加也造成了严重的环境隐患.目前,使用酶制剂代替化学品进行清洁化生产的相关应用在制革中受到越来越多的关注[9-10].其中,蛋白酶作为脱毛工艺中硫化钠的环境友好型替代品,已在皮革工业中应用.Dayanandan等[11]利用塔马里曲霉(Aspergillus tamarii)来源的蛋白酶在pH 9~11、温度30~37℃、酶质量分数1%、孵育时间18~24h的条件下对羊皮进行了脱毛,该方法显著降低了脱毛过程中的五日生化需氧量(BOD5,50%)、化学需氧量(COD,40%)、溶解性总固体(TDS,60%)和悬浮性总固体(TSS,20%).然而,由于传统蛋白酶中的胶原降解蛋白酶活力较强,在应用过程中对皮胶原易造成损伤,导致松面、烂面等现象出现,极大降低了经济效益,造成了蛋白酶在皮革工业中的应用局限性[12-13].因此,开发一种适合皮革加工的、具有低胶原水解活性的蛋白酶能够提高其在使用过程中的安全性,具有较高的应用需求与实践价值.
由于克劳氏芽胞杆菌来源的碱性蛋白酶可以水解毛发,因此胶原蛋白水解能力也较高,造成在皮革工业中的应用受限.本研究以克劳氏芽胞杆菌来源的碱性蛋白酶(PRO)为研究对象,通过理性设计工具设计突变库对PRO进行改造,以期获得低胶原降解活力的蛋白酶突变体,旨在进一步提高该酶在皮革工业中的应用价值.
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
枯草芽胞杆菌(Bacillus subtilis)WB600、解淀粉芽胞杆菌(Bacillus amyloliquefaciens)、质粒pLY2-PRO均为本实验室保存.
1.1.2 主要试剂及培养基
KOD-Plus点突变试剂盒,TOYOBO公司;质粒快速提取试剂盒,Omega 公司;蛋白胨和酵母浸粉,Oxoid公司;Ⅰ型胶原(可溶),Solarbio公司;其他试剂均为国产分析纯.
LB培养基(g/L):胰蛋白胨10,酵母提取物5,NaCl 10,121℃高压蒸汽灭菌 20min.
发酵培养基(g/L):玉米淀粉64,豆类淀粉40,NaH2PO44,K2HPO40.3,高氏淀粉酶0.7,90℃保温30min,121℃高压蒸汽灭菌20min.
1.2 方法
1.2.1 PRO突变体的构建及表达
克劳氏芽胞杆菌来源的碱性蛋白酶(PRO)的晶体结构已在1998年得到了解析(PDB:1GCI)[14].通过突变设计软件HotSpot Wizard 3.0[15]设计突变库.
本实验室前期已经克隆了克劳氏芽胞杆菌碱性蛋白酶基因pro,并将其插入到pLY2载体中,构建了重组质粒pLY2-PRO[16].设计突变体引物(表1),通过KOD-Plus点突变试剂盒,以pLY2-PRO质粒为模板,经反向PCR引入突变位点构建重组质粒,转入枯草芽胞杆菌WB600,涂布于卡那霉素抗性平板,挑取转化子扩大培养后提取质粒进行测序验证.测序正确的重组质粒参照杨连[17]的方法转入解淀粉芽胞杆菌中.将重组菌株以2%的接种量接种到发酵培养基中,37℃、220r/min培养48h.取2mL菌液12000 r/min离心2min,取上清液用于聚丙烯酰胺凝胶电泳(SDS-PAGE)检测及酶活力测定.

表1 实验所用引物 Tab. 1 Primers used in this study
1.2.2 蛋白酶活力测定
碱性蛋白酶活力测定根据GB/T 23527—2009方法,每组以1个试管为对照组,其余3个试管为实验组.在所有试管中,加入1mL用硼酸缓冲液(pH 10.5)配制的1%的酪素溶液,并将试管在40℃保温2min.向对照组试管中加0.4mol/L三氯乙酸2mL,向实验组试管中加入1mL适当稀释的酶液,40℃反应10min.反应后对照组试管加入1mL酶液,实验组试管加入0.4mol/L三氯乙酸溶液2mL终止反应.分别从各试管中取1mL反应液,12000r/min离心1min,取0.5mL上清液于新的试管中,加入2.5mL碳酸钠、0.5mL福林试剂,40℃显色20min,在680nm处测定吸光度.酶活力定义为在40℃下每分钟水解酪蛋白产生1µg酪氨酸所需的酶量.
胶原蛋白降解活力测定根据Rosen法,每组以1个试管为对照组,其余3个试管为实验组.在所有试管中,加入1mL用硼酸缓冲液(pH 10.5)配制的5mg/mL Ⅰ型胶原溶液,并将试管在40℃保温2min.向对照组试管中加0.4mol/L三氯乙酸2mL,向实验组试管中加入1mL适当稀释的酶液,40℃反应10min.反应后对照组试管加入1mL酶液,实验组试管加入0.4mol/L三氯乙酸溶液2mL终止反应.分别从各试管中取1mL反应液,12000r/min离心1min,取0.5mL上清液于新的试管中,加入0.5mL乙酸-乙酸钠溶液(pH 5.4)、0.5mL茚三酮溶液,煮沸10min,冷却后加入4.5mL 60%乙醇溶液,混匀,在570nm处测定吸光度.酶活力定义为在40℃下每分钟水解Ⅰ型胶原产生1µg甘氨酸所需的酶量.
1.2.3 PRO突变体酶学性质测定
分别使用pH 7~9的磷酸盐缓冲液(50mmol/L)和pH 10~12的硼酸缓冲液(50mmol/L)配制酪素溶液,测定40℃时不同pH条件下的酶活力.以最高酶活力为100%,计算不同pH下的相对酶活力,确定最适pH.
将酶液置于40℃的条件下,在7.0、8.0、9.0、10.0和11.0的缓冲液中孵育20h后,测定残余酶活力.以未孵育的酶活力为100%,计算不同pH孵育后的残余酶活力,测定pH稳定性.
在最适pH环境下,分别测定30、40、50、60、70、80℃条件下的酶活力,以最高酶活力为100%,计算不同温度下的相对酶活力,确定最适温度.
将酶液置于最适pH缓冲液中,在不同温度条件下保温20h后,测定残余酶活力.以未孵育的酶活力为100%,计算不同温度孵育后的残余酶活力,测定热稳定性.
2 结果与分析
2.1 PRO突变点的选择及突变库构建
野生型PRO结构中Gly97-Gly102loop区域在其催化三联体Asp-His-Ser附近(图1),通过分子动力学模拟发现(数据未显示),Gly97-Gly102loop区域会与底物分子接触并相互作用,从而影响PRO的催化功能.
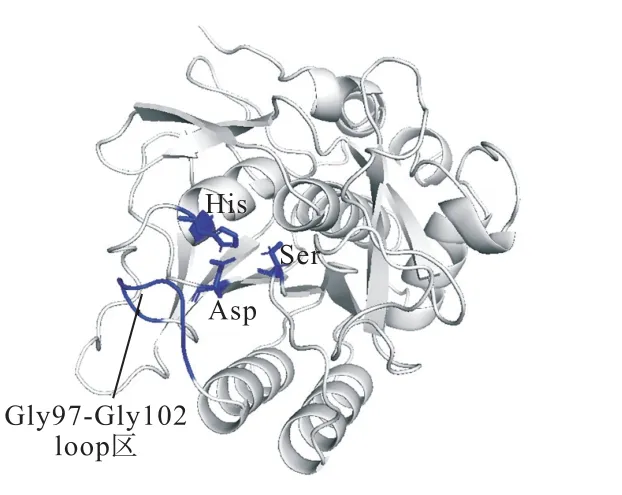
图1 PRO的三维结构 Fig. 1 Three-dimensional structure of PRO
以RCSB数据库PDB:1GCI为输入文件,运用HotSpot Wizard 3.0设计了 PRO 位于 Gly97-Gly102loop区的突变库.利用突变引物和KOD-Plus点突变试剂盒在pLY2-PRO质粒的pro基因处引入突变,成功构建pLY2-G97E等31个重组质粒(表2).将重组质粒转入枯草芽胞杆菌WB600中进行扩增及甲基化修饰.

表2 重组质粒 Tab. 2 Recombinant plasmid
2.2 PRO突变体在解淀粉芽胞杆菌中的表达
将测序正确的重组质粒转入解淀粉芽胞杆菌,对重组菌株进行发酵表达,菌液离心后取上清液为粗酶液.将粗酶液置于截留相对分子质量为1.0×104的超滤管中,3800g离心30min,取浓缩液用于SDSPAGE检测,结果如图2所示.在相对分子质量为3.0×104处出现一个明显的单一蛋白条带,与目的蛋白理论大小相符,证明PRO突变体在解淀粉芽胞杆菌中成功分泌表达,且经超滤后纯度较高,可用于后续分析和研究.
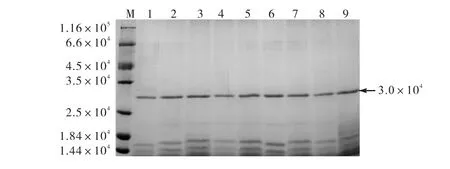
图2 部分PRO突变体的SDS-PAGE分析 Fig. 2 SDS-PAGE analysis of partial PRO mutant
2.3 PRO突变库的筛选
将浓缩液稀释适当倍数后,分别测定PRO突变体的碱性蛋白酶活力及胶原蛋白降解活力.以野生型(WT)PRO的碱性蛋白酶活力和胶原蛋白降解活力为100%,计算各突变体的碱性蛋白酶相对活力和胶原蛋白降解相对活力,结果如图3所示.
与野生型PRO的碱性蛋白酶活力和胶原蛋白降解活力相比,大部分突变体碱性蛋白酶活力与胶原蛋白降解活力下降幅度无显著差异,G97M、S99G、S99M和S99P等突变体的胶原蛋白降解活力下降幅度显著低于碱性蛋白酶活力的下降幅度,仅G97E突变体的胶原蛋白降解活力下降幅度显著高于碱性蛋白酶活力的下降幅度.G97E突变体的碱性蛋白酶活力和胶原蛋白降解活力分别为野生型PRO的91.97%和65.84%,碱性蛋白酶活力损失在10%以内,而胶原蛋白降解活力降低了三分之一以上,表明G97E突变体在几乎不损失蛋白酶活力的情况下,显著降低了对于胶原蛋白的水解能力.
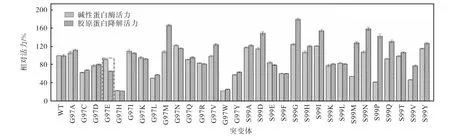
图3 PRO突变体的碱性蛋白酶相对活力及胶原蛋白降解相对活力 Fig. 3 The alkaline protease relative activity and collagen degradable relative activity of PRO mutant
2.4 G97E突变体的酶学性质
为了探究突变位点Gly97Glu对突变体G97E酶学性质的影响,对G97E及野生型(WT)PRO的酶学性质进行了测定,结果如图4与图5所示.
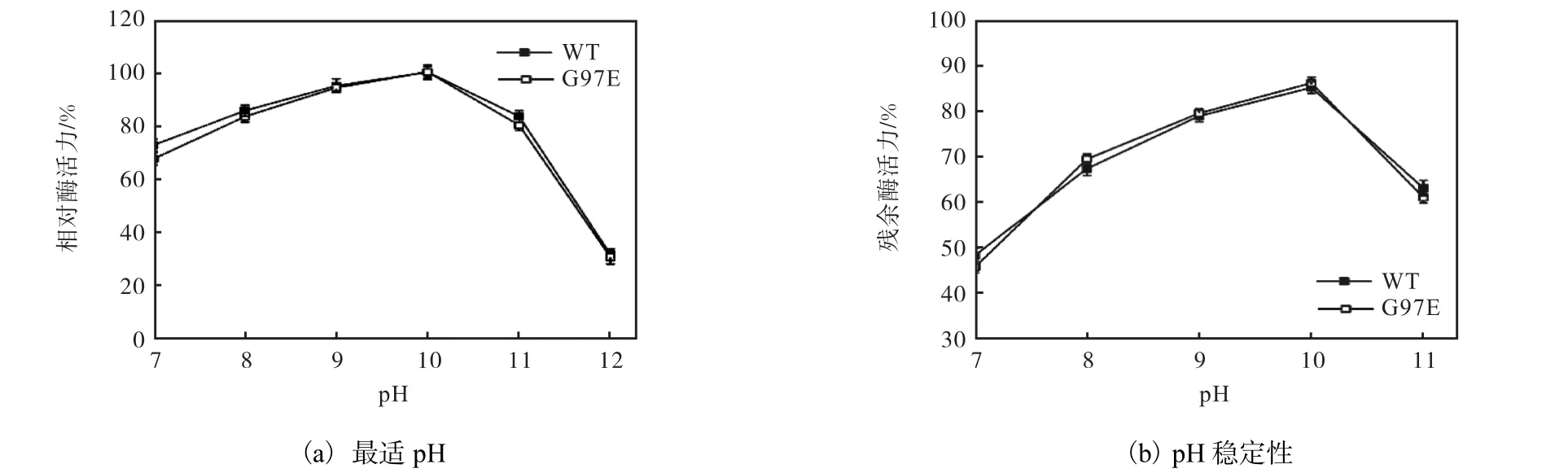
图4 pH对野生型PRO和G97E酶学性质的影响 Fig. 4 Effect of pH on the properties of wild-type PRO and G97E
与野生型PRO相似,G97E突变体最适pH为10.0,在pH 7~12的范围内,G97E与野生型PRO的相对酶活力无明显差异(图4(a)).由图4(b)可知,在pH 7~11和40℃条件下保温20h后,G97E的残余酶活力为初始酶活力的46%、69%、79%、86%和61%,而野生型PRO保留了初始酶活力的48%、67%、79%、85%和63%.野生型PRO和G97E的残余酶活力差异不明显,表明突变位点Gly97Glu对于G97E的最适pH及pH稳定性的影响不显著.
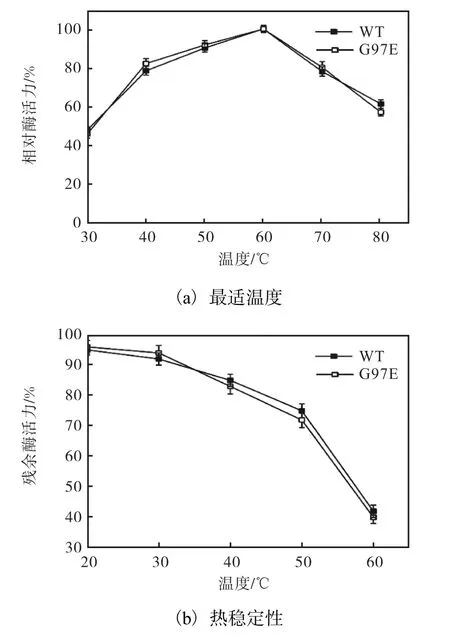
图5 温度对野生型PRO和G97E酶学性质的影响 Fig. 5 Effect of temperature on the properties of wildtype PRO and G97E
由图5(a)可知,G97E和野生型PRO的最适温度约为60℃,在30~80℃范围内,G97E与野生型PRO的相对酶活力无明显差异.由图5(b)可知,在20、30、40、50℃和60℃以及pH 10.0条件下保温20h后,G97E的残余酶活力分别为96%、94%、83%、72%和40%,而野生型PRO的残余酶活力分别为95%、92%、85%、75%和42%.野生型PRO和G97E的残余酶活力差异不明显,表明突变位点Gly97Glu对于G97E的最适温度及热稳定性的影响不显著.
3 结 论
运用HotSpot Wizard 3.0构建了克劳氏芽胞杆菌来源的碱性蛋白酶的突变库,经筛选得到了碱性蛋白酶活力和胶原蛋白降解活力分别为野生型PRO 91.97%和65.84%的G97E突变体.G97E在基本不损失蛋白酶活力的情况下,胶原蛋白降解活力显著降低,在应用于皮革脱毛时能够降低皮革中胶原蛋白的损伤,从而为其在皮革工业的应用奠定了基础.此外,G97E突变体的温度稳定性和pH稳定性均没有降低,使其在工业应用时能够在较长的时间内保持酶活力,进一步提高了其在皮革工业中的应用价值.
