人参茎叶皂苷和硒溶液(GSe)增强猪伪狂犬病疫苗免疫反应
2021-06-21袁丽佳胡松华
王 勇,袁丽佳,胡松华
(浙江大学 动物科学学院,浙江 杭州 310058)
伪狂犬病(pseudorabies,PR)是由伪狂犬病病毒(PRV)所引起的动物传染病,PRV属于疱疹病毒科、α疱疹病毒亚科、猪疱疹病毒属。PRV对养猪业危害极大,成年猪呈隐形感染,长期带毒排毒,这是导致PR长期流行、难以根除的重要原因,严重影响猪场的产能和效益,是制约我国养猪业健康发展的重要疾病之一。接种疫苗是防控该病的重要措施。我国将PR列入优先防制的动物疫病之一[1-3]。然而,在生产中,有些PR疫苗的免疫效果差,不能诱导动物产生有效的免疫反应,导致PR在一些猪场得不到有效控制[4]。因此,寻求提高猪PR疫苗免疫效果的方法,对临床上控制PR具有重要意义。
人参茎叶皂苷(GSLS)是一种从人参的茎和叶中获得的提取物。研究表明,GSLS对多种动物疫苗如口蹄疫疫苗、鸡新城疫疫苗、H5N1禽流感灭活疫苗和PR弱毒疫苗等具有免疫增强作用[5-7]。以GSLS为主要成分的人参茎叶总皂苷颗粒已由农业农村部批准为新兽药((2017)新兽药字证20号)上市[8]。硒(Se)作为一种微量元素,具有增强机体免疫的作用,广泛应用在畜牧业生产中[9-10]。BABAR等[11]研究发现,给小鼠口服GSLS后接种添加了Se的PR疫苗能显著提高疫苗的免疫效果。为了进一步丰富和优化GSLS和Se在临床上的应用,本试验以小鼠为模型,研究一种含GSLS和Se的GSe溶液对PR疫苗的免疫增强作用,并探讨其作用机理,为临床上提高动物的抗病力提供依据。
1 材料与方法
1.1 实验动物ICR小鼠,雌性,6~8周龄,购自上海斯莱克实验动物有限责任公司。小鼠自由采食与饮水,饲养于IVC独立送风饲养笼具,室内条件为温度(25±1)℃,湿度50%±10%。小鼠于试验开始前适应性饲养1周。
1.2 细胞、病毒和疫苗小鼠巨噬细胞系RAW 264.7由浙江大学动物科学学院中兽医研究室保存;伪狂犬病病毒野毒株(fPRV),由浙江省农业科学院惠赠;PR疫苗购自武汉科前生物股份有限公司。
1.3 主要试剂和药品猪PRV gB抗体检测试剂盒购自美国IDEXX公司;胎牛血清购自浙江天杭生物科技股份有限公司;人参茎叶皂苷(GSLS)购自吉林宏久生物科技股份有限公司;亚硒酸钠(Na2SeO3,Se)购自上海今品化学技术有限公司;刀豆蛋白(ConA)、脂多糖(LPS)和MTT购自Sigma公司;DMEM培养基、1640培养基、Hank’s液、胰酶消化液(0.25% 胰酶 + 0.02% EDTA)购自杭州吉诺生物医药有限公司;HRP标记山羊抗小鼠IgG1、IgG2a抗体购自Santa Cruz公司;红细胞裂解液购自北京索莱宝生物科技有限公司;FITC标记的CD40 (Clone:HM40-3)、CD80 (Clone:16-10A1) 和CD86 (Clone:GL1)流式抗体购自ebioscience公司;小鼠 IL-2、IL-4、IL-6、IL-10、TNF-α和IFN-γ ELISA检测试剂盒购自杭州联科生物科技有限公司。
1.4 GSe注射次数对PR疫苗诱导抗体水平的影响将小鼠随机分为8组,每组6只,第1~3组小鼠免疫PR疫苗前,分别肌肉注射0.2 mL GSe溶液(6 μg GSLS + 2 μg Se)1,2,3次;第4~6组小鼠免疫PR疫苗前,分别肌肉注射等量的生理盐水1,2,3次;第7,8组小鼠分别为PR疫苗对照组和空白对照组。每只小鼠每次免疫稀释100倍的PR疫苗0.1 mL(下同),免疫2次,间隔2周二免,于二免后2周对小鼠进行眼眶静脉丛采血,分离血清,使用ELISA检测试剂盒检测血清中gB抗体水平。
1.5 GSe注射剂量对PR疫苗诱导抗体水平的影响将小鼠随机分为5组,每组6只,第1~3组小鼠免疫PR疫苗前,分别肌肉注射质量浓度为(30 mg/L GSLS + 10 mg/L Se)的GSe溶液 0.1,0.2,0.3 mL;第4,5组小鼠分别为PR疫苗对照组和空白对照组。每只小鼠免疫2次,间隔2周二免,于二免后2周对小鼠进行眼眶静脉丛采血,分离血清,使用ELISA检测试剂盒检测血清中gB抗体水平。
1.6 动物分组及免疫将小鼠随机分为3组,每组6只,第1组小鼠免疫PR疫苗前,肌肉注射1次GSe溶液0.2 mL(30 mg/L GSLS + 10 mg/L Se),第2,3组小鼠分别为PR疫苗对照组和空白对照组。每只小鼠免疫2次,间隔2周二免,于二免后1,2,3周对小鼠进行眼眶静脉丛采血,分离血清,使用ELISA检测试剂盒检测血清中gB抗体及其亚类水平。二免后3周分离脾脏,制备脾淋巴细胞,检测淋巴细胞增殖反应和细胞因子水平。
1.7 gB抗体及其亚类检测按ELISA检测试剂盒说明检测血清中特异性PRV gB抗体水平。使用同样的ELISA检测试剂盒,向试剂盒包被板中加入100 μL/孔的待检测血清(1∶2稀释),室温条件下孵育60 min,洗涤液洗板3~5次,将板拍干,每孔加入100 μL HRP标记的山羊抗鼠IgG1或IgG2a抗体(1∶1 000),37℃孵育60 min;洗涤液洗板3~5次,将板拍干,每孔加入100 μL TMB底物溶液,室温条件孵育15 min后每孔加入50 μL终止液,在酶标仪上测定D450 nm值。
1.8 攻毒保护试验小鼠加强免疫后2周,腹腔注射致死剂量的fPRV(5×105TCID50),连续观察10 d,并记录小鼠临床症状和死亡情况。
4月18日,水利部抗震救灾前方领导小组组长、青海省水利厅抗震救灾前线指挥部总指挥于丛乐厅长、副总指挥张世丰、张伟副厅长分别带领抢险分队深入一线,详查供水设施、禅古电站安全隐患,巡查巴塘河、扎西科河两岸滑坡淤塞河道情况,研究应急供水和禅古电站水库大坝应急处置方案。
1.9 淋巴细胞增殖试验将小鼠断颈处死,于75%酒精浸泡5 min;无菌条件下分离脾脏,加入5 mL完全Hank's液,使用研钵研磨后过200目铜网,滤液离心(1 500 r/min,10 min),弃上清,向底物中加入3 mL红细胞裂解液,轻轻振荡混匀;4℃静止3 min,1 500 r/min离心5 min,弃上清,向沉淀物中加入3 mL RPMI-1640完全培养基,重悬后进行细胞计数,并调整细胞浓度至5×106个/mL,加入到96孔细胞培养板中,100 μL/孔。随后,分别使用5 mg/L Con A、5 mg/L LPS和5×105TCID50/mL灭活fPRV (水浴56℃灭活30 min)抗原刺激小鼠脾淋巴细胞,在恒温培养箱中37℃、5% CO2培养44 h,向每孔中加入20 μL MTT(5 g/L)后继续培养4 h后,离心培养板(1 800 r/min 10 min)并小心弃掉上清液,每孔加入150 μL DMSO,避光振荡溶解结晶后置于酶标仪上测量D570 nm。刺激指数(SI)的计算公式如下:SI=(刺激孔D值-空白孔D值)/(未刺激孔D值-空白孔D值)。
1.10 细胞因子检测按1.9方法收集脾细胞,调整细胞浓度至5×106个/mL,5×105TCID50/mL灭活fPRV (水浴56℃灭活30 min)抗原刺激小鼠脾淋巴细胞,于37℃、5% CO2细胞培养箱中培养48 h后,收集上清液,按ELISA试剂盒说明书操作步骤,检测IFN-γ、IL-2、IL-4、IL-6和IL-10的分泌水平。
1.11 GSe对巨噬细胞的影响将巨噬细胞RAW 264.7按5×105个/孔加到24孔培养板中,在37℃、5% CO2条件下培养24 h后,使用GSe(60 μg/L GSLS + 20 μg/L Se)和LPS(100 μg/L)刺激细胞;只加DMEM完全培养基的为细胞对照组,在37℃、5% CO2条件下培养24 h后,离心收集细胞上清液,使用ELISA检测试剂盒测定细胞因子IL-6、IL-10和TNF-α水平。收集细胞,使用1% BSA-PBS将细胞洗2次后,用CD16/CD32抗体阻断FcR 10 min,并将细胞用FITC标记的CD40、CD80 和 CD86避光条件下染色30 min。染色结束后,1 500 r/min 离心8 min, 收集细胞,将细胞用PBS重悬后,上机检测细胞表面共刺激分子的表达水平。

2 结果
2.1 注射不同次数的GSLS-Se对PR疫苗诱导抗体反应的影响由图1A可知, 与PR疫苗组和免疫前注射生理盐水组相比,PR疫苗免疫前分别肌肉注射0.2 mL含6 μg GSLS + 2 μg Se的GSe溶液1,2,3次(0.2 mL·次-1·d-1)均能显著提高二免后2周小鼠血清中PRV特异性gB抗体水平(P<0.05)。

图1 注射不同次数(A)和不同剂量(B)GSLS-Se对PR疫苗抗体反应的影响
2.2 注射不同剂量GSLS-Se对PR疫苗诱导抗体反应的影响由图1B可知,与PR疫苗组相比,PR疫苗免疫前分别肌肉注射0.1,0.2 mL GSe溶液(30 mg/L GSLS+10 mg/L Se),能够显著提高小鼠血清中PRV特异性gB抗体水平(P<0.05),当注射体积为0.3 mL时, gB抗体水平只是较疫苗对照组在数值上有所提高(P>0.05)。
2.3 GSe提高小鼠血清特异性PRV gB抗体及其亚类水平由图1结果可知,确定免疫前给小鼠肌肉注射1次GSe溶液(0.2 mL含6 μg GSLS+2 μg Se的溶液)为最终注射方案。由图2A~C可知,与疫苗组相比,免疫前注射GSe溶液(GSe/pre-PR)能诱导小鼠产生更高水平的血清PRV特异性IgG及其亚类(P<0.05)。
2.4 GSe提高PR疫苗免疫小鼠的攻毒保护作用在攻毒试验中,攻毒fPRV后48 h,空白对照和GSe对照组小鼠首先出现啃咬后背、瘙痒、抽搐、共济失调和瘫痪等明显的神经症状,并在攻毒后60~72 h全部死亡。疫苗对照组小鼠在攻毒后60~72 h开始死亡,最终小鼠存活率为40%(4/10),这一结果低于GSe/pre-PR组小鼠的70%(7/10)(图2D)。
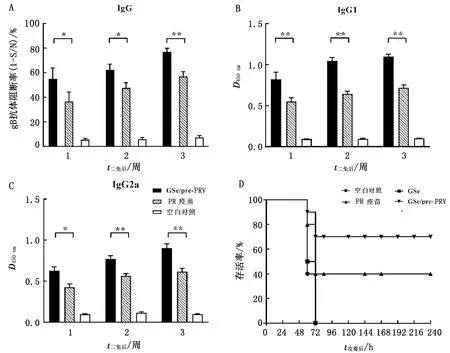
图2 GSe对PRV 特异性IgG及其亚类水平(A~C)和免疫小鼠攻毒后生存率(D)的影响
2.5 GSe增强免疫小鼠脾淋巴细胞增殖反应能力由图3知,与PR疫苗组相比,GSe/pre-PR组小鼠脾淋巴细胞经ConA、LPS和PRV抗原刺激后的增殖能力显著提高(P<0.05)。
2.6 GSe提高免疫小鼠脾淋巴细胞细胞因子水平由图4可知,与PR疫苗组相比,GSe/pre-PRV能够显著增强免疫小鼠脾淋巴细胞经PRV抗原刺激后Th1型(IFN-γ和IL-2)和Th2型(IL-4、IL-6、IL-10)细胞因子的分泌能力(P<0.05)。

A.ConA;B.LPS;C.PRV

图4 GSe/pre-PR对小鼠脾淋巴细胞细胞因子水平的影响
2.7 GSe增强巨噬细胞细胞因子分泌水平由图5可知,与细胞对照组相比,当使用含60 μg/L GSLS和20 μg/L Se的GSe刺激RAW264.7细胞24 h后,细胞因子IL-6、IL-10和TNF-α的分泌水平显著提高(P<0.05)。

图5 GSe对巨噬细胞RAW264.7细胞因子分泌的影响
2.8 GSe提高巨噬细胞表面共刺激分子的表达水平由图6可知,与细胞对照组相比,当使用含60 μg/L GSLS和20 μg/L Se的GSe刺激巨噬细胞RAW264.7 24 h后, GSe能够显著提高细胞表面共刺激分子CD40、CD80和CD86的表达水平(P<0.05)。
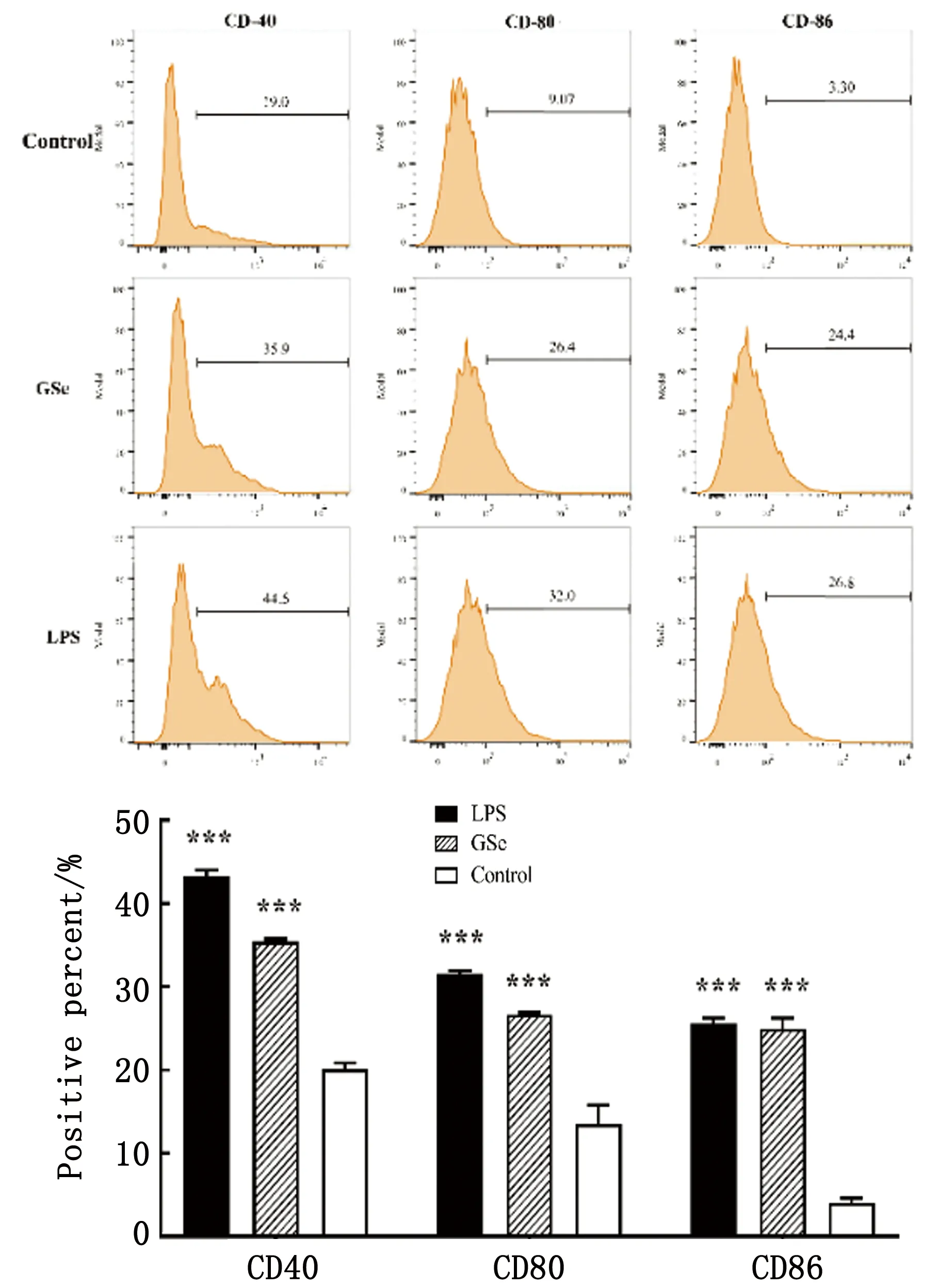
图6 GSe对巨噬细胞RAW264.7细胞表面共刺激分子表达的影响
3 讨论
体液免疫在宿主防御PRV过程中发挥着重要的作用[12]。作为一种PRV囊膜表面的糖蛋白,gB能够有效诱导机体产生具有保护性的抗体,可作为评价接种PR疫苗后诱导产生的体液免疫水平[13]。本试验中,GSe溶液能够显著提高免疫小鼠血清gB抗体及其亚类(IgG1和IgG2a)水平,说明GSe能增强PR疫苗诱导产生的体液免疫水平。细胞免疫在机体抗病毒免疫中发挥着至关重要的作用。通常,淋巴细胞增殖反应和细胞因子水平可作为评价细胞免疫水平的指标。对淋巴细胞而言,Con A主要刺激T细胞,LPS主要刺激B细胞[14]。本研究结果显示,与对照组相比,GSe/pre-PR能显著提高脾淋巴细胞对Con A、LPS和PRV抗原刺激后的增殖能力。细胞因子在Th细胞分化过程中起重要作用,可诱导Th细胞分化产生Th1和Th2型等细胞因子。其中,Th1型免疫主要产生IFN-γ、IL-2、IL-12和IgG2a,Th2型主要产生IL-4、IL-5、IL-6、IL-10和IgG1[15]。本研究结果显示,GSe/pre-PR能够显著提高小鼠淋巴细胞Th1型(IFN-γ、IL-2)和Th2型(IL-4、IL-6、IL-10)细胞因子水平,说明GSe/pre-PR能够提高小鼠Th1/Th2型细胞免疫水平。此外,攻毒试验是评价疫苗对机体保护力的重要指标。在本试验中,GSe/pre-PR组小鼠攻毒后的最终存活率为70%,高于PR疫苗组的40%。综上说明,GSe溶液能同时提高PR疫苗诱导动物产生有效的体液免疫和细胞免疫水平。
作为一种抗原提呈细胞(APC),巨噬细胞是连接固有免疫和适应性免疫的重要免疫细胞。T细胞经“MHC-抗原肽-TCR”作为第一信号刺激后,还需APC表面的共刺激分子如CD40、CD80、CD86等作为第二信号刺激后才能活化[16]。活化的T细胞可促进APC活化并表达更多的共刺激分子,进一步促进T细胞活化和增殖[17]。激活的巨噬细胞可分为M1型和M2型,M1型细胞分泌IL-6和TNF-α等促炎细胞因子参与Th1型免疫;M2型细胞主要发挥免疫调节作用,可分泌抗炎细胞因子IL-10、TGF-β和一些趋化因子,促进Th2型细胞免疫应答反应[18]。本研究结果显示,GSe能通过提高IL-6、IL-10和TNF-α的分泌水平来促进RAW264.7细胞的活化,说明GSe能够同时激活M1和M2型巨噬细胞。此外,GSe可通过提高CD40、CD80和CD86的表达水平增强巨噬细胞的抗原提呈能力。由此说明, GSe溶液对PR疫苗的免疫增强作用与其提高巨噬细胞的活性有关,而GSe能同时诱导动物产生Th1和Th2型免疫应答反应,很可能与GSe能诱导平衡的M1/M2巨噬细胞分化相关。
本试验结果表明,GSe溶液能提高小鼠对PR疫苗的体液和细胞免疫应答水平,并增强免疫动物对PRV的抵抗能力。同时,GSe可通过提高巨噬细胞细胞因子水平和抗原提呈能力发挥其免疫增强作用。但GSe溶液在临床上如何提高动物抵抗疫病方面还有待进一步研究。
