狂犬病病毒(RABV)感染小鼠原代神经元细胞对Bif-1蛋白表达的影响
2021-06-21李武建金宏丽焦翠翠时智康伊淑帅闫飞虎赵永坤高玉伟杨松涛王化磊夏咸柱
李武建,金宏丽,焦翠翠,时智康,张 颖,黄 培,伊淑帅,闫飞虎,赵永坤,高玉伟,杨松涛*,王化磊*,夏咸柱
(1.吉林大学 动物医学学院,吉林 长春 130062;2.军事医学研究院 军事兽医研究所 吉林省人兽共患病预防与控制重点实验室,吉林 长春 130122;3.吉林农业大学 动物科学技术学院,吉林 长春 130118;4.东北林业大学 野生动物与自然保护地学院,黑龙江 哈尔滨 150040)
Bif-1(Bax-interacting factor-1)又称Endophilin-B1,是CUDDEBACK等[1]在2001年发现的一种新的Bax绑定蛋白。Bif-1是一种进化上保守的、位于胞浆的多功能蛋白质,参与细胞自噬[2-3]、细胞凋亡[4]以及线粒体动力学[5]等生理过程。越来越多的研究表明Bif-1参与调节骨平衡[6]、癌症[7]、缺血性中风[8]、脂滴降解[9]及神经性疾病[10]等多种过程。
研究表明,Bif-1的氨基端含有1个N-BAR(bin-amphiphysin-rvs)结构域,具有膜绑定、弯曲活性;羧基端含有1个SH3(src homology 3)结构域,能与脯氨酸富集区结合。Bif-1各亚型具有相同的SH3结构域,由于mRNA的选择性剪切,使Bif-1b/c的N-BAR结构域发生了改变[11]。Bif-1不同亚型在不同细胞内功能不尽相同。Bif-1a是非神经元细胞的主要剪切异构体,研究显示其具有促进凋亡的作用;“神经特异性”的Bif-1c在多种疾病中对神经元细胞具有保护性作用。
在自然条件下,狂犬病病毒(rabies virus,RABV)主要侵袭动物或人的神经系统,尤其是中枢神经系统(CNS)。有研究表明,引起狂犬病的主要原因是神经元功能异常,而不是神经元死亡。虽然狂犬病临床症状严重,但中枢神经元细胞缺乏明显的病理学变化,限制了RABV致病机制相关研究。本试验通过建立RABV CVS-11株感染原代神经元细胞模型,并利用该模型检测RABV感染对Bif-1蛋白表达水平的影响,为进一步研究Bif-1蛋白在RABV致病中的作用及其分子机制奠定基础。
1 材料与方法
1.1 质粒、病毒及实验动物质粒pcDNA3.1-N,RABV CVS-11株由军事科学院军事医学研究院军事兽医研究所动物病毒学与特种动物疫病学实验室保存。10周龄ICR小鼠、怀孕14~16 d ICR孕鼠购自辽宁长生生物技术股份有限公司。
1.2 主要试剂Neurobasal-A无血清培养基、B-27补充物、L-谷氨酰胺(L-Gln)、胎牛血清、青链霉素混合液购自美国Gibco公司;DNase Ⅰ、Poly-D-Lysine、Ara-C购自Sigma公司;RABV N蛋白抗体,小鼠抗Bif-1单克隆抗体购自美国Novus公司;FITC标记的RABV N蛋白单克隆抗体购自日本FUJIREBIO公司;兔抗MAP2单克隆抗体购自美国CST公司;小鼠抗β-actin抗体购自北京锐抗生物技术有限公司;辣根过氧化物酶(HRP)标记的山羊抗鼠二抗购自Sigma公司;Alexa Fluor 594羊抗兔lgG荧光二抗购自美国Thermo公司。
1.3 RABV感染小鼠原代神经元细胞
1.3.1小鼠原代神经元细胞的分离培养及形态学观察 麻醉怀孕14~16 d ICR小鼠,取出胎鼠,置于预冷的DMEM液体培养基中,在光学解剖显微镜下剥取大脑皮质组织,仔细剥除软脑膜及血管等,在60 mm×15 mm培养皿中,使用预冷的DMEM液体培养基洗涤组织3次,4 000 r/min离心5 min,沉淀洗涤3次;最后1次用0.25%胰酶重悬,补足0.25% EDTA胰蛋白酶至20 mL(含DNase Ⅰ 0.1 g/L),37℃条件下摇床消化30 min;向组织悬液加入少许胎牛血清终止消化后,依次经过70,40 μm孔径细胞筛网过滤得到细胞悬液;2 000 r/min离心5 min后,弃上清,加入 Neurobasal-A完全培养基(2% B-27+1%L-Gln+1%抗生素)重悬细胞;细胞计数并稀释,按每孔1×106个接种于预先经 0.1 g/L PDL包被液包被的6孔板中,37℃、5% CO2分离培养;24 h后全量换液,同时加入0.01 mmol/L Ara-C抑制胶质细胞贴壁或生长,每48 h半量换液1次,体外培养5~7 d,依据细胞生长状态用于后续研究。
1.3.2RABV感染及鉴定 将培养5~7 d且生长状态良好的原代神经元细胞弃去培养基,PBS洗2次;将RABV按MOI=0.1接种于原代神经元细胞,置于37℃、5% CO2培养箱中孵育1 h;弃去病毒液,加入完全培养基,于37℃、5% CO2中培养48 h;弃上清,PBS洗涤2次,加入4%多聚甲醛固定15 min;去除固定液,使用5% BSA 37℃封闭1 h;PBS洗涤5次,加入PBST稀释的兔抗MAP2抗体(1∶200),4℃过夜;PBST洗涤5次,加入PBST稀释的FITC标记的RABV-N蛋白单抗(1∶200)、伊文斯兰(1∶300),Alexa Fluor 594标记的羊抗兔lgG(1∶1 000),37℃温箱孵育1 h;PBST洗涤5次,置于荧光显微镜下观察。
1.4 RABV在小鼠原代神经元细胞中的复制
1.4.1直接免疫荧光观察RABV增殖情况 将分离的原代神经元细胞接种于48孔板培养5~7 d,待原代神经元细胞生长状态良好时,弃去培养基,PBS洗2次;将RABV以MOI=0.1的剂量接种于细胞,置于37℃、5% CO2培养箱中孵育1 h;弃去病毒液,加入完全培养基,于37℃、5% CO2培养箱中培养;接毒后,每隔12 h做1次直免,观察病毒复制情况,直至72 h;首先弃去细胞培养基,每孔加-20℃预冷的80%丙酮溶液300 μL/孔,室温固定30 min;弃去固定液,加入PBST 300 μL/孔,室温摇床洗涤3次,每次5 min;避光条件下,用PBST将FITC标记的RABV-N蛋白单抗200倍稀释,伊文斯兰300倍稀释,按100 μL/孔加入48孔板内,避光置于37℃、5% CO2培养箱中孵育1 h;弃去抗体,PBST摇床洗涤3次,每次5 min,置于荧光显微镜下观察结果。
1.4.2Western blot检测RABV-N蛋白的表达 将RABV以MOI=0.1的剂量接种于生长状态良好的原代神经元细胞,每12 h提取细胞总蛋白,直至72 h;将原代神经元细胞用RIPA裂解液(含1 mmol/L PMSF蛋白酶抑制剂)冰上裂解40 min;用细胞刮刀小心刮取细胞样品,14 000×g离心10 min,吸取上清。蛋白样品经12% SDS-PAGE分离后,电转至NC膜,室温封闭120 min;加入Bif-1一抗(1∶1 000稀释),4℃孵育过夜;PBST洗涤5次,加入HRP标记的羊抗鼠二抗(1∶20 000稀释),室温孵育90 min;PBST洗涤5次,加入显色液,化学发光仪进行曝光,回收NC膜,用二蒸水洗涤5 min;使用一、二抗去除液室温孵育NC膜10 min,PBST洗涤5次;重新封闭,并孵育抗体,其中一抗为β-actin内参抗体(1∶10 000稀释)。
1.4.3染料法荧光定量PCR扩增RABV基因组 将RABV以MOI=0.1的剂量接种于生长状态良好的原代神经元细胞,每12 h反复冻融收取病毒上清液,直至72 h;使用TianGen病毒RNA提取试剂盒提取总RNA;参照PrimeScript RT Reagent Kit with gDNA Eraser试剂盒说明书,将提取的RNA反转录成cDNA;使用TB Green Premix Ex Taq Ⅱ(Tli RNaseH Plus)试剂盒进行荧光定量PCR。反应体系:TB Green Premix Ex Taq Ⅱ(Tli RNaseH Plus)(2×)12.5 μL,RV-N-F(10 μmol/L) 1 μL,RV-N-R(10 μmol/L) 1 μL,cDNA(500 ng)2 μL,ddH2O 8.5 μL。反应条件:95℃ 30 s,95℃ 5 s,60℃ 30 s,40个循环。在检测样本的同时以已知浓度的pcDNA3.1-N质粒为模板制作标准曲线,记录每个样品的Ct值并代入标准曲线公式中,换算成RABV基因组拷贝数,结果以拷贝数/500 ng 病毒RNA表示。
1.4.4RABV TCID50测定 将生长状态良好的NA细胞正常传代,将细胞按100 μL/孔铺至96孔板内,置于37℃、5% CO2培养箱备用。将待检的病毒液用含10% FBS的DMEM进行10倍倍比稀释,每个样品做4组重复;将稀释好的病毒液按50 μL/孔加入96孔板内,置于37℃、5% CO2培养箱中培养48 h;弃去细胞培养液,每孔加-20℃预冷的80%丙酮溶液150 μL/孔,室温固定30 min;弃去固定液,加入PBST 150 μL/孔,室温摇床洗涤3次,每次5 min;PBST稀释FITC标记的RABV-N蛋白单抗(1∶200)、伊文斯兰(1∶300),按50 μL/孔加入96孔板内,避光置于37℃、5% CO2培养箱中孵育1 h;弃去抗体,PBST洗涤3次,每次5 min;最后一次将PBST拍净,置于荧光显微镜下观察,用Reed-Muench法计算病毒滴度,结果以lg TCID50/mL表示。
1.5 Bif-1蛋白表达水平检测将RABV以MOI=0.1的剂量接种于生长状态良好的原代神经元细胞,每12 h提取细胞总蛋白,直至72 h;将原代神经元细胞用RIPA裂解液(含1 mmol/L PMSF蛋白酶抑制剂)冰上裂解40 min;用细胞刮刀小心刮取细胞样品,14 000×g离心10 min,吸取上清。蛋白样品经12% SDS-PAGE分离后,电转移至NC膜,室温封闭120 min;加入Bif-1一抗(1∶1 000稀释),4℃孵育过夜;PBST洗涤5次,加入HRP标记的抗鼠二抗(1∶20 000稀释),室温孵育90 min;PBST洗涤5次,回收NC膜,用二蒸水洗涤5 min;使用一、二抗去除液室温孵育NC膜10 min,PBST洗涤5次,重新封闭,并重新孵育抗体,其中一抗为β-actin内参抗体(1∶10 000稀释)。
2 结果
2.1 RABV感染小鼠原代神经元细胞将胎鼠大脑皮质分离获得的神经元细胞进行培养,并于2,4,6 d观察细胞形态。培养2 d后(图1A),可见少量细胞轴突变长,并生长出许多树突,且胞体膨大。培养至4 d后(图1B),胶质细胞脱落,贴壁细胞轴突增多、伸长,细胞间开始出现少量连接,逐渐形成神经细胞网络。培养6 d后(图1C),细胞胞体变大,轴突树突相互连接,形成神经网络,立体感较强。

A.培养2 d;B.培养4 d;C.培养6 d;D.MAP2标记的红色细胞即为原代神经元细胞;E.FITC标记RABV-N蛋白抗体
将RABV按MOI=0.1接种于神经元细胞,并用神经元细胞特异性抗体MAP2进行鉴定,观察病毒感染情况及分布。MAP2标记的红色细胞即为原代神经元细胞(图1D)。FITC标记的RABV-N蛋白抗体检测RABV感染情况及病毒分布,结果显示,RABV能够感染原代神经元细胞,在胞体及轴突均有分布,且神经元轴突出现串珠样神经病变(图1E)。
2.2 RABV在神经元细胞中的复制将RABV以MOI=0.1的剂量感染原代神经元细胞,经荧光显微镜观察,病毒感染12 h后,无明显荧光斑点;在24~48 h 荧光斑点逐渐增多、变大,并在48 h达到较高水平;病毒在60~72 h进一步复制,荧光斑点遍布整个视野(图2A)。Western blot结果显示,在接毒36 h后,可检测出RABVN蛋白条带,且72 h处灰密度较高(图2B);接种病毒后检测神经元细胞中病毒N蛋白mRNA水平(图2C)及上清中子代(图2D)病毒载量,结果显示,接毒后24 h细胞中病毒基因组及子代病毒滴度均逐渐上升,48 h显著升高。
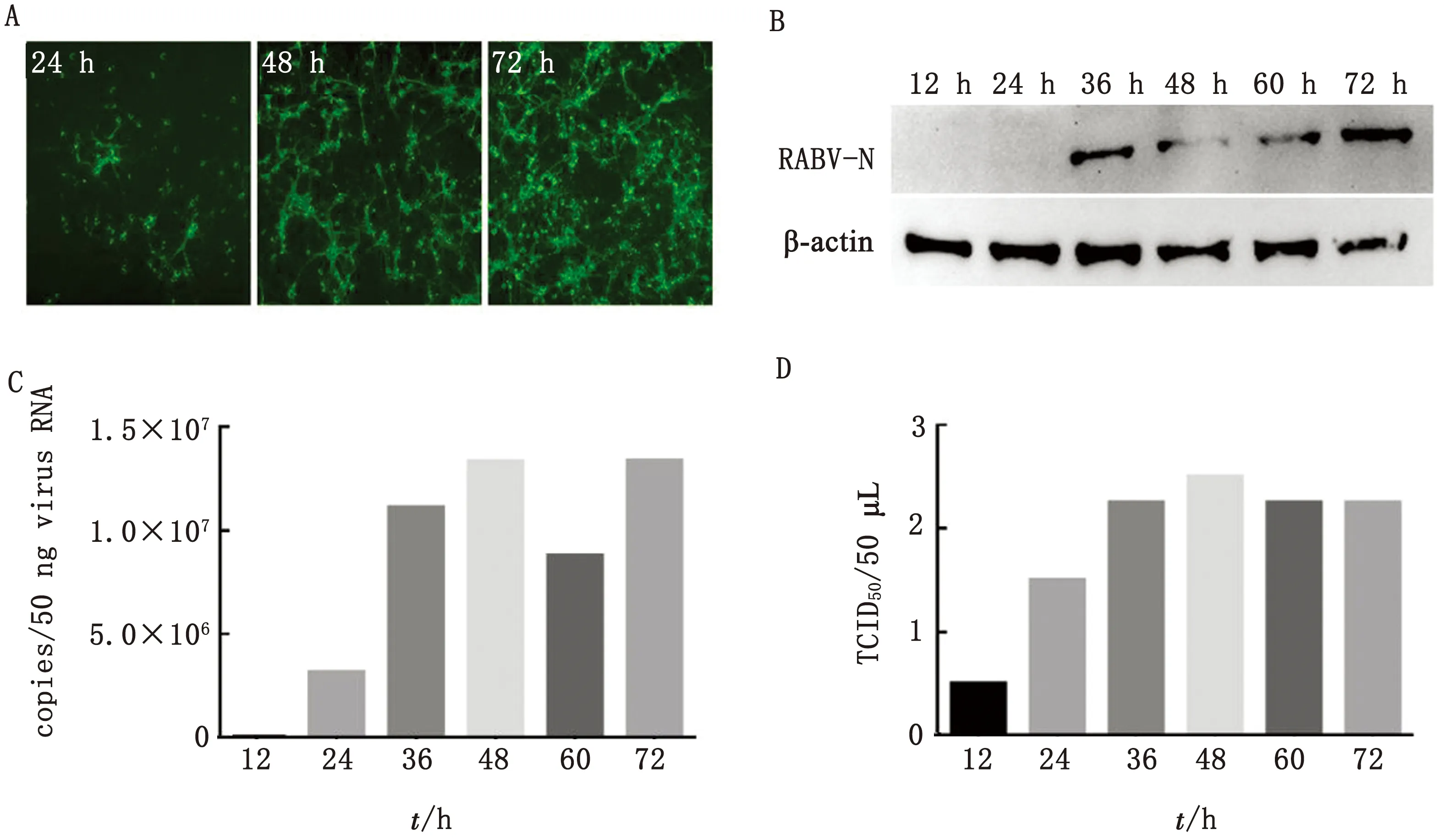
A.荧光显微镜观察;B.Western blot结果;C.N蛋白mRNA水平;D.上清中子代病毒载量
2.3 Bif-1蛋白的表达分析通过对不同时间点提取的蛋白样品进行Western blot检测(图3A)并对检测条带进行灰度值分析(图3B)。结果显示,RABV感染原代神经元细胞后,随着RABV的复制,Bif-1蛋白表达在病毒感染24 h内出现短期上升后,在36 h出现短暂下降后上升,并在48 h处趋于正常水平;在病毒感染60~72 h后Bif-1蛋白及内参蛋白均出现明显降低,且Bif-1蛋白在72 h无明显条带。在病毒感染72 h后,β-actin表达量降低,该结果提示,RABV CVS-11株对原代神经元细胞具有较强的神经噬性,从而破坏了细胞骨架结构的完整性。

A.Western blot检测;B.条带灰度值分析(#示P>0.05;*示P<0.05,**示P<0.01,***示P< 0.001)
3 讨论
RABV属于弹状病毒科(Rhabdoviridaefamily)RABV属(Lyssavirusgenus),是极具致命性的嗜神经性病毒。RABV能够特异性感染神经元并通过逆行轴突运输在宿主神经系统中传播。SUNDARAMOORTHY等[12]发现SARM1能够促进狂犬病诱导神经细胞的突触变性,而这种突触变性阻碍了RABV在神经细胞间的传播。AHMAD等[13-14]发现RABV感染使微管和肌动蛋白相关蛋白下调,从而破坏细胞骨架结构的完整性,造成神经元变性,引起突触功能障碍,表现出神经功能异常。FABER等[15]研究发现过表达RABV G蛋白使神经元细胞凋亡程度增加,且凋亡程度直接决定抗体反应程度。PULMANAUSAHAKUL等[16]研究发现过表达细胞色素C使神经元细胞凋亡程度增加,降低了RABV的致病性,并增强了抗病毒免疫反应。
Bif-1是吞蛋白B蛋白家族(the endophilin protein family)的一员,由基因SH3GLB1编码产生。研究表明,由于mRNA的选择性剪接,Bif-1至少存在a、b、c、d、e五种亚型[5]。目前关于Bif-1a、Bif-1b、Bif-1c三种亚型的研究较多。研究表明,Bif-1是一种促凋亡蛋白[1,4],具有促进线粒体分裂的作用[17-18]。TAKAHASHI等[2,18]发现Bif-1a通过调节PI3KC3信号通路参与细胞自噬;过表达Bif-1a能够改变Bax蛋白构象,激活Caspase-3蛋白,促进细胞凋亡的发生。WANG等[5]发现“神经特异性”Bif-1b/c能够维持线粒体的形态并促进神经元的存活;Bif-1b/c与阿尔茨海默病的病理有关,Bif-1b/c缺失能够导致β-淀粉样蛋白沉积、斑块形成、突触变性、tau过度磷酸化;过表达Bif-1b/c能够降低神经细胞的凋亡及β-淀粉样蛋白的毒性,从而促进神经细胞的存活[10]。GAN等[7]发现Bif-1a在转移性前列腺癌中具有促凋亡作用;Bif-1b/c具有抵抗由抗癌治疗而产生的细胞凋亡作用,使转移性前列腺癌向治疗性神经内分泌前列腺癌转变。因此,Bif-1a和Bif-1b/c在不同细胞中的“特异性”使其在癌症、神经性疾病的治疗方面极具前景。
本实验室前期研究表明,在NA细胞中,过表达Bif-1c能够抑制RABV的复制;过表达Bif-1c亚型促进RABV(CVS-11株)诱导的不完整自噬流并抵抗其诱导的细胞凋亡[19]。但目前尚无在原代神经元细胞上研究RABV与Bif-1蛋白相互关系的报道。因此本试验建立了RABV CVS-11株感染小鼠原代神经元细胞模型,经Western blot检测,RABV感染原代神经元细胞后,Bif-1蛋白水平表达有所变化,推测在原代神经元细胞中,Bif-1可能参与了RABV的感染过程。在本试验中发现RABV感染使神经细胞GAPDH、β-actin、β-tubulin的表达降低,该结果提示RABV感染破坏了神经元细胞骨架结构的完整性,与相关研究报道[13-14,20-21]结果相似。下一步将通过Bif-1蛋白的过表达及基因敲除探索Bif-1对RABV复制的影响,为RABV致病机制和救治药物研究奠定基础。
