多重重组鸭源H9N2亚型禽流感病毒的遗传演化分析
2021-06-21周惠英麦文鸿岑晓峰姚秋成赵志辉
葛 叶,周惠英,麦文鸿,岑晓峰,姚秋成,赵志辉
(广东海洋大学 滨海农业学院,广东 湛江 524088)
流感病毒根据NP蛋白的差异,分为A、B、C型。其中以A型流感病毒(AIV)影响范围最广,给人类和家禽带来的威胁最大。A型AIV根据血凝素(HA)和神经氨酸酶(NA)的差异分为18个HA亚型和11个NA亚型[1]。自1966年在北美的火鸡中分离到第1株H9N2后,该亚型AIV已在全球范围内广泛存在。随着H9N2亚型 AIVs的进化变异,目前主要分为欧亚分支和北美分支,其中欧亚分支进一步细化为A/chicken/Beijing/1/94(BJ94-like)(也有称为Y280-like或者G9-like)、A/quail/Hong Kong/G1/1997(G1-like)和A/chicken/Hong Kong/Y439/1997(Y439-like)三大亚分支,而G1分支又进一步分为G1-W和G1-E分支。BJ94分支目前主要流行于印度尼西亚、日本和缅甸等地,中国主要流行BJ94和G1-E两大分支,Y439分支主要流行于韩国,G1-W分支主要流行于非洲北部的利比亚、阿尔及利亚、埃及以及亚洲的西南部沙特阿拉伯、伊拉克、伊朗等国家[2-3]。
H9N2亚型 AIV的宿主范围很广,不仅能够感染不同种类的家禽(鸡、鸭、鹅)、野鸟,还具备不通过中间宿主跨越种间障碍,直接感染哺乳动物甚至感染人的能力[4]。1998年,从猪体内分离到H9N2 AIV,同期发生人感染H9N2事件[5]。针对与活禽接触频繁的工作人员的血清学调查发现,血清学阳性者的比率很高。另外,该亚型可在犬、鲸和水貂中检测到[6]。而作为内部基因复杂的供体作用尤为令人关注,该亚型AIV不仅是1997年中国香港H5N1高致病性AIV的内部基因的供体[7],而且还为新的人H7N9、H10N8 和H5N6 AIV提供了内部基因[5,7-8]。近些年分离到的H9N2亚型AIV的HA基因的226和228位点大多为人源受体结合位点。综上所述,H9N2 AIV影响巨大,必须进行系统的监测。
为掌握广东省雷州半岛水禽体内的H9N2亚型AIV的携带情况,本研究于2019年从广东省雷州半岛的4个不同方位的具有代表性的5个大型鸭场开展流行病学调查,了解家养水禽H9N2亚型AIV的携带情况。通过遗传演化分析和从分子水平的角度阐述H9N2亚型AIV的潜在危害,为家禽的防控预警提供有力的数据支持。
1 材料与方法
1.1 试剂TRIzol、反转录试剂盒购自赛默飞世尔公司;SPF鸡胚购自广东大华农有限公司;Easy Taq DNA 聚合酶和胶回收试剂盒购自北京全式金生物科技有限公司。
1.2 病毒的分离鉴定与测序2019年春、秋两季,于广东省雷州半岛东、西、南、北5个大型养殖户采集咽拭子和喉拭子,共计568份。将拭子经涡旋振荡后,12 000 r/min离心5 min;取上清,用0.22 μm 滤器过滤除菌并接种于11日龄SPF鸡胚中,37℃培养72 h。在此期间,每12 h照胚1次并弃掉死胚。无菌收获尿囊液,经HA试验初次判定,并利用特异性鉴定引物进行PCR扩增进一步确定病毒的种类及亚型。
利用TRIzol试剂提取尿囊液中病毒的RNA。利用U12通用引物及反转录试剂盒将RNA反转录成cDNA。利用AIV的特异性扩增引物进行常规的表面基因和内部基因的扩增,PCR扩增条件:94℃ 5 min;94℃ 30 s,56℃ 30 s,72℃ 90 s,35个循环后;72℃延伸7 min,4℃保存。按照全式金胶回收试剂盒的说明书回收扩增的目的基因并测序。
1.3 遗传演化分析利用DNAStar软件的SeqMan模块进行序列编辑,通过NCBI和GISAID网站下载经典毒株序列(包括欧亚分支的经典毒株和北美分支的经典毒株),使用MEGA 6.0 的Clustal X 1.81软件的最大相邻法进行序列处理并比对1 000 次进行遗传进化树的绘制[9]。
2 结果
2.1 病毒的分离与鉴定经过鸡胚接种后,HA和HI试验结果显示,从568份粪便拭子中共分离到3株H9N2亚型AIV,分别命名为A/duck/Guangdong/ZJ3-1/2019(H9N2)(简称GD/ZJ3-1)、A/duck/Guangdong/F2/2019(H9N2) (简称GD/F2)和A/duck/Guangdong/ML14/2019(H9N2) (简称GD/ML14)。
2.2 病毒表面基因的遗传演化分析通过遗传进化树分析发现,这3株病毒的HA基因均属于欧亚分支的Y280-like亚群,提示野鸟中的H9N2 AIV在我国经历了一个漫长的进化过程。3株病毒的HA基因核苷酸同源性为93.4%~99.9%,氨基酸同源性为93.9%~99.5%,分属2个组(图1A)。NCBI和GISAID流感数据库中与GD/ZJ3-1的HA基因同源最高的是(A/chicken/Jiangsu/J2245/2018(H9N2),与GD/F2同源性最高的是A/chicken/Shanghai/S1177/2018(H9N2),与GD/ML14同源性最高的是A/chicken/Jiangsu/J2308/2018(H9N2)。NA基因比较发现,GD/ZJ3-1和GD/ML14的NA基因均与A/chicken/Nantong/02/2017(H9N2)的同源性最高,与GD/F2同源性最高的是A/environment-air/Kunshan/NIOSH-BL34/2018(H9N2),3株病毒的NA基因处于同一个组(图1B)(表1)。
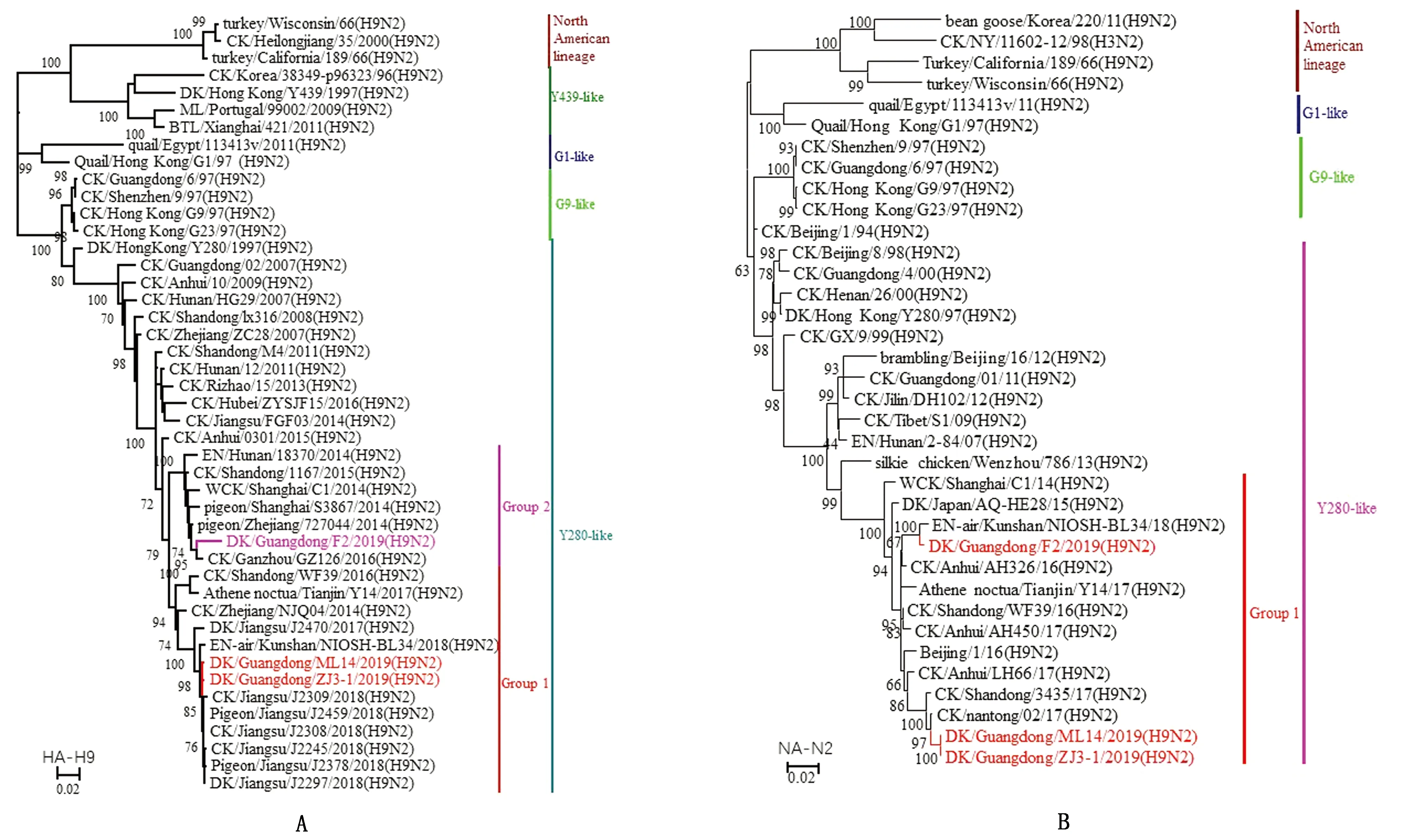
A.HA基因;B.NA基因。The sequences of viruses listed in black were downloaded from available databases;viruses listed in everycolor were sequenced in this study.Abbreviations:CK.chicken;DK.duck;GS.goose;SW.swine;WDK.wild duck;EN.environment。下同
2.3 病毒内部基因的遗传演化分析早期的进化研究表明,由于长期地理隔离,AIV已逐渐演化为欧亚和北美两个大分支。东西半球的AIV分别处于两个不同的分支,基因重组或/和交换的情况非常有限,但该现象的发生也进一步证明了候鸟的迁徙对AIV的重组与传播的重要作用。本研究分离的3株病毒的8个基因均处于欧亚分支。3株H9N2 AIV的PB2基因同源性为96.5%~99.9%,氨基酸同源性为98.0%~99.7%处于1个组中(图2A);PB1基因的核苷酸同源性为96.7%~100.0%,氨基酸同源性为92.6%%~99.9%(图2B);PA基因的核苷酸同源性为96.2%~99.9%,氨基酸同源性为99.0%~99.9%(图2C);NP基因的核苷酸同源性为96.0%~99.9%,氨基酸同源性为99.2%~99.8%(图2D);M基因的核苷酸同源性为97.8%~100.0%,氨基酸同源性为96.0%~99.4%(图2E);NS基因共分为两个大分支,Allele A和Allele B。Allele A为北美分支,Allele B为欧亚分支。本研究分离的3株病毒的NS基因均属于欧亚分支。NS基因的核苷酸同源性为86.9%~98.1%,氨基酸同源性为79.1%~97.9%,分属2个不同的组(图2F)。从内部基因的比较分析发现,本试验分离的3株病毒均存在不同程度的重组现象。GD/ZJ3-1和GD/ML14为鸡-人的重组病毒,而GD/F2为鸡-鸭-野鸟-人的多重重组病毒。GD/ML14和GD/F2的M基因均与人的A/Beijing/1/2017(H9N2)株同源性最高(表1)。
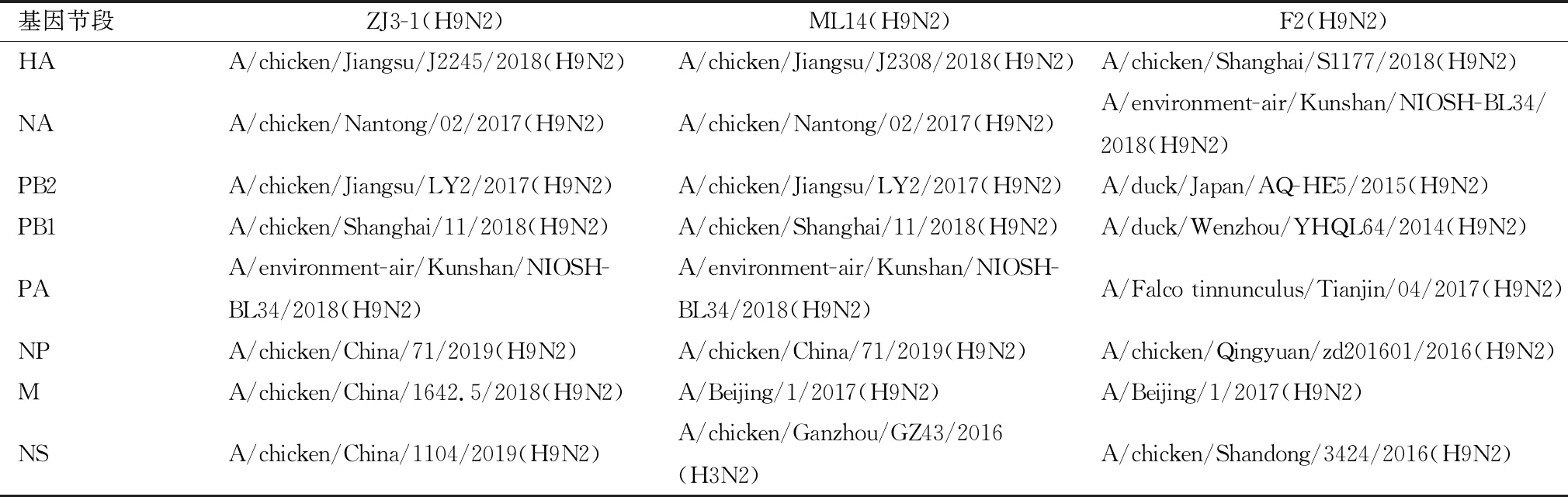
表1 3株H9N2 AIV与NCBI中同源性最高的毒株

A.PB2;B.PB1;C.PA;D.NP;E.M;F.NS
2.4 生物学特性评价为进一步了解野鸟源H9N2亚型AIV的潜在威胁,我们分析了3株病毒表面蛋白和内部蛋白的分子标记。3株病毒的HA碱性裂解位点为RSSR/GLF,无连续的多个碱性氨基酸,提示这3株病毒为低致病性AIV[1,6]。受体结合位点显示3株病毒均为226L 和228G,也就是说226位点发生由偏嗜禽源受体向偏嗜人源受体的改变[4,10]。值得注意的是,本研究分离的3株病毒的NA基因长均为1 402 bp,编码467个氨基酸,存在着颈部缺失,意味着该3株病毒对小鼠的致病力增强[11]。PB2的Q591K、E627K或D701N位点突变意味着病毒的聚合酶活性和病毒在哺乳动物细胞上的复制能力增强[12],本试验的3个病毒株不存在上述3个改变。然而,这3个分离株的PB2蛋白发生了I292V的突变,意味着3株病毒感染哺乳动物细胞后聚合酶的活性增强,并对小鼠的致病力增强[13]。PB2的588V是H10N8、H7N9和H9N2亚型适应哺乳动物的标志。本研究的3个分离株均存在588V的特征[14]。本研究的3株AIVs的PB1蛋白上436位均为酪氨酸。PA蛋白的515位为苏氨酸,呈现对家禽和哺乳动物的低致病性的特征[15]。PB1-F2蛋白的66位N-S的变化提示1918年AIV分离株和高致病性H5N1亚型AIV对小鼠和雪貂的致病力增强[14-17]。本研究的3株AIV的PB1-F2蛋白上66位均为丝氨酸,提示这些病毒可能存在着对小鼠致病性增强的情况。本研究中的3株病毒出现了M1蛋白的N30D和T215A的氨基酸变化、M2蛋白S31N变化,意味着病毒对金刚烷胺的耐药性增强,说明AIV随着病毒的遗传进化重组,出现抵抗金刚烷胺类药物的特性[15]。NS1蛋白的42位发生P42S的变化,病毒的毒力有增强的趋势[18-19],详见表2。

表2 病毒基因节段的分子标记
3 讨论
H9N2亚型AIV广泛分布于世界各国,但主要在亚洲的家禽中流行,是我国家禽中流行最为广泛的AIV之一。H9N2亚型AIV在家禽中稳定存在和持续流行不仅给家禽饲养业造成了严重的危害,而且对人类健康构成了日益严重的威胁。H9N2亚型AIV作为供体基因的危害也很大,如人的H7N9和H10N8亚型AIV。正是由于H9N2亚型AIV在我国家禽中广泛且稳定存在,所以该亚型的AIV不容忽视。
雷州半岛位于我国广东省境内,是中国大陆的最南端,地处热带和亚热带的交界处,是全球鸟类的8条迁徙路线中的1条,也是众多候鸟的越冬地。雷州半岛家养水禽的饲养量庞大,调查发现,家养水禽饲养场常处于水库旁,水禽可自由游走于水库内,常形成候鸟和家禽混居的情况。本研究选择雷州半岛东、西、南、北4个方向的代表性的大型养殖场采集样品,获得 3株H9N2亚型AIV。全基因测序及遗传演化分析发现,这3株H9N2 AIV的HA基因和NA基因都属于欧亚分支的Y280亚分支。6个内部基因同属于欧亚分支。更重要的是,这3株病毒存在不同情况的重组现象为三重重组和五重重组的病毒。重组不仅发生在家禽和野鸟之间,亦发生在野鸟、家禽和人之间。推测可能是由于饲养环境所致如此复杂的重组现象。
从基因的分子水平分析发现,本研究3株病毒的HA蛋白出现Q226L的变异,意味着由偏嗜禽源受体结合位点转至偏向人源的受体结合位点。该现象也存在于近几年分离到的H9N2亚型AIV,意味着H9N2亚型AIV的感染性更易感人类和哺乳动物。这3株病毒出现M1蛋白N30D和T215A的氨基酸变化,此结果与目前流行毒株的分析结果相吻合。目前流行的AIV大多数M1蛋白出现这两个氨基酸位点的变化,同时NS1蛋白的42位同样发生着P42S的变化,说明随着时间的推移,病毒的毒力有增强的趋势,这也意味着病毒的变异向着毒力更强的方向转变。3株H9N2亚型AIV分离株中的2株,GD/ML14和GD/F2的M基因来源于人的H9N2亚型AIV。这也是首次从鸭体内分离到如此重组多样的病毒,这样新的重组病毒可能对家禽乃至人类的健康存在着潜在的威胁。本研究进一步证实了H9N2亚型AIV的内部基因在病毒的重组中发挥着重要作用。
