负载槲皮素的酶法糖基化酪蛋白复合纳米粒子的构建与表征
2021-06-21樊永康刘健华吴晓琴陈玉峰沈建福
樊永康,刘健华,刘 尧,吴晓琴,陈玉峰,沈建福,*
(1.浙江大学生物系统工程与食品科学学院,浙江杭州 310058;2.浙江晟泰茶油科技有限公司,浙江衢州 324200)
酪蛋白(Casein,Cas)是牛乳中含量最多的蛋白质,约占牛奶蛋白的80%。其由4 种蛋白质组成,分别是αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白、κ-酪蛋白,四种酪蛋白的比例为40:10:35:15[1]。酪蛋白的营养价值非常丰富[2],含有人体必需的氨基酸,能够满足人体各种营养需求。优化酪蛋白的性质以改善其对疏水性小分子的包埋及传递效果,对拓宽酪蛋白的应用范围具有重大意义。
槲皮素(Quercetin,Que),化学命名为3,3′,4′,5,7-五羟基黄酮,是一种植物类黄酮素,广泛存在于水果蔬菜中[3]。槲皮素具有抗癌、抗病毒、抗炎等多种生物学功效[4-7],但槲皮素的水溶性低的问题限制了槲皮素的商业应用。郝建鹏[8]利用大豆卵磷脂和壳聚糖复合物包埋槲皮素,制备负载槲皮素的纳米微胶囊,以此来提高槲皮素的水溶性和稳定性。结果表明:槲皮素经过包埋后,其水溶性大大增加,4 ℃避光保存2 周后仍有91%的残留率。Li 等[9]用玉米醇溶蛋白和大豆多糖静电复合物来包埋槲皮素以此来提高水溶性和抗氧化能力。结果表明,当玉米醇溶蛋白与槲皮素的质量比为20:1 时,槲皮素的包埋率最高,为82.5%,抗氧化性比槲皮素水溶液提高了10 倍以上。Nazanin 等[10]利用自组装法来制备酪蛋白胶束,并用酪蛋白胶束来包埋槲皮素,以此来提高槲皮素的包埋率。结果表明:被酪蛋白包埋的槲皮素在25 ℃下储存30 d 后,其仍有90%以上的包埋率。
本文以槲皮素、壳寡糖(Chitosan oligosaccharide,Cos)为原料,采用转谷氨酰胺酶法对酪蛋白进行糖基化,并研究糖基化后的产物对槲皮素的包埋效果。首先制备酪蛋白-壳寡糖(Cas-Cos)糖基化复合物,并采用超声自组装法探究复合自组装纳米粒子的制备工艺,然后探究其对槲皮素的包埋机理、热稳定效果,为其应用提供理论指导。
1 材料与方法
1.1 材料与仪器
酪蛋白、辣根过氧化酶(酶活:200 U/g)、蛋白质分子量标准(分子量:14.4-116 KDa)上海阿拉丁生化科技有限公司;壳寡糖(Cos,分子量1 KDa)浙江金壳药业有限公司;转谷氨酰胺酶(TGase,酶活:130 U/g)江苏一鸣精细化工有限公司;无水乙醇、浓盐酸、氢氧化钠、氯化钙、三氯乙酸 分析纯,上海国药试剂有限公司。
UV-2600 紫外可见分光光度计 日本岛津公司;冷冻干燥机 德国Christ 公司;Milli-Q 超纯水仪 美国Millipore 公司;AVATAR370 傅里叶红外光谱仪 美国NICOLET 公司;JEM-1010 透射电子显微镜 日本电子株式会社;高速离心机 湖南湘仪仪器有限公司;Zetasizer Nano ZS-90 纳米粒径电位分析仪 英国 Malvern 公司产品;SLHW-4 四联加热数显恒温磁力搅拌器 杭州仪表电机有限公司;HH-S 恒温水浴锅 常州翔天实验仪器厂;电子天平 赛多利斯有限公司;HZ-8812S-B 水浴恒温振荡器 江苏太仓华利达公司;pHS25 数显pH 计 梅特勒-托利多仪器(上海)有限公司。
1.2 实验方法
1.2.1 酪蛋白糖基化交联及修饰产物的制备 参考王晓杰等[11]方法并作适当修改。将质量浓度为30 g/L的Cas 与质量浓度为60 g/L 的Cos 按体积比2:3混合,TGase 的添加量为20 U/g 酪蛋白,用1 mol/L的NaOH 和HCl 调节溶液pH 至7.5,混匀溶液置于37 ℃的水浴锅中水浴震荡加热5 h。反应结束后,将样品置于85 ℃的水浴锅中加热灭酶5 min,冷却至室温,4 ℃下透析7 d,除去未反应的壳寡糖,样品冻干,得到Cas-Cos 糖基化产物。
1.2.2 糖基化样品中壳寡糖的含量测定
1.2.2.1 氨基葡萄糖标准曲线的绘制 参考王晓杰等[11]方法,并作适当修改。用氨基葡萄糖盐酸盐配制浓度分别为12.5、25、50、100、150、200 μg/mL的标准液各2 mL。上述溶液各取1 mL 加入1 mL的DNS 试剂中,充分混匀,沸水浴加热5 min,冷却后各组分别加入4 mL 超纯水,以空白组(将氨基葡萄糖盐酸盐溶液换成超纯水)调零,测定上述溶液在540 nm 处的吸光度值。以氨基葡萄糖浓度为横坐标(μg/mL),吸光值为纵坐标,绘制标准曲线。
1.2.2.2 样品中氨基葡萄糖接入量的测定 参考王晓杰等[11]方法并作适当修改。样品中壳寡糖的含量用mg 氨基葡萄糖/g 蛋白来表示。取0.01 g 糖基化修饰的酪蛋白样品于安瓿管中,加入2.5 mL 6 mol/L HCl,通过氮吹排除管内的空气以防止氧化,用酒精喷灯灼烧安瓿管管口使其密封,放入100 ℃水浴锅中酸水解8.5 h。取出样品,冷却后用滤纸过滤到10 mL 离心管中,吸取1 mL 样液,加入1 mL 6 mol/L NaOH 调节pH,使pH 大于7.5,再从调节好pH 值的样液中取0.5 mL,加入0.5 mL DNS 试剂,沸水浴加热5 min,冷却后加入4 mL 蒸馏水,混匀,测定540 nm 处的吸光度值。带入氨基葡萄糖标准曲线,计算修饰样品中的壳寡糖接入量。
1.2.3 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE)参考宋春丽等[12]的方法。采用恒压法电泳分析,分离胶和浓缩胶的质量分数分比为12%和4%,样品浓度为2.5 mg/mL,样品进样量为10 μL,样品处于入浓缩胶时的电压为80 V,进入分离胶后,电压为120 V,电泳结束后,进行染色和脱色。
1.2.4 酪蛋白-壳寡糖和酪蛋白纳米粒子的制备 参考闵敏[13]的方法并作适当修改。以纳米粒子的平均粒径和PDI 为评价指标,采用单因素实验探究纳米粒子的最佳制备工艺。Cas-Cos、Cas 的浓度分别为1、2、4、6、8 g/L;超声功率分别为0、50、100、150、200 W,超声时间为6 min;pH 分别为5.8、6.1、6.4、6.7、7.0。每组实验数据均重复3 次。
1.2.5 负载槲皮素的酪蛋白-壳寡糖和酪蛋白纳米粒子的制备 参考于钰[14]的方法并作适当修改。配制Cas、Cas-Cos 的溶液4 g/L,pH 为5.8,取一定量的10 g/L 的Que 乙醇溶液加入20 mL 蛋白质溶液中,使蛋白质与槲皮素的质量比分别为10:1、20:1、30:1、40:1、50:1,超声频率为200 W,超声时间为6 min。取0.1 mL 10 g/L 的Que 乙醇溶液加入10 mL蛋白质溶液中,磁力搅拌20 min 除去乙醇,将溶液超声处理6 min 得到负载Que 的纳米粒子溶液。
1.2.6 包埋率(EE)与载药率(LC)的测定
1.2.6.1 槲皮素紫外光谱和标准曲线的绘制 配制浓度为30 μg/mL 的Que 乙酸乙酯溶液5 mL,取3 mL置于石英皿中,于波长300~450 nm 处进行光谱扫描,得到光谱曲线,进行分析。分别配制浓度为2、4、6、8、10 μg/mL 的Que 乙酸乙酯溶液,测定其在369 nm 处的吸光度值。以槲皮素的浓度x(μg/mL)为横坐标,吸光度值y 为纵坐标绘制标准曲线。
1.2.6.2 EE 与LC 的测定 参考刘敏的方法[15],并作适当修改。采用分光光度法测定纳米粒子的槲皮素含量。在自组装纳米粒子4 ℃放置24 h 后,取10 mL负载槲皮素的纳米粒子溶液在10000 r/min 下离心10 min,上清液用40 mL 乙酸乙酯萃取,涡旋5 min使充分混合,混合液8000 r/min 离心5 min,分离得到乙酸乙酯相。萃取重复两次,合并萃取液。将萃取液用乙酸乙酯适当稀释,测定369 nm 处的吸光值。计算槲皮素的包埋率(EE)和载药率(LC)。

1.2.7 傅利叶红外光谱分析(FITR)采用溴化钾压片法进行傅里叶红外光谱分析,扫描波长为400~4000 cm-1。
1.2.8 X 射线衍射(XRD)参考Sun 等[16]的方法,并作适当修改。将样品研磨均匀后,在样品池上铺平,使用Unisantis XMD-300 型X 射线衍射仪测定样品的XRD 光谱。具体参数为:入射波束发射狭缝1°,接收狭缝0.1 mm,样品扫描范围5°~70°,扫描速度2°/min。
1.2.9 透射电镜(TEM)和外观形态分析 采用JEM-1010(HR)型透射电镜在200 kV 工作电压下观察纳米粒子的形态。取一滴稀释后的纳米粒子样品置于覆有支持膜的铜网上(40 目),自然晾干后,用醋酸双氧铀对载有样品的铜网负染30 s。用滤纸吸走多余的液体后,将样品置于透射电镜下观察、拍照。
1.2.10 热稳定性分析 将1 mg 的槲皮素分散在乙醇和超纯水中,制成浓度为0.1 mg/mL 的溶液10 mL,将以上溶液与浓度为0.1 mg/mL 的槲皮素纳米粒子溶液分成3 份,分别置于温度为37、60、99 ℃的水浴锅中,每隔2 h,取出1 mL 的溶液测定其中槲皮素残留量,计算槲皮素的残留率。以同浓度同体积的槲皮素水溶液和乙醇溶液作为对照。

1.3 数据处理
所得数据使用Origin 8.0 或Excel 绘制相关图表。每次测试前需更换样品,且每组实验均重复3 次。
2 结果与讨论
2.1 Cas-Cos 接糖量的分析
Cas-Cos 经过酸水解后,与氨基葡萄糖溶液一起进行利用DNS 法进行分析。利用DNS 外标法分析Cas-Cos 中的氨基葡萄糖接入量。DNS 外标法的结果可以证明壳寡糖已经接入到Cas 中。本文中,分别配制含有12.5、25、50、100、150、200 μg/mL的标准液,利用氨基葡萄糖溶液得出标准曲线方程(图1):y=0.0013x+0.0865(R2=0.9978),x、y 分别是氨基葡萄糖的浓度和吸光度。本实验中测得样品的吸光度为0.143,根据标准曲线计算得Cas-Cos 的接糖量为43.4 mg/g 蛋白质。

图1 氨基葡萄糖标准曲线Fig.1 Glucosamine standard curve
2.2 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE)
利用聚丙烯酰胺凝胶电泳技术对Cas、Cas-Cos 进行分析。将电泳胶片分别进行考马斯亮蓝和高碘酸-希夫试剂(糖染色),对比分析电泳胶片的染色结果,可以确认糖基化修饰反应。Cas 及其糖基化产物的电泳图谱如图2 所示。由图2A 可知,Cas 的分子量主要分布在25~35 kDa 之间。Cas 经过自身交联修饰和糖基化之后,原有的条带消失,在Cas-Cos 的浓缩胶和分离胶顶端形成新的条带。这是由于大分子聚合物分子量较大,所以其不能进入浓缩胶和分离胶。由图2B 可以看出,Cas-Cos 也显示出了粉色条带,显示出了特异性的糖染色效果,而标准蛋白(M)和Cas 无明显的糖染色效果。结果表明,Cas 经过糖基化修饰之后在其泳道的顶端生成大分子糖蛋白聚合物,这表明壳寡糖以共价的形式接入到Cas 中。Sheng 等[17]利用美拉德反应使支链淀粉共价接入溶菌酶中,其SDS-PAGE 也显示出相似的电泳图,这表明美拉德反应也生成了糖蛋白。Guo等[18]利用干法美拉德反应制备乳清分离蛋白-甜菜果胶糖基化产物,反应5 h 后,SDS-PAGE 图谱也显示有较大分子量的聚合物生成,这表明干法美拉德反应生成了大分子量的糖蛋白。
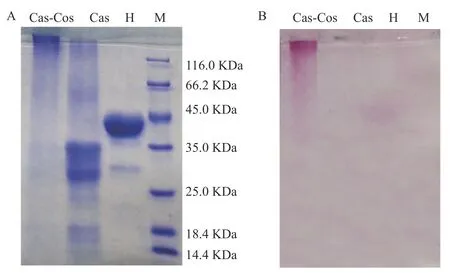
图2 十二烷基磺酸钠-聚丙烯酰胺凝胶电泳条带Fig.2 Sodium dodecyl sulfate-polyacrylamide gel electrophoresis band
2.3 蛋白质浓度对纳米粒子粒径和PDI 的影响
如图3a 所示,Cas、Cas-Cos 两种纳米粒子的粒径随浓度的增加呈现出先减小后增大的趋势。n-Cas 纳米粒子在蛋白质浓度为2 g/L 时,纳米粒子的粒径为190.2 nm,纳米粒子的粒径随着浓度的增加呈现出减小的趋势。这是因为在超声功率相同的情况下,蛋白质浓度越低,分散到每个蛋白质分子上的能量就越大,产生较强的剪切作用。当剪切力高于一定水平时,蛋白质分子就会去折叠而发生聚集[19-20],使得粒径较大。因此,在浓度较低的蛋白质分子中,剪切作用会使蛋白质的疏水基团发生暴露,在疏水性作用力下蛋白质重新发生自组装形成较为规则的纳米粒子。n-Cas-Cos 纳米粒子也表现出同样的特性,在蛋白质浓度为4 g/L 时,粒径为126.8 nm。当蛋白质的浓度逐渐增大,分散到每个蛋白质上的剪切力较小,不均一的蛋白质颗粒会发生聚集形成纳米粒子[13]。同时,n-Cas 的粒径要高于n-Cas-Cos,这可能是因为Cas 经过糖基化后,分子内的疏水基团暴露更多,疏水作用力加强,蛋白分子间相互作用增加,纳米粒子发生收缩[14]。两种纳米粒子的PDI(如图3b所示)也表现出相同的趋势。本文选取4 g/L 作为纳米粒子的最佳浓度。

图3 不同的蛋白质浓度对纳米粒子的平均粒径及PDI 的影响Fig.3 Effect of different protein concentrations on the average particle size and PDI of nanoparticles
2.4 超声功率对纳米粒子粒径和PDI 的影响
如图4 所示,两种纳米粒子的粒径和PDI 都随着超声功率的增加而减小。这表明在一定的超声功率范围内,纳米粒子的粒径随着超声功率的增大变得更加均一,形成较小的纳米粒子。在较大的超声功率下,超声波的空化作用产生很大的剪切力和压强,使得粒子间发生猛烈的碰撞和使原来伸展在粒子表面的不规则产物发生结构断裂,体系中的粒子形态更加规则[13]。当超声功率增加到200 W 时,n-Cas、n-Cas-Cos 的粒径分别为167.8 nm 和133.4 nm,PDI 分别为0.213 和0.179。本文选取200 W 作为纳米粒子的最佳超声功率。

图4 不同的超声功率对纳米粒子的平均粒径及PDI 的影响Fig.4 Effect of different ultrasonic power on the average particle size and PDI of nanoparticles
2.5 pH 对纳米粒子粒径和PDI 的影响
本文选取5.8~7.0 之间的pH 为考察范围。当pH 低于5.8 时,蛋白质接近等电点,静电斥力减小,发生蛋白质聚集,形成沉淀。如图5a 所示,随着pH 增大,蛋白质纳米粒子粒径呈现出增大的趋势。这是因为随着pH 增大,纳米粒子间静电斥力会越强,分子间的疏水作用力、氢键变弱,纳米粒子结构会变得松散,蛋白质粒径表现为增加的趋势,PDI 也有同样的趋势[21]。因此,本文选取5.8 作为纳米粒子自组装的最佳pH。综上,在蛋白质浓度为4 g/L、超声功率为200 W、pH 为5.8、超声时间为6 min 条件下,n-Cas、n-Cas-Cos 纳米粒子的粒径分别为169.1 nm和125.6 nm、PDI 分别为0.217 和0.161。

图5 不同的pH 对纳米粒子的平均粒径及PDI 的影响Fig.5 Effect of different pH on the average particle size and PDI of nanoparticles
2.6n-Cas-Que 和n-Cas-Cos-Que 纳米粒子包埋率和载药率的测定
由图6a 可以看出,随着蛋白质与Que 的质量比的逐渐增加,包埋率呈现出一直上升并趋于平缓的趋势。当质量比达到40:1 时n-Cas-Que 的包埋率为74.14%,而n-Cas-Cos-Que 的包埋率为85.21%。荷载能力分别为1.85%和2.13%。当质量比较低时(低于30:1),两种纳米粒子的包埋率较低,原因可能是Que 的含量过多,导致大量的Que 没有被包埋进纳米粒子的疏水性内核中,绝大部分Que 以微晶的形式分散在溶液中;随着蛋白质质量的不断增大,有更多的Que 被包埋进纳米粒子的疏水性内核中,所以包埋率呈现出上升的趋势;当蛋白质与Que 的质量比增加到40:1 之后,n-Cas-Que 和n-Cas-Cos-Que 的包埋率增加缓慢,同时考虑到纳米粒子的荷载能力不能过低,选取Cas、Cas-Cos 与Que 的质量比为40:1 作为最佳工艺条件。从图中还可以看出n-Cas-Cos-Que 纳米粒子的包埋率高于n-Cas-Que,这表明蛋白质经过糖基化之后,可以提高其对Que 的包埋效果。原因可能是酪蛋白经过糖基化之后,分子间提供更强的疏水作用力和氢键,从而更好的与Que 结合,提高包埋能力。郝建鹏[8]利用脂质体/壳聚糖复合载体包埋与本研究质量相同的槲皮素,得到槲皮素的包埋率为71.14%,低于本研究的包埋率。综上,酶法糖基化能提高酪蛋白纳米粒子对Que 的包埋效果。

图6 不同的质量比对槲皮素包埋率和载药率的影响Fig.6 Effect of different mass ratios on quercetin embedding rate and drug loading rate
2.7 槲皮素纳米粒子的红外特性分析
由图7 可知,槲皮素有以下特征吸收峰:O-H 伸缩振动吸收峰(3385 cm-1)、C=O 伸缩振动吸收峰(1658 cm-1)、苯环骨架伸缩振动吸收峰(1513 cm-1、1615 cm-1)、C-O、C-C、C-C-O 的伸缩振动吸收峰(1093 cm-1)[22]。
n-Cas 主要有O-H 和N-H 伸缩振动吸收峰(3416 cm-1)、C-H 伸缩振动吸收峰(2961 cm-1)、C=O 伸缩振动吸收峰(1654 cm-1、酰胺I 带)、N-H弯曲吸收峰(1538 cm-1、酰胺II 带)、C-O、C-C、CC-O 的伸缩振动吸收(1096 cm-1)等特征峰[23]。当n-Cas 包裹槲皮素后,n-Cas-Que 的红外特性吸收峰与n-Cas 相似,但n-Cas-Que 的红外吸收峰中无苯环骨架等特征吸收峰,这表明Cas 已经成功包裹槲皮素。此外,n-Cas 在包裹槲皮素后形成n-Cas-Que 纳米粒子,O-H 和N-H 伸缩振动吸收峰由3416 cm-1位移至3419 cm-1,C-H 伸缩振动吸收峰由2961 cm-1位移至2964 cm-1处、N-H 弯曲吸收峰由1538 cm-1位移至1540 cm-1,这表明槲皮素与n-Cas 发生相互作用,作用的方式可能是氢键、疏水作用等作用力。
n-Cas-Cos-Que 的特征吸收峰与n-Cas 相似,有O-H 和N-H 伸缩振动吸收峰(3405 cm-1)、C-H 伸缩振动吸收峰(2928 cm-1)、C=O 伸缩振动吸收峰(1652 cm-1、酰胺I 带)、N-H 弯曲吸收峰(1539 cm-1、酰胺II 带)、C-O、C-C、C-C-O 的伸缩振动吸收(1076 cm-1)。当槲皮素与n-Cas-Cos-Que 作用后,苯环骨架特征吸收峰消失(1513、1615 cm-1),O-H 和N-H 伸缩振动吸收峰由3405 cm-1位移至3420 cm-1、C-H 伸缩振动吸收峰由2956 cm-1位移至2960 cm-1,这也同样表明了槲皮素与蛋白结合被包埋进蛋白内部,作用方式为氢键和疏水作用力。
2.8 X 射线衍射(XRD)
X 射线衍射反映了物质的结晶度。在2θ 角度处,如果分子有尖锐的结晶峰,则表明这种物质有结晶度;如果只有弥散的散峰,则该种物质是一种无定型态的物质,没有明显的的结晶状况。如图8 所示,槲皮素在5.77°、10.27°、11.36°、12.07°、13.20°、14.18°、17.02°、22.24°、26.62°等处有非常尖锐的结晶峰。然而n-Cas、n-Cas-Cos、n-Cas-Que、n-Cas-Cos-Que 的XRD 都没有明显的大的尖锐峰,均在10°和20°左右存在着小的弥散峰,槲皮素的结晶峰在两种纳米粒子中均未观察到,这表明槲皮素已经被包埋进纳米粒子内,以无定型态的方式分布在纳米粒子中[24]。

图8 槲皮素及各纳米粒子的X 射线衍射图谱Fig.8 X-ray diffraction pattern of quercetin and each nanoparticle
2.9 透射电镜(TEM)和外观形态分析
n-Cas、n-Cas-Que、n-Cas-Cos、n-Cas-Cos-Que 纳米粒子的透射电镜图如图9c、9d、9e、9f 所示。从图9a 和9b 可以看出,Cas 和糖基化的Cas-Cos 在未组装的情况下呈现出一种比较松散的状态且分布不均一,较为零散,这种状态下的Cas 和Cas-Cos 非常不利于自组装,疏水性营养物质很容易从蛋白中析出。这是因为酪蛋白结构缺乏刚性的三维构象[25]。经过超声自组装之后,Cas 和Cas-Cos 会自发的形成图9c 和图9d 中所示的类球状的纳米粒子,n-Cas 和n-Cas-Cos 的粒径在10~200 nm 之间,这与我们前面所测的粒径大小相符。包埋槲皮素后,纳米粒子的形态变化不大,略有增加。但n-Cas-Cos-Que 表现出更好的分散性,Nazanin 等[10]利用酪蛋白自组装包埋槲皮素和姜黄素,透射电镜下纳米粒子显示出与图中相似的形状。从图中还可以看出,n-Cas-Cos-Que 粒子的分散效果要好于n-Cas-Que,这与我们前面所测得的PDI 结果相符。纳米粒子的外观形态如图所示,槲皮素经过包埋之后,增大其水溶性,未出现沉淀。

图9 纳米粒子的外观图及TEM 图像Fig.9 Appearance and TEM images of nanoparticles
2.10 热稳定性分析
Que-水、Que-乙醇、n-Cas-Que、n-Cas-Cos-Que在不同温度下的热稳定性如图10 所示。在37 ℃条件下,随着加热时间的的延长,n-Cas-Cos-Que 表现出更好的热稳定性。在加热8 h 后,Que-水、Que-乙醇、n-Cas-Que、n-Cas-Cos-Que 中的槲皮素残留率分别为53.4%、64.8%、73.2%、87.6%;在60 ℃下也表现出相似的趋势,加热8 h 后,槲皮素的残留率分别为38.9%、42.13%、57.2%、63.5%;在99 ℃下加热8 h 后,槲皮素的残留率分别为2.13%、2.41%、4.27%、5.13%。以上结果表明n-Cas-Cos 能够提高槲皮素的热稳定性,可能是因为Cas 经过糖基化交联之后,提高了蛋白质的热稳定性,对槲皮素起到了更好的保护效果。Yang 等[26]利用转谷氨酰胺酶法制备乳铁蛋白-壳寡糖纳米粒子,并用这种纳米粒子来包埋芦丁。热稳定性表明:与未糖基化的乳铁蛋白相比,乳铁蛋白-壳寡糖-芦丁纳米粒子在50 ℃下加热20 h 后,残留率为60%;而乳铁蛋白包埋的芦丁残留率为51.2%。

图10 不同的温度加热对槲皮素的残留率的影响Fig.10 Effect of heating at different temperatures on the residual rate of quercetin
3 结论
本文利用TGase 催化Cos 糖基化接入Cas,制备Cas-Cos 二元复合物。然后利用超声自组装法制备二元复合纳米粒子,探究其对Que 的包埋效果和稳定效果。结果如下:Cas 中壳寡糖的接入量为43.4 mg/g 酪蛋白。SDS-PAGE 表明Cos 已经成功的接入Cas 中。二元复合纳米粒子的最佳工艺为:pH为5.8、蛋白质浓度为4 g/L、超声功率200 W、超声时间为6 min,n-Cas-Cos 纳米粒子的粒径为125.6 nm、PDI 为0.161。蛋白质浓度与Que 的比值为40:1时,复合纳米粒子对槲皮素包埋率和载药率为最佳,分别为85.21%、2.13%。FTIR、XRD 表明Que 已经成功的包埋进纳米粒子的疏水性内核中,且通过疏水作用力和氢键与蛋白质结合,TEM 结果表明纳米粒子成圆球状且包埋槲皮素前后,纳米粒子无明显变化。热稳定性表明Cas 经过糖基化后制备的二元复合纳米粒子能够更好的保护Que。
本实验制备的均匀稳定的酶法糖基化酪蛋白纳米粒子(n-Cas-Cos)能够显著提高Cas 对Que 的包埋效果和保护效果,提高了Que 的水溶性和稳定性,进一步拓宽了酶法蛋白质糖基化在功能性食品领域的应用。在今后的研究中,可建立动物实验模型(如小鼠)探究n-Cas-Cos-Que 的体内生物利用度和生物学功效(如降血糖、抗癌等),并尝试利用本实验制备的酶法糖基化酪蛋白纳米粒子包埋其他水溶性较差的功能性小分子,将其应用在农业、日化、医药等领域。
