迷迭香中抑制NLRP3炎症小体活性成分的发现
2021-06-21钟祥健李金杰刘嘉琛王楷淇岳建宇尚小雅
钟祥健,周 娜,王 欣,李金杰,刘嘉琛,王楷淇,岳建宇,焦 悦,尚小雅
(北京联合大学 生物活性物质与功能食品北京市重点实验室,北京100191)
迷迭香(Rosmarinus officinalisL.)是唇形科迷迭香属草本植物,原产地为地中海沿岸,目前在我国广西、海南、云南和福建等省均有引种[1];具有独特的香气,除了可用于烹饪外,也具有丰富的药用价值[2]。文献报道迷迭香提取物具有抗氧化、抗炎、抗肿瘤、神经保护、护肝保胃、抗菌、杀虫等作用[3];是我国食品添加剂目录中的一种天然优良食用抗氧化剂,能改善食品品质,延长保鲜时间,在医药、护肤品等领域也有广泛的应用[4]。
炎症是宿主组织对病原体、异物或损伤的一种防御性反应[5],控制炎症过程中介质的释放是抗炎的主要目标[6]。NLRP3炎症小体是炎症反应的核心,由凋亡相关斑点样蛋白(ASC)和含半胱氨酸的天冬氨酸水解酶-1(Caspase-1)等组成的多蛋白复合物,可被尼日利亚菌素(Nigericin)、ATP和病原体等多种因素诱导活化,与癌症、糖尿病、阿尔茨海默病、动脉粥样硬化等疾病密切相关[7]。有研究者提出,通过日常的抗炎饮食(类似地中海饮食),可对一些炎症性疾病起到预防或缓解作用[8-9]。因此,以食用资源为对象,研究清楚其抗炎活性物质的作用基础,将抗炎活性组分添加到各种食品中,开发出能够长期食用的抗炎功能食品,对于预防或缓解心脏病、癌症、阿尔兹海默病和糖尿病等慢性疾病中炎症的发生发展,具有重要的实际意义。
目前,研究报道迷迭香提取物对于炎症反应有很明显的抑制作用[10]。作为抗炎膳食补充剂,可以改善结肠的炎性症状[11];在大鼠足肿胀实验中,可以明显降低体内炎症因子的表达[12]。研究显示,迷迭香抗炎活性与其富含的鼠尾草酸、鼠尾草酚和熊果酸等化合物密切相关[13-14];在脂多糖(LPS)诱导的炎症细胞模型中,能很好地抑制炎症因子的产生[15]。但Arranz等[16]研究发现,鼠尾草酸、迷迭香酸的抗炎活性比粗提物弱,提示:迷迭香中可能存在抗炎活性更强的未知成分。作者所在课题组前期研究发现,将迷迭香中含量较大的上述已知抗炎成分剔除后,剩余组分仍显示较好的抗炎活性,与文献[16]报道一致;同时,液质分析发现活性组分的主成分不是文献报道的抗炎活性成分,进一步推测迷迭香中仍存在活性较好、未被挖掘的抗炎活性因子。为明确迷迭香抗炎物质基础,在体外抗炎活性的筛选结果指导下,对未知抗炎活性组分进行研究,为迷迭香作为抗炎功能食品或膳食补充剂的研发提供科学依据。
1 材料与方法
1.1 材料试剂
迷迭香(Rosmarinus officinalis)原料由哈佛大学医学院李豫伟教授鉴定,样品存于北京联合大学生物活性物质与功能食品北京市重点实验室。Sephadex LH-20凝胶:GE公司产品;柱色谱硅胶(160~200目)和薄层色谱(TLC)硅胶GF254:青岛海洋化工厂产品;十八烷基硅烷键合硅胶(RPC18):美国Teledyne Isco公司产品。石油醚、氯仿、丙酮、甲醇、乙醇及硫酸等试剂:分析纯,北京化学试剂厂产品;高效液相色谱所用色谱级甲醇、乙腈:美国Fisher公司产品;NLRP3和Caspase-1抗体:美国Adipogen公司产品;Caspase-1荧光底物:美国Promega公司产品;细胞培养试剂:美国Gibco公司产品;实验用超纯水:美国Millipore公司产品。
1.2 仪器设备
旋转蒸发仪、中压液相色谱仪:瑞士Buchi公司生产;低压(Flash)快速分离仪(正反相硅胶制备柱/氰基柱为ISCO公司产品):Combiflash公司生产;高效液相色谱仪(Sunfire C18制备柱,19 mm×250 mm,5μm;Sunfire C18分析柱,4.6 mm×250 mm,5μm,Waters 2998型检测器):Waters公司生产;Million-Q Integral纯水系统:德国默克公司产品;Inova 500核磁共振仪:美国Varian公司制造;PromegaGloMax 20/20发光检测仪:美国Promega公司生产;Q Exactive Plus高分辨液质联用分析仪:美国赛默飞公司生产。
1.3 实验方法
1.3.1 抗炎活性筛选方法的建立及活性筛选
1)小鼠原代骨髓巨噬细胞(BMDMs)的分离培养饲养10~12周龄SPF级雌性C57BL/6雌鼠,取脱臼处死后小鼠的双侧股骨,用细注射器吸取DMEM培养基反复冲出骨髓细胞转移至50mL离心管,离心去上清液后用体积分数10%胎牛血清(FBS)及1 g/dL双抗的DMEM培养基重悬细胞,同时加入巨噬细胞集落刺激因子(M-CSF,终质量浓度为25 ng/mL),培养5天后获得BMDMs。
2)刺激方式 取分离培养好的BMDMs,用EDTA与胰酶联合消化后接种于96孔板中,用DMEM高糖培养基培养12 h,之后将培养基替换成质量浓度50 ng/mL LPS的DMEM培养基,预处理4 h后,撤除LPS刺激,粗提物以80μg/mL质量浓度处理1 h,单体化合物以10μmol/L浓度处理1 h(模型组中则不需要此步骤),再在实验孔中加入Nigericin(NLRP3炎症小体激活剂),刺激45 min。
3)样品的处理 经过3 500 r/min离心后的细胞培养上清液,加入1/4体积三氯乙酸,放置-20℃冰箱过夜。再经13 000 r/min、4℃条件下离心20 min,弃上清液加冰丙酮洗1次,100℃金属浴下挥发干丙酮,后加1×loading buffer 40μL振荡混合均匀,在水浴中煮沸,冷却后即为上清液样品。用PBS洗贴壁细胞3次,置于冰上,每孔加入1×loading buffer 200μL,20 min后刮下细胞,吸取细胞裂解液,在水浴锅中煮沸15 min,放置冷却后为细胞裂解样品。
4)Caspase-Glo®1 Inflammasome Assay检测细胞中Caspase-1活性[17]采用Caspase-1活性检测试剂盒测定细胞培养上清液Caspase-1的活性,检测方法对照试剂盒说明书进行操作,之后利用PromegaGloMax 20/20发光检测仪进行检测,由Excel进行数据处理。
5)统计学分析 采用SPSS软件对两组间数据进行独立样本t检验,实验数据以±s表示,与对照组相比,以*P﹤0.05、**P﹤0.01、***P﹤0.001表示差异的显著性。
1.3.2 提取物的分离、纯化与分析
1)原料提取 迷迭香原料10 kg,体积分数100%乙醇预浸12 h,再分别采用体积分数100%、90%和80%乙醇依次超声提取,每个浓度提取1次,每次1 h,合并提取液减压浓缩得到浸膏(1.56 kg)。将迷迭香浸膏经水饱和的乙酸乙酯超声溶解,得到乙酸乙酯相可溶部分和不溶部分。用体外抗炎活性方法进行筛选,发现抗炎活性集中在乙酸乙酯可溶部分。将乙酸乙酯可溶部分正相硅胶拌样,用正相常压硅胶柱色谱分离,以氯仿和甲醇体积比范围100∶0~0∶100为流动相进行梯度洗脱,利用薄层色谱(TLC)点板检测,合并相似洗脱流分,得到8个组分(M1—M8)。将分离得到的8个组分进行体外抗炎活性筛选,发现M1—M6均具有较好的抗炎活性。检测发现,熊果酸和齐墩果酸等类似物主要集中在M2组分中,鼠尾草酚和鼠尾草酸等主要集中在M3组分中,活性最好的M5中几乎不含文献报道的上述抗炎成分。
2)剩余活性组分的分离 将M5用丙酮加热超声溶解,放置析出大量沉淀,母液过Sephadex LH-20凝胶柱色谱,V(氯仿)∶V(甲醇)=2∶1为流动相洗脱,TLC点样显色合并,得到6个组分(M5-1至M5-6)。其中M5-2析出黄色沉淀,将其多次过滤纯化后,TLC点板显色为一个黄色斑点,再经制备型高效液相色谱分离纯化,流动相为体积分数75%甲醇水溶液,出峰时间为21 min,制备得到化合物1(20 mg)。M5-3经常压正相硅胶柱分离得到8个组分(M5-3-1至M5-3-8),富集M5-3-3中TLC显色为黄色的主斑点,分别经Sephadex LH-20凝胶柱色谱纯化,流动相为V(石油醚)∶V(氯仿)∶V(甲醇)=5∶5∶1。再经制备型HPLC进行纯化,流动相为体积分数80%甲醇水溶液,出峰时间分别为15 min和19 min,制备得到化合物2(20 mg)和化合物3(35 mg)。
3)化合物的质谱分析 将分离得到的单体化合物用甲醇溶解,配制成质量浓度为0.5 mg/mL的溶液,过0.22μm滤膜后直接进行高分辨质谱分析。高分辨质谱条件参数:电喷雾离子源正离子模式,扫描模式为Full MS(m/z:100~500)/dd-MS2,鞘气流量50 units,辅助气流量10 units,离子源温度为380℃,毛细管温度350℃。分辨率为70 000,碰撞能量为55 V。实验流程见图1。
2 结果与分析
2.1 化合物的结构鉴定
化合物1为黄色无定形粉末。1H-NMR谱的较高场显示1个甲氧基单峰质子信号δH3.83(3H,s),在低场区有7个芳环烯氢信号δH6.32(1H,d,J=1.6 Hz)和6.69(1H,d,J=1.6 Hz),δH6.80(1H,s),δH6.91(2H,d,J=8.7 Hz)和7.91(2H,d,J=8.7 Hz);13C-NMR谱显示16个碳信号(图2),推断结构是一个甲氧基取代的黄酮。HRESIMS一级质谱显示m/z:285.07526[M+H]+(理论计算值:285.07575),分子式为C16H13O5;二级碎片离子有270.05176、243.06042、242.05698、213.05431、167.03372、160.05173、145.02831、124.01554、119.04924、111.04424(图3);根据碎片离子推测此结构是4′,5-二羟基-7-甲氧基黄酮(图4)。将该化合物的核磁数据与文献[18]比对发现,二者数据一致,故确证了所推导结构的正确性。
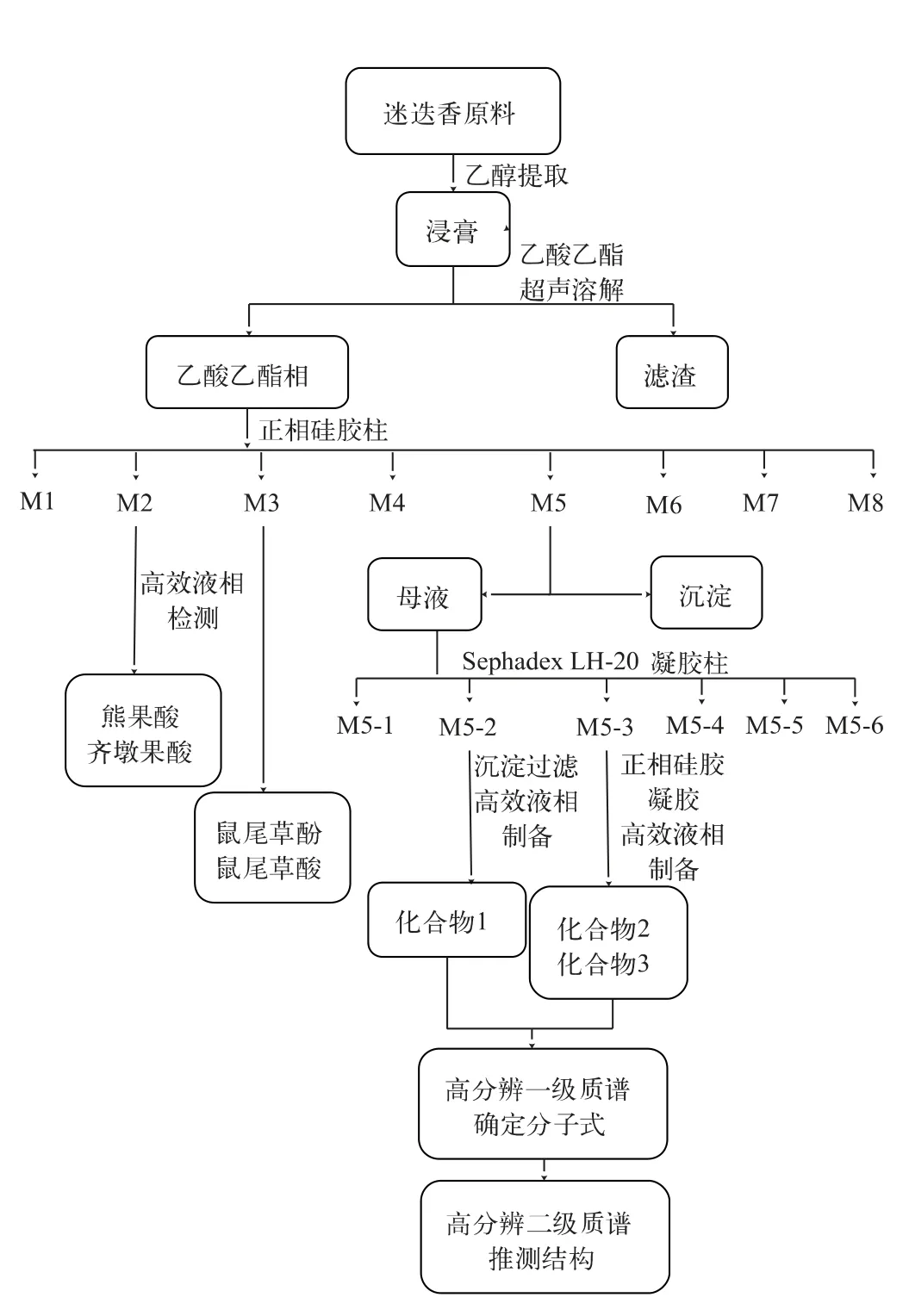
图1 单体化合物分离、纯化与分析流程Fig.1 Separation,purification and analyses of monomeric compounds
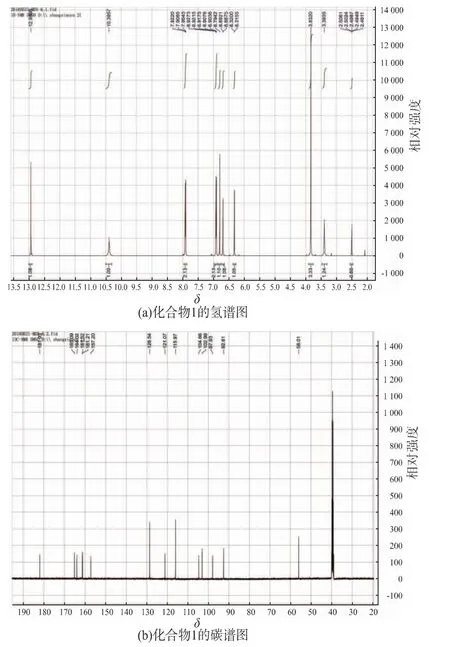
图2 化合物1的核磁图Fig.2 NMR spectra of compound1
化合物2为黄色无定形粉末。1H-NMR谱数据显示在低场有7个芳环烯氢质子信号δH6.38(1H,d,J=2.4Hz),6.79(1H,d,J=2.4Hz),7.11(2H,d,J=8.9Hz),8.06(2H,d,J=8.9Hz),6.94(1H,s);在较高场有2个甲氧基单峰质子信号δH3.85(3H,s)和3.87(3H,s);13C-NMR谱显示17个碳信号,其中有2个甲氧基碳信号δC56.3和56.8,和1个羰基碳信号δC182.7(图5),推断该物质为黄酮类结构,且有2个甲氧基存在。HRESIMS一级质谱显示m/z:299.09100[M+H]+(理论计算值:299.09140),分子式为C17H15O5;二级碎片离子有284.06747、256.07257、227.06996、167.03372、146.85710、124.01555(图6);根据碎片离子推测此结构是5-羟基-7,4′-二甲氧基黄酮(图7)。将该化合物的核磁数据与文献[19]作比较发现,二者数据一致,故确证了所推导结构的正确性。
化合物3为黄色粉末。1H-NMR谱显示该化合物存在3个甲氧基单峰质子信号,分别为:δH3.73(3H,s),3.86(3H,s)和3.93(3H,s);6个烯氢质子信号δH6.94(1H,s),6.95(1H,s),δH7.11(2H,d,J=8.8Hz)和8.07(2H,d,J=8.8Hz);在13C-NMR谱显示18个碳信号(图8),推断是3个甲氧基取代的黄酮。HRESIMS一级质谱显示m/z:329.101 44[M+H]+(理论计算值:329.101 96),分子式为C18H17O6;二级碎片离子有313.070 13、296.067 44、285.075 35、269.075 84、268.072 51、253.049 27、240.077 74、225.054 31、169.064 61、154.025 88、136.015 38、133.064 70、132.056 90、108.020 82(图9);根据碎片离子推测此结构是5-羟基-7,8,4′-三甲氧基黄酮(图10)。将该化合物核磁数据与文献[20]比对发现,二者数据一致,故确证了所推导结构的正确性。
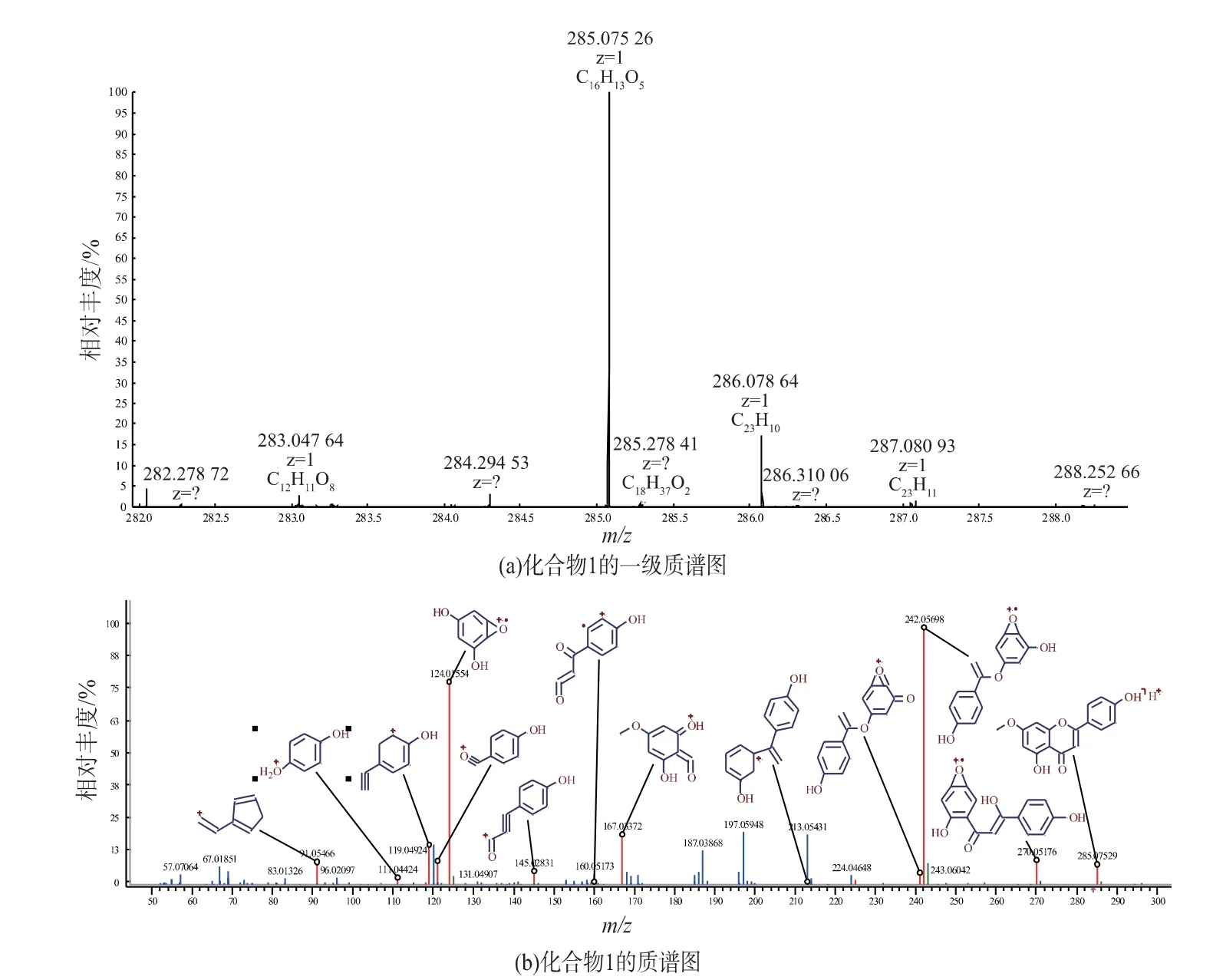
图3 化合物1的质谱图Fig.3 Mass spectra of compound 1
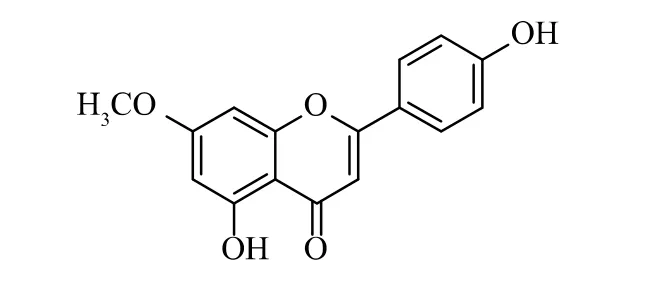
图4 化合物1的结构式Fig.4 Structure of compound 1
图5 化合物2的核磁图Fig.5 NMR spectra of compound 2
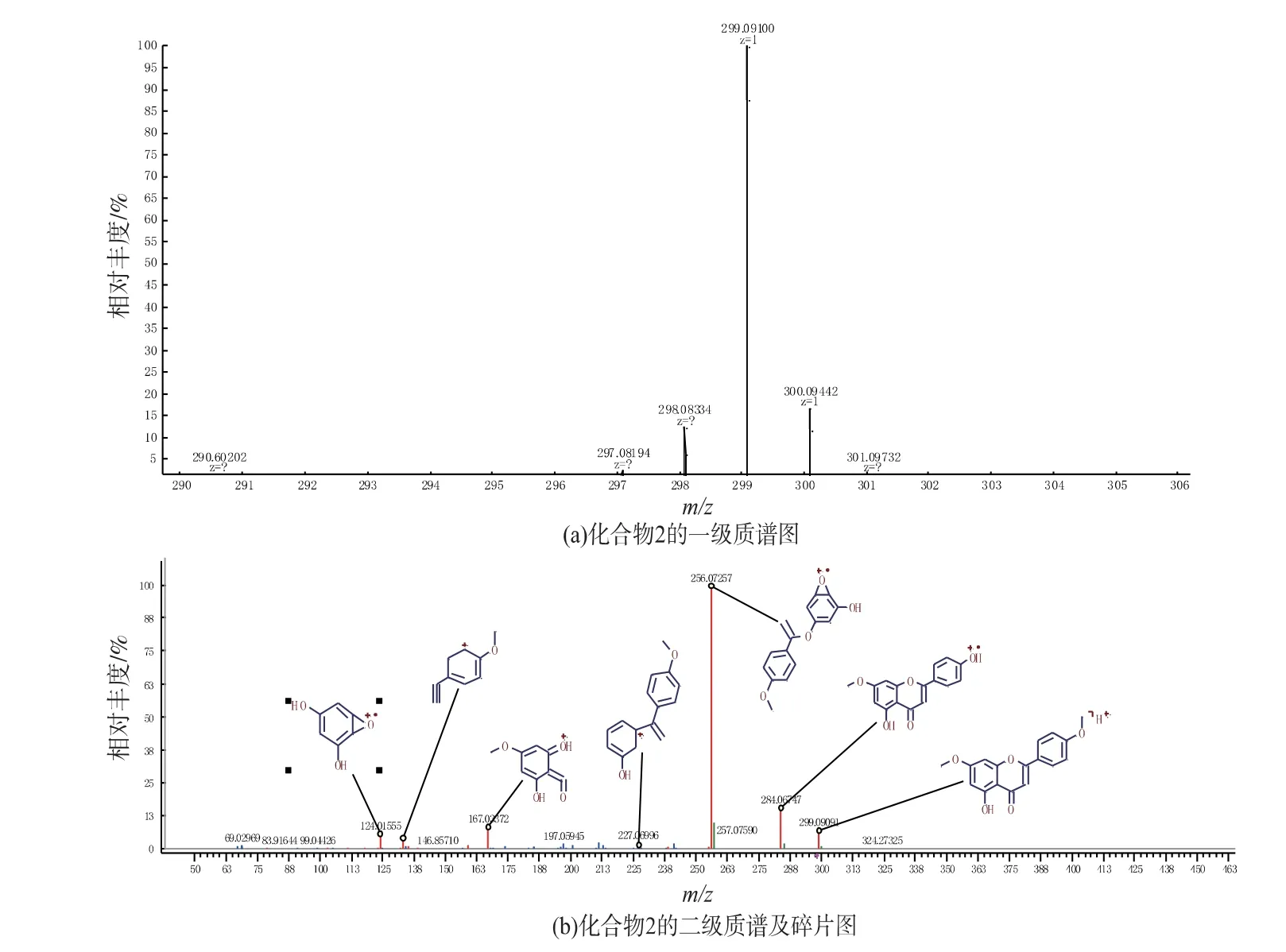
图6 化合物2的质谱图Fig.6 Mass spectra of compound 2
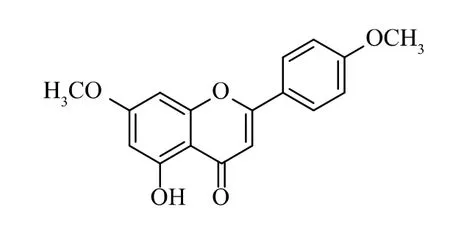
图7 化合物2的结构式Fig.7 Structure of compound 2
图8 化合物3的核磁图Fig.8 NMR spectra of compound 3
2.2 化合物的核磁波谱数据
化合物1:1H-NMR(DMSO,500 MHz),δH:3.83(3H,s,-OMe-7),6.32(1H,d,J=1.6 Hz,H-6),6.69(1H,d,J=1.6 Hz,H-8),6.80(1H,s,H-3),6.91(2H,d,J=8.7 Hz,H-3′,5′),7.91(2H,d,J=8.7 Hz,H-2′,6′),12.94 (1H,s,OH-5);13C-NMR(DMSO,125 MHz),δC:56.0(-OMe-7),92.6(C-8),97.9(C-6),102.9(C-3),104.7(C-10),115.9(C-3′,5′),121.1(C-1′),128.6(C-2′,C-6′),157.2(C-5),161.2(C-9),161.3(C-2),164.0(C-4′),165.1(C-7),181.9(C-4)。
化合物2:1H-NMR(DMSO,500 MHz),δH:3.85(3H,s,-OMe-4′),3.87(3H,s,-OMe-7),6.38(1H,d,J=2.4Hz,H-6),6.79(1H,d,J=2.4Hz,H-8),6.94(1H,s,H-3),7.11(2H,d,J=8.9 Hz,H-3′,H-5′),8.06(2H,d,J=8.8Hz,H-2′,H-6′),12.92(1H,s,OH-5);13C-NMR(DMSO,125 MHz),δC:56.3(-OMe-4′),56.8(-OMe-7),93.5(C-8),98.8(C-6),104.4(C-3),105.4(C-10),115.3(C-3′,C-5′),123.4(C-1′),129.1(C-2′,C-6′),157.9(C-9),161.9(C-4′),163.1(C-5),164.3(C-2),165.9(C-7),182.7(C-4)。
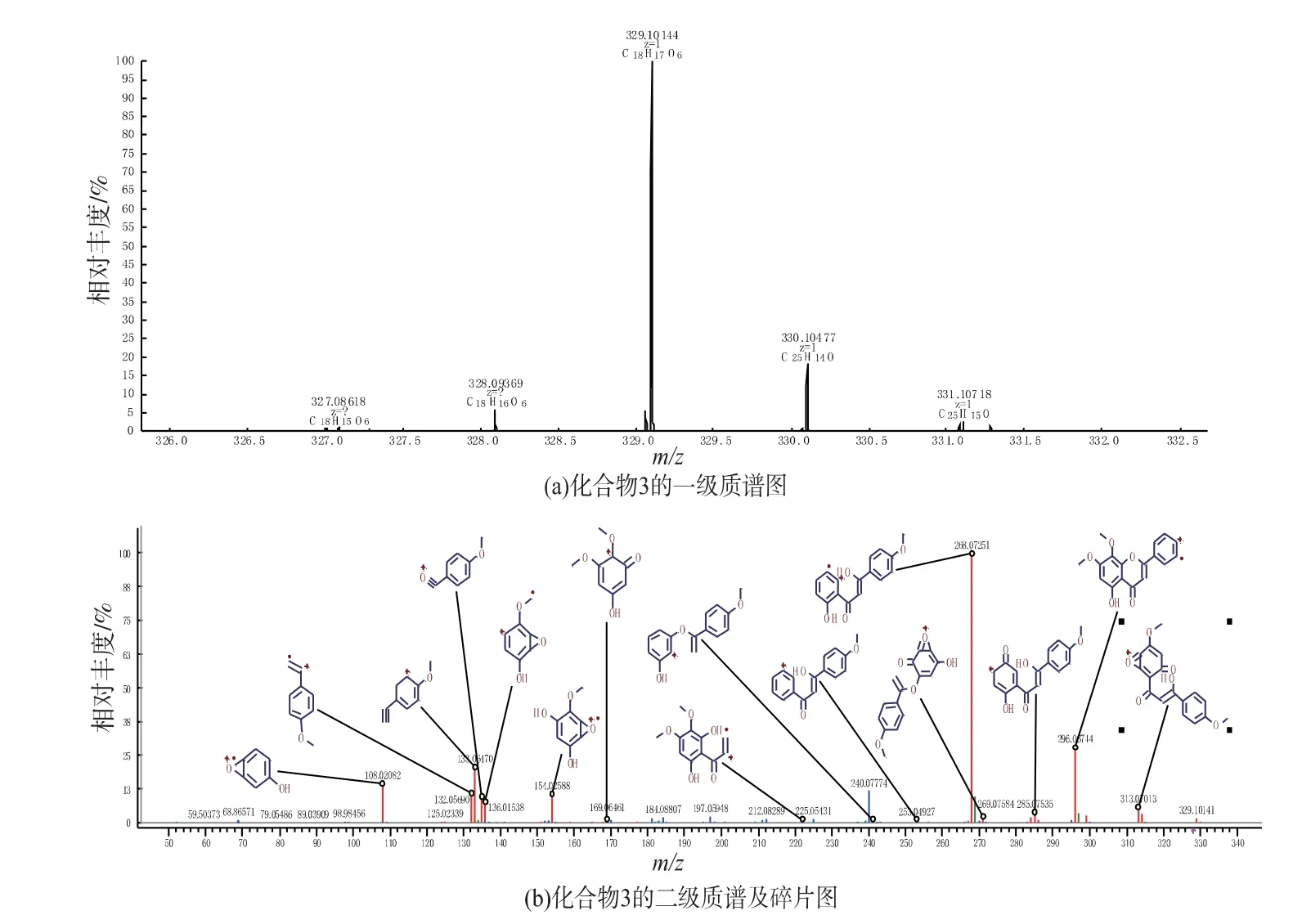
图9 化合物3的质谱图Fig.9 Mass spectra of compound 3
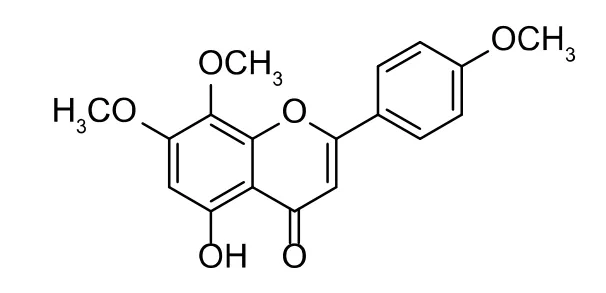
图10 化合物3的结构式Fig.10 Structure of compound 3
化合物3:1H-NMR(DMSO,500 MHz),δH:3.73,(3H,s,-OMe-4′),3.86(3H,s,-OMe-7),3.93(3H,s,-OMe-8),6.94(1H,s,H-3),6.95(1H,s,H-6),7.11(2H,d,J=8.8 Hz,H-3′,H-5′),8.07(2H,d,J=8.8 Hz,H-2′,H-6′),12.89(1H,s,OH-5);13C-NMR(DMSO,125 MHz),δC:55.6(-OMe-4′),56.5(-OMe-7),60.1(-OMe-8),91.7(C-6),103.4(C-3),105.2(C-10),114.6(C-3′,5′),122.7(C-1′),128.3(C-2′,C-6′),131.9(C-8),152.1(C-9),152.7(C-5),158.7(C-7),162.4(C-4′),163.6(C-2),182.3(C-4)。
2.3 抗炎活性筛选结果
通过模型组与空白组对比可以看出,当给细胞加入炎症小体激活剂Nigericin后,可以明显刺激炎症小体的活性,提示造模成功。当已知阳性药物MCC950以10μmol/L浓度处理细胞后,可以明显抑制Nigericin诱导炎症小体的活性。以上说明实验体系成功,可以用于评价其他化合物对炎症小体的影响。将乙酸乙酯相、乙酸乙酯相经正相硅胶分离后的不同组分及单体化合物进行体外抑制Nigericin诱导的炎症小体模型抗炎活性筛选,结果见图11。
对粗提物的活性测试结果显示,乙酸乙酯相以80μg/mL质量浓度处理细胞后,相对炎症小体活力为0.643 3,显示一定的抗炎活性。经正相硅胶分离后的不同部位同样以80μg/mL质量浓度处理细胞,M5组分的相对炎症小体活力为0.610 6,显示最好的抗炎活性,因此选择此部位进行下一步的分离纯化。
在抗炎活性筛选中,单体化合物和阳性药物MCC950一样以10μmol/L浓度处理细胞。阳性对照MCC950的相对炎症小体活力为0.311 2,而化合物1为0.331 2,比迷迭香中已知的鼠尾草酚和鼠尾草酸具有更强的抗炎活性,且显示活性与阳性对照组相当。
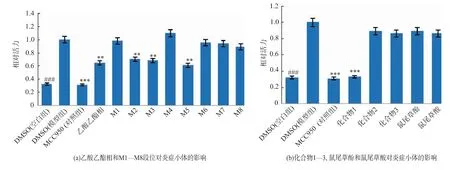
图11 抗炎活性筛选结果Fig.11 Results of anti-inflammatory activities screening
3 结语
炎症反应涉及肿瘤、糖尿病、阿尔兹海默病等疾病的病理过程,在安全有效的前提下抑制炎症反应,对于炎症性相关疾病的预防与改善具有重要意义。有较多文献报道了迷迭香提取物抗炎活性及安全性评价,发现主要抗炎活性成分是鼠尾草酸、鼠尾草酚和熊果酸等[13,16]。作者将迷迭香中已知的抗炎活性成分剔除后,利用Nigericin诱导的炎症小体模型进行活性筛选,通过核磁和高分辨质谱数据确证结构,首次从迷迭香中发掘具有抗炎活性的3个黄酮类化合物,且化合物1(4′,5-二羟基-7-甲氧基黄酮)的抗炎活性与阳性对照组相当,为迷迭香作为改善炎症发展的功能食品或膳食补充剂提供理论依据。
作者所在课题组前期对活性粗提物用液质联用分析后发现,仍存在未被挖掘的其它类型抗炎活性因子。因此,还需对迷迭香活性部位继续进行深入、系统研究,以期发现更多强抗炎活性的结构,为开发应用迷迭香作为预防或改善相关慢性疾病炎症反应的功能食品提供更多的理论支撑和检测依据。
