不同辅因子NADPH水平对谷氨酸棒杆菌生长及产物合成的影响
2021-06-21王路平徐建中张伟国
王路平,徐建中*,张伟国
(1.江南大学 生物工程学院,江苏 无锡214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122)
L-赖氨酸是人类和动物所必需的、自身不能合成的八大必需氨基酸之一。研究报道,自赖氨酸发酵开始以来,谷氨酸棒状杆菌(Corynebacterium glutamicum)及其亚种是发酵赖氨酸的主要选择,但最近大肠杆菌(Escherichia coli)也在赖氨酸发酵过程中发挥着重要作用[1-3]。以葡萄糖为原料时,C.glutamicum中有5个途径参与L-赖氨酸合成:糖酵解途径、磷酸戊糖途径(PPP)、三羧酸(TCA)循环、补给途径(CO2固定反应)和L-赖氨酸终端合成途径(图1)。20世纪80年代末和90年代,开发了用于该微生物的各种基因工程工具,并将这些分子技术应用于菌株改良,旨在增强赖氨酸生产能力[4-5]。这使得理论代谢工程不仅可以用于赖氨酸生物合成途径,而且可用于中枢代谢,从而,增加前体供应和NADPH再生成为研究者用于增强赖氨酸生物合成的着力点。
还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)是细胞代谢中最重要的氧化还原载体,不仅作为催化底物分解代谢的电子受体,也为能量依赖型的氧化还原反应提供还原力[6],是多种代谢产物合成中的主要驱动力。其影响的代谢产物包括赖氨酸[7]、缬氨酸[8]、精氨酸[9]、鸟氨酸[10]、氯丙酸酯[11]、番茄红素[11]和萜类化合物[12]。 已有文献报道,在C.glutamicum中每合成1 mol L-赖氨酸需要消耗4 mol的NADPH[13]。因此,为了增加C.glutamicum生物合成途径中L-赖氨酸的积累,提高C.glutamicum代谢途径中NADPH量或降低L-赖氨酸合成途径中NADPH需求量是辅因子工程育种常用的策略。然而,作者前期研究发现,胞内过量的NADPH会阻碍细胞对糖的利用,降低菌体生长量和L-赖氨酸积累量。虽然有文献指出,控制胞内辅因子平衡是维持细胞正常代谢的一项基本需求[14],但辅因子NADPH是如何调控细胞内代谢水平,进而影响产物合成的机制还不清晰。

图1 谷氨酸棒杆菌中L-赖氨酸和NADPH合成代谢网络示意图Fig.1 Metabolic pathways of L-lysine and NADPH in C.glutamicum
本研究的目的是详细解析谷氨酸棒杆菌中赖氨酸与NADPH水平之间的关联及其代谢调控机制。在这项工作中,以赖氨酸高产菌C.glutamicumXQ-5作为出发菌株,通过基因工程手段分别构建出一种高NADPH水平菌株C.glutamicumXQ-5Δpgi::(zwf-gnd)和一种低NADPH水平菌株C.glutamicumXQ-5Δzwf::pgi,并比较分析其与出发菌胞内微环境的差异。通过出发菌与工程菌之间的转录组数据分析,重组菌C.glutamicumXQ-5Δpgi::(zwf-gnd)中编码天冬氨酸-α-脱羧酶的panD基因表达水平提高,且被证实为重组菌C.glutamicumXQ-5Δpgi::(zwf-gnd)赖氨酸产量反而降低的原因之一。这些数据为通过改变胞内NADPH水平来探究其对L-赖氨酸合成的调节机制的可行性提供了有力依据。
1 材料与方法
1.1 菌株和质粒
本研究中使用的菌株和质粒列于表1,使用的引物序列列于表2。

表1 本研究中用到的菌种和质粒Table 1 Strains and plasmids used in this study

表2 本研究中用到的引物序列Table 2 Primers used in this study
1.2 培养基和生长条件
Luria-Bertani(LB)培养基(g/L):蛋白胨10,酵母提取物5,NaCl 10;pH 7.0。LB培养基用于培养E.coliJM109细菌,并在旋转振荡器上以100 r/min在37℃下进行基因克隆。
LB-葡萄糖(LBG)培养基(g/L):葡萄糖5,蛋白胨10,酵母提取物5,NaCl 10;pH 7.0。在LBG培养基中,30℃、100 r/min的条件下培养谷氨酸棒杆菌。
EPO培养基(g/L):葡萄糖5,蛋白胨10,酵母提取物5,NaCl 10,吐温-80 1;pH 7.0。在121℃下湿加热灭菌20 min,过滤除菌后,向培养基中加入4 g异烟肼和30 g甘氨酸。
LB-脑心浸液-山梨糖醇(LBHIS)培养基(g/L):蛋白胨5,酵母提取物2.5,NaCl 10,脑心浸液18.5,山梨醇91;pH 7.0。
CGXII培养基(g/L):(NH4)2SO436,尿素5,KH2PO4l,K2HPO41,MgSO4·7H2O 0.25,3-(N-吗啡啉)-丙磺酸42,CaCl20.010,FeSO40.01,MnSO40.01,ZnSO40.01,CuSO40.000 2,NiCl20.000 02,生物素0.000 2,原儿茶酸0.000 03;115℃灭菌10 min,用于L-赖氨酸发酵。
冯可儿和高潮就颁奖典礼的举办地点问题,唇枪舌剑,互不相让,争论得脸红脖子粗。见冯可儿情急之下说出了题外话,田卓忙出来打圆场,说,这个事情,一时难以讨论出个结果。至于具体在哪里举办,反正还有段时间,我们都考虑考虑,下周一的例会上再讨论吧。
发酵培养基(g/L):葡萄糖40,(NH4)2SO436,MgSO4·7H2O 1.5,FeSO40.02,MnSO40.02,KH2PO4l,K2HPO41,玉米浆35,甜菜糖蜜12,烟酰胺0.008,甜菜碱0.05,硫胺素0.000 45,生物素0.000 85,CaCO340;pH 7.0,115℃灭菌10 min。5 mL种子液转接到装有50 mL发酵培养基的500 mL的摇瓶中,30℃、100 r/min发酵40 h。

续表2
1.3 质粒和菌株构建
用限制性核酸内切酶(Takara公司)和DNA Ligase Kit Ver 2.0(Takara公司)构建质粒pK18mobsacB-Δzwf::pgi和pK18mobsacB-Δpgi::(zwf-gnd),然后将质粒转化到C.glutamicumXQ-5中[21]。制备C.glutamicumXQ-5的感受态菌株,质粒pK18mobsacB-Δzwf::pgi和pK18mobsacB-Δpgi::(zwf-gnd)分别用电穿孔导入C.glutamicumXQ-5中,分别得到C.glutamicumXQ-5/pK18mobsacB-Δzwf::pgi和C.glutamicumXQ-5/pK18mobsacBΔpgi::(zwf-gnd)。重组菌株C.glutamicum XQ-5Δzwf::pgi和C.glutamicumXQ-5Δpgi::(zwf-gnd)通过基因组整合获得[22]。将敲除质粒pK18mobsacBΔA::B电穿孔到谷氨酸棒杆菌的感受态细胞中,并使用谷氨酸棒杆菌的双交换同源重组策略,通过两个菌株筛选重组菌株。
1.4 胞内辅酶II NADP(H)的测定
收集400万~500万细菌,加入0.9 mL酸性(碱性)提取液,超声破碎1 min(200 W,超声2 s,停1 s),盖紧后煮沸5 min,冰浴中冷却后,10 000g、4℃离心10 min,取上清液200μL至另一新的离心管中,加入等体积的碱性(酸性)提取液使之中和,10 000g、4℃离心10 min,取上清液。随后,以试剂盒NADP/NADPH Quantification Colorimeteric Kit特异性检测NADP+和NADPH,并计算NADPH/NADP+[23]。
1.5 胞内辅酶I NAD(H)的测定
收集400万~500万细菌,加入0.5 mL酸性(碱性)提取液,超声破碎1 min(200 W,超声2 s,停1 s),盖紧后煮沸5 min,冰浴中冷却后,10 000g、4℃离心10 min,取上清液200μL至另一新的离心管中,加入等体积的碱性(酸性)提取液使之中和,10 000g、4℃离心10 min,取上清液。随后,以试剂盒NAD/NADH Quantification Colorimeteric Kit特异性检测NAD+和NADH,并计算NADH/NAD+[23]。
1.6 胞内ATP、ADP、AMP的测定
利用0.6 mol/L HClO4(PCA)抽提重组菌C.glutamicumXQ-5Δpgi::(zwf-gnd),C.glutamicumXQ-5Δzwf::pgi和出发菌C.glutamicumXQ-5胞内ATP、ADP和AMP。随后,采用HPLC技术对抽提液进行分析,测定胞内ATP、ADP和AMP的浓度。将50 mL细胞样品从培养物中取出,立即在液氮中冷冻60 s,并储存在-20℃。通过HPLC检测细胞内ATP的浓度。为了提取ATP,将10 mL的0.6 mol/L HClO4加入到细胞沉淀中并混合,用磁力搅拌器彻底搅拌10 min。将混合物以10 000g离心10 min以收集上清液。将另外10 mL的0.6 mol/L HClO4加入到沉淀中,充分混合10 min,离心后收集上清液。将两部分上清液在25 mL容量瓶中混合,并用0.6 mol/L HClO4补足至25 mL。取10 mL所制备的溶液,并用0.8 mol/L KOH将pH值调节至7.0。在4℃保持30 min后,通过过滤除去晶体KClO4(滤纸孔径=0.22μm),然后在应用HPLC柱之前,用磷酸盐缓冲液(pH 7.0)稀释至25 mL。HPLC分析的进样量为10μL。使用体积分数80%10 mmol/L KH2PO4(pH 7.0)和体积分数20%甲醇的混合物作为流动相,流速为1.2 mL/min。紫外检测器的波长设置为260 nm,柱温控制在25℃[24]。
1.7 通过RNA-seq进行转录组分析
从新划线的琼脂平板上挑取单个菌落的谷氨酸棒杆菌原始菌株(C.glutamicumXQ-5)或重组菌株 (C.glutamicumXQ-5Δpgi::(zwf-gnd)和C.glutamicumXQ-5Δzwf::pgi),并接种到LBG培养基中。在30℃过夜培养12~16 h后,分别收获细胞,洗涤并转移至标准CGXII基本培养基,初始OD600nm为0.1。在RNA提取之前,将培养物在30℃下再温育12 h。将10 mL收集的细胞在液氮中快速冷冻,用RNAprep纯试剂盒(TIANGEN)处理以提取总细菌RNA,并在干冰环境递送至GENEWIZ公司进行转录组测序分析(https://www.genewiz.com/)。对于注释,使用谷氨酸棒杆菌ATCC13032(NC_003450.3)的基因组作为参考。通过使用错误发现率 (FDR)≤0.05和倍数变化log2Ratio标准,测定样品C.glutamicumXQ-5与重组菌C.glutamicumXQ-5Δpgi::(zwf-gnd)和C.glutamicumXQ-5Δzwf::pgi之间的差异表达基因。
1.8 生长曲线测定
将来自新鲜划线的琼脂平板上的菌株C.glutamicumXQ-5,C.glutamicumXQ-5Δpgi::(zwf-gnd)和C.glutamicumXQ-5Δzwf::pgi的单个菌落转移至液体LBG培养基中,并在30℃下温育16 h。在生长实验之前以200 r/min摇动。收获培养物,洗涤并重新悬浮在新鲜的指定培养基中至初始OD600nm为0.1。然后通过在指定的时间点测量600 nm处的光密度来监测细胞生长,并显示为至少3次独立重复的平均值。
1.9 摇瓶发酵
将谷氨酸棒杆菌单菌落接种到LBG液体培养基中。将细菌在30℃、100 r/min的摇床中培养约10 h。用不含碳源的CGXII培养基洗涤最终悬浮液3次。将悬浮液接种到60 mL CGXIIG(CGXII培养基中加入40 g/L葡萄糖)液体培养基中。在500 mL三角烧瓶中,于30℃、100 r/min的振荡器中培养48 h。每4 h测量OD600nm和L-赖氨酸的浓度。
1.10 统计分析
各实验至少独立进行3次,数据表示为平均值和标准偏差(SD)。为了比较实验组数据之间的统计差异,使用了学生t检验。
2 结 果
2.1 重组菌和出发菌胞内腺嘌呤核苷酸(ATP、ADP和AMP)、吡啶核苷酸(NAD+、NADH、NADP+和NADPH)的变化
使用赖氨酸生产菌株C.glutamicumXQ-5作为出发菌株,利用基因敲除和替换策略,作者分别用将pgi基因敲除替换为Ptac-pgi-rrnBT1T2表达框以强化磷酸戊糖途径和将zwf基因敲除替换为Ptac-pgi-rrnBT1T2表达框以阻断磷酸戊糖途径的方式成功地构建了重组菌株C.glutamicumXQ-5Δpgi::(zwf-gnd)和C.glutamicumXQ-5Δzwf::pgi。为了确定出发菌株C.glutamicumXQ-5经过改造后是否胞内NADPH水平有所改变,对出发菌株和重组菌株进行摇瓶发酵48 h,然后对其胞内进行吡啶核苷酸含量测定,具体数据见表3-4。
从表3可知,重组菌株C.glutamicumXQ-5Δpgi::(zwf-gnd)胞内NADPH水平从起始菌株的每1万个细胞含3.57×10-8μmol提高到1.80×10-7μmol,胞内NADPH/NADP+提高了109.9%;胞内NADH略低于出发菌株,这是由于糖酵解途径的阻断,碳流量经过磷酸戊糖途径,导致NADH的合成量减少。重组菌株C.glutamicumXQ-5Δzwf::pgi胞内NADPH水平从起始菌株的每1万个细胞含3.57×10-8μmol下降到1.12×10-8μmol,胞内NADPH/NADP+降低了28.8%。谷氨酸棒杆菌胞内存在多种NADPH合成代谢途径,而其胞内的NADPH主要是通过PPP途径合成[13,19-20],阻断该途径大大降低了NADPH的合成量。同时胞内NADH略高于出发菌株,这是糖酵解途径加强的结果。与此同时,由于胞内NADPH水平的降低,NAD(H)/NADP(H)的氧化平衡被打破,部分NADH在NAD激酶的作用下合成NADPH[13,25-26]。
从表4可知,重组菌株C.glutamicumXQ-5Δpgi::(zwf-gnd)胞内ATP比出发菌株提高了29.7%,而重组菌株C.glutamicumXQ-5Δzwf::pgi胞内ATP含量提高了111.2%。这是由于NADH、NADPH与ATP合成具有密不可分的联系,但NADPH几乎仅用于还原性生物合成,用作氢和电子的供体,而NADH则主要用于产生ATP,为氧化形成ATP的电子传递链提供电子,从而使胞内的ADP和AMP转换成ATP[27]。因此,NADH和NADPH含量的变化直接影响ATP的合成,从而关系着胞内腺嘌呤核苷酸的平衡。
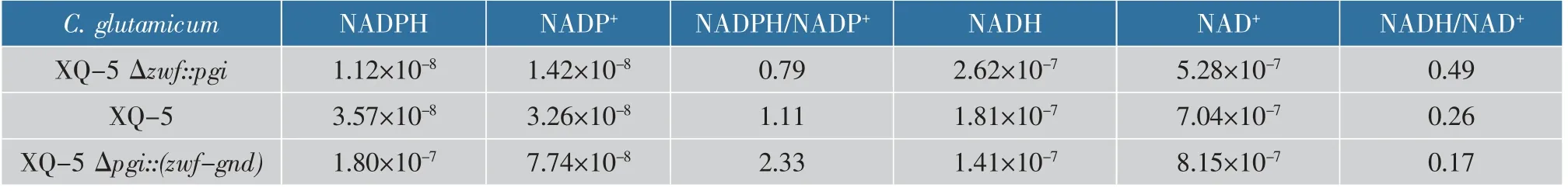
表3 重组菌和出发菌胞内每1万个细胞的吡啶核苷酸(NAD+、NADH、NADP+和NADPH)含量Table 3 Contents of intracellular pyridine nucleotides(NAD+,NADH,NADP+and NADPH)in each 104 cells of recombinant and original bacteria 单位:μmol

表4 重组菌和出发菌胞内腺嘌呤核苷酸(ATP、ADP和AMP)含量Table 4 Contents of intracellular adenine nucleotides(ATP,ADP and AMP)in recombinant and original bacteria单位:mmol/L
2.2 重组菌与出发菌的生长参数比较
尽管重组菌C.glutamicumXQ-5Δpgi::(zwfgnd)的细胞内NADPH水平增加,但由于糖酵解途径的阻断,在以葡萄糖为单一碳源的CGXIIG发酵培养基(葡萄糖的初始质量浓度为40 g/L)中,重组菌的生长被延缓,但最终菌体量与出发菌相似,见图2(a),并且发酵结束的赖氨酸产量15 g/L低于发酵结束后出发菌株的赖氨酸产量17 g/L,见图4(a)。当发酵培养基富含营养(葡萄糖的初始质量浓度为100 g/L)时,重组菌的生长与起始菌株的生长相似,见图2(b),但发酵结束后重组菌株的赖氨酸产量41 g/L仍然低于发酵后起始菌株的赖氨酸产量49 g/L,见图4(b)。
重组菌C.glutamicumXQ-5Δzwf::pgi的细胞内是阻断了PPP途径,强化了糖酵解途径。其在CGXIIG发酵培养基中时,发酵16 h之前生长速率高于出发菌株,发酵16 h之后生长速率开始下降并低于出发菌株,最终在发酵32 h后进入平缓期,最终OD600nm为17,远远低于出发菌株,见图2(a)。并且其葡萄糖消耗有10 g/L的剩余,见图3(a)。其发酵结束后的赖氨酸产量3 g/L远低于出发菌株的17 g/L,见图4(a)。发酵16 h,其生长速率高于出发菌株可能是糖酵解途径的加强引起的,生长前期NADPH的匮乏暂时由NADH转化的NADPH弥补[13],维持细胞生长。NADPH是细胞生长与代谢的重要辅因子之一,由于NADPH主要合成途径PPP的阻断和NADPH的不断消耗,发酵16 h以后细胞生长速率逐渐降低。这一现象进一步表明了NADPH影响菌体生长速率和菌体量。发酵结束后,葡萄糖的剩余和赖氨酸产量的减少说明了NADPH对于细胞的糖代谢和赖氨酸合成至关重要。在富含营养的发酵培养基中时,重组菌C.glutamicumXQ-5Δzwf::pgi与出发菌株的生长情况相似,见图2(b),发酵结束后仍有3 g/L的残糖,见图3(b),且赖氨酸产量为28 g/L,见图4(b)。
2.3 不同NADPH水平的菌株内胞内副产物合成的比较
NADPH是代谢网络中的关键辅助因子之一,在氨基酸生产菌株的生化反应和生理功能中起重要作用。为了进一步研究胞内不同NADPH水平对发酵副产物(如有机酸和其他氨基酸)的影响,在发酵结束后测定发酵液中有机酸和副产物氨基酸含量。

图2 重组菌与出发菌在CGXIIG培养基和发酵培养基的生长情况Fig.2 Growth of recombinant strain and original strain in CGXIIG medium and fermentation medium

图3 重组菌与出发菌在CGXIIG培养基和发酵培养基的葡萄糖消耗情况Fig.3 Glucose consumption of recombinant strain and original strain in CGXIIG medium and fermentation medium
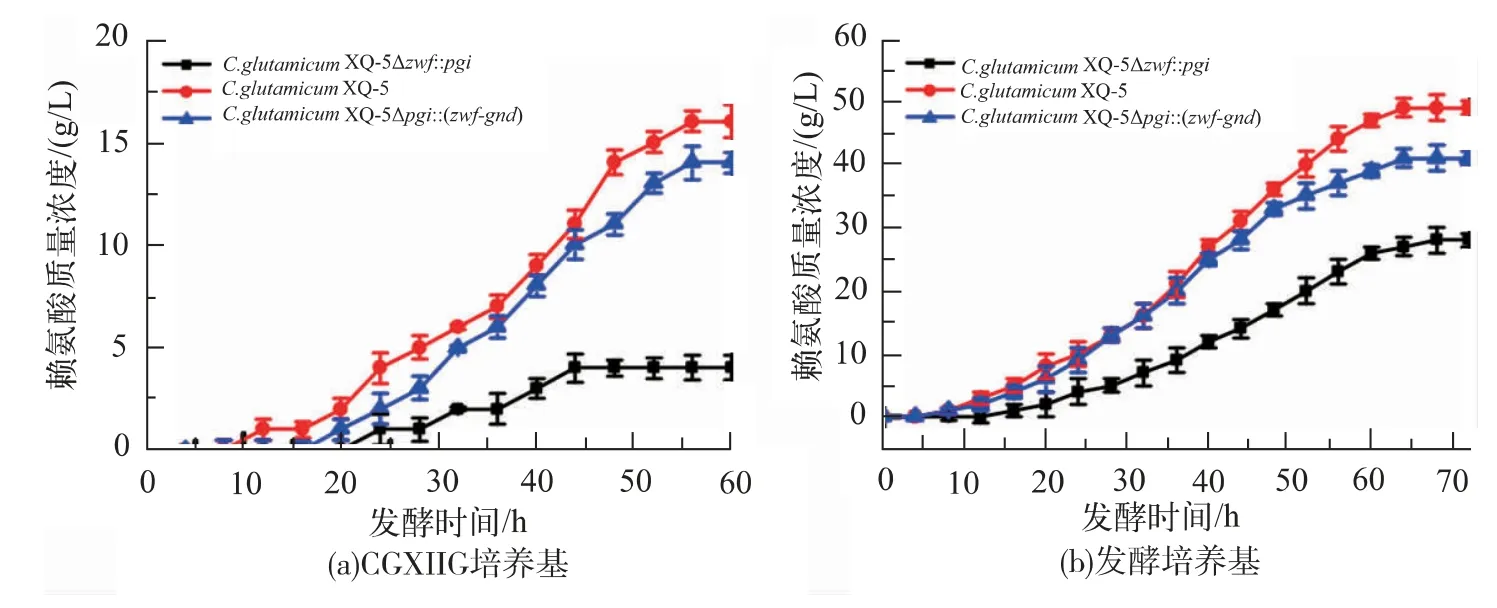
图4 重组菌与出发菌在CGXIIG培养基和发酵培养基的赖氨酸合成情况Fig.4 Lysine synthesis of recombinant strain and original strain in CGXIIG medium and fermentation medium
由表5可知,阻断糖酵解途径、强化PPP途径后,与出发菌株C.glutamicumXQ-5相比,重组菌C.glutamicumXQ-5Δpgi::(zwf-gnd)发酵液中副产物氨基酸明显增加:缬氨酸、亮氨酸、异亮氨酸、苏氨酸、谷氨酸分别增加了27.6%、55.3%、27.5%、19.5%、26.2%。而发酵液中的丙酮酸和乳酸含量与出发菌相比,分别减少了24.5%和65.7%。重组菌C.glutamicumXQ-5Δzwf::pgi发酵液中的副产物氨基酸含量明显降低:缬氨酸、亮氨酸、异亮氨酸、苏氨酸、谷氨酸分别降低了37.1%、55.3%、73.5%、50.3%、52.7%。而发酵液中的丙酮酸和乳酸含量与出发菌相比,分别增加了51.1%和5.1%。NADPH是多种代谢产物合成的驱动力,尤其是氨基酸。多项研究表明,提高胞内NADPH水平可以增强多种氨基酸的合成,如赖氨酸[7]、谷氨酸[28]、苏氨酸[28]、亮氨酸[28]、异亮氨酸[28]、缬氨酸[8]、精氨酸[10]和鸟氨酸[9]等。所以胞内NADPH水平的变化也会引起胞内相应副产物氨基酸发生相应改变。同样,胞内NADPH的变化对胞内丙酮酸和乳酸也会产生相应影响。且由于胞内NADPH水平改变,胞内以NADPH为辅酶的氨基酸,如以丙酮酸为前体合成的丙氨酸族氨基酸,和经过丙酮酸流向三羧酸循环后以草酰乙酸为前体合成的天冬氨酸族氨基酸,其合成会发生相应变化,使得丙酮酸等代谢途径上游的中间产物得以累积或减少。

表5 重组菌和出发菌发酵液中副产物氨基酸和有机酸含量Table 5 Concentration of amino acid and organic acid in fermentation of recombinant and original bacteria

图5 差异表达基因的火山图Fig 5 Volcano plot of differentially expressed genes
2.4 重组菌株和原始菌株的转录组分析比较
为了进一步揭示不同NADPH水平的出发菌C.glutamicumXQ-5和重组菌C.glutamicumXQ-5Δpgi::(zwf-gnd)以及出发菌C.glutamicumXQ-5和重组菌C.glutamicumXQ-5Δzwf::pgi在转录组水平上的差异,收集在摇瓶发酵了12小时的样品,并进行RNA-Seq分析以评估重组菌与原始菌株C.glutamicumXQ-5之间的基因表达差异。发现重组菌C.glutamicumXQ-5Δpgi::(zwf-gnd)中103个基因的表达水平与原始菌相比有明显差异,包括53个上调基因和50个下调基因,见图5(a)。其中重组菌株构建的相关基因显示出相应的表达差异,包括基因zwf(log2FC=5.386,FDR=0.000 01),gnd(log2FC=2.432,FDR=0.000 41)和panD(log2FC=2.808,FDR=0.000 01),表达水平分别上调了41.5倍,5.5倍和7.1倍,而基因pgi(log2FC=-2.96,FDR=0.002 3)表达水平下降了87.2%。基于KEGG途径富集分析,这些基因被归类至7个主要细胞过程(见表6),即ATP结合盒(ABC家族蛋白)转运系统、磷酸戊糖途径、丙酮酸代谢、谷胱甘肽代谢、碳代谢、氨基酸代谢和β-丙氨酸代谢。同时发现重组菌C.glutamicumXQ-5Δzwf::pgi中69个基因的表达水平与原始菌相比有明显差异,包括36个上调基因和33个下调基因,见图5(b)。其中重组菌株构建的相关基因显示出相应的表达差异,包括基因pgi(log2FC=3.96,FDR=0.000 013)表达水平上调了15.7倍,而基因zwf(log2FC=-2.556,FDR=0.000 23)表达水平下调了83.1%。基于KEGG途径富集分析,这些基因被归类至6个主要细胞过程(见表6),即ATP结合盒(ABC家族蛋白)转运系统、磷酸戊糖途径、丙酮酸代谢、谷胱甘肽代谢、碳代谢和肌醇磷酸代谢。

表6 重组菌和出发菌株之间RNA-seq数据的差异基因表达分析Table 6 Differential gene expression analysis of RNA-seq data between the recombinant and original strain

续表6
2.5 敲 除 工 程 菌C.glutamicum XQ-5Δpgi::(zwf-gnd)中panD基因提高其赖氨酸产量
基于转录组数据和KEGG分析中差异表达的基因信息,发现由于胞内NADPH水平的提高,重组菌C.glutamicumXQ-5Δpgi::(zwf-gnd)中编码天冬氨酸-α-脱羧酶的panD基因的表达水平也提高了,见表6,表明基因panD可能受到NADPH的调控。而panD基因表达水平的提高使更多的天冬氨酸流向合成β-丙氨酸的途径,天冬氨酸是赖氨酸合成的重要前体,panD基因的表达水平提高对于目标产物赖氨酸的合成是非常不利的,这也可能是重组菌C.glutamicumXQ-5Δpgi::(zwf-gnd)中赖氨酸产量减少的潜在原因。因此,通过基因敲除策略,敲除重组菌C.glutamicumXQ-5Δpgi::(zwf-gnd)基因组中的panD基因以构建菌株C.glutamicumXQ-5ΔpanDΔpgi::(zwf-gnd),来实现阻断该途径的目的。以C.glutamicumXQ-5Δpgi::(zwf-gnd)和C.glutamicumXQ-5ΔpanDΔpgi::(zwf-gnd)基因组为模板进行PCR验证,结果表明panD基因已被成功敲除。与菌株C.glutamicumXQ-5Δpgi::(zwfgnd)相比,panD几乎不在菌株C.glutamicumXQ-5ΔpanDΔpgi::(zwf-gnd)中表达。在相同条件下,将两个菌株进行摇瓶发酵。菌株C.glutamicumXQ-5Δpgi::(zwf-gnd) 和 菌 株C.glutamicumXQ-5ΔpanDΔpgi::(zwf-gnd)之间的细胞生长和葡萄糖消耗几乎相同,见图6(a)、(b),但赖氨酸的产量从最初的41 g/L提高到55 g/L,见图6(c),比出发菌株C.glutamicumXQ-5的赖氨酸产量48 g/L提高了14.3%。这些结果表明,基因panD的表达水平上调是重组菌C.glutamicumXQ-5Δpgi::(zwf-gnd)与出发菌C.glutamicumXQ-5相比赖氨酸合成减少的原因之一。

图6 重组菌C.glutamicum XQ-5ΔpanDΔpgi:(zwf-gnd)的发酵参数Fig.6 Fermentation parameters of recombinant strain C.glutamicum XQ-5ΔpanDΔpgi::(zwf-gnd)
3 结语
该研究中对一赖氨酸产生菌C.glutamicumXQ-5进行基因工程改造,构建了自杀型质粒pKl8mobsacB-Δpgi::(zwf-gnd)和pKl8mobsacBΔzwf::pgi。其中pKl8mobsacB-Δpgi::(zwf-gnd)用于将葡萄糖-6-磷酸脱氢酶基因zwf和6-磷酸葡萄糖酸脱氢酶基因gnd替换6-磷酸葡萄糖异构酶编码基因pgi,来过表达PPP途径,阻断糖酵解途径,从而构建了提高胞内NADPH水平的重组菌C.glutamicumXQ -5Δpgi:: (zwf-gnd)。pKl8mobsacB-Δzwf::pgi用于将6-磷酸葡萄糖异构酶编码基因pgi替换葡萄糖-6-磷酸脱氢酶基因zwf,来阻断PPP途径,过表达糖酵解途径,从而构建了降低胞内NADPH水平的重组菌C.glutamicumXQ-5Δzwf::pgi。对出发菌和重组菌进行摇瓶发酵实验,在3种不同的辅因子NADPH水平下,对胞内氧化还原辅因子(NAD+、NADH、NADP+和NADPH)和能量辅因子(ATP、ADP和AMP)进行分析和比较。由于强化了糖酵解途径,重组菌C.glutamicumXQ-5Δzwf::pgi胞内NADPH水平较出发菌降低了68.6%,NADPH/NADP+降低了28.8%,NADH含量提高了44.8%,NADH/NAD+提高了88.5%,ATP含量提高了111.2%。在以葡萄糖为单一碳源的CGXIIG培养基中,重组菌C.glutamicumXQ-5Δzwf::pgi的葡萄糖代谢能力在对数生长前期强于出发菌株,发酵12 h以后生长速率下降并很快进入稳定期,最终菌体量与出发菌相比降低了32.1%。其L-赖氨酸产量降低了82.4%,缬氨酸、亮氨酸、异亮氨酸、苏氨酸、谷氨酸合成量也都明显降低,而在胞内积累了大量副产物,如丙酮酸、乳酸等。由于阻断了糖酵解途径,重组菌C.glutamicumXQ-5Δpgi::(zwf-gnd)胞内NADPH水平较出发菌提高了404.2%,NADPH/NADP+提高了109.9%,NADH含量降低了22.1%,NADH/NAD+降低了34.6%,ATP含量提高了29.7%。在以葡萄糖为唯一碳源的CGXIIG培养基中,重组菌C.glutamicumXQ-5Δpgi::(zwf-gnd)通过PPP途径代谢碳源,葡萄糖代谢能力明显弱于出发菌株,菌体生长缓慢,进入稳定期的时间延长,并且最终菌体量与出发菌相比降低了11.4%。虽然NADPH有所提高,但是L-赖氨酸产量却降低了11.8%,缬氨酸、亮氨酸、异亮氨酸、苏氨酸、谷氨酸合成量也都明显降低,而在胞内积累了大量副产物,如丙酮酸、乳酸等。
通过出发菌和重组菌C.glutamicumXQ-5Δpgi::(zwf-gnd)之间的转录数据分析,经过改造的重组菌C.glutamicumXQ-5Δpgi::(zwf-gnd)基因组中天冬氨酸-α-脱羧酶基因panD表达水平比出发菌株提高了7.1倍。通过基因敲除技术将重组菌C.glutamicumXQ-5Δpgi::(zwf-gnd)中的panD基因进行剔除,获得重组菌C.glutamicumXQ-5ΔpanDΔpgi::(zwf-gnd),通过摇瓶发酵,赖氨酸产量为55 g/L,比出发菌C.glutamicumXQ-5提高了14.3%。实验结果证实,单纯通过阻断糖酵解途径、过表达PPP途径来提高NADPH水平,会使重组菌赖氨酸合成途径中某些关键基因表达水平发生变化,这也是其赖氨酸产量有所下降的原因之一。并且,改变胞内NADPH的水平,胞内微环境,如氧化还原平衡等,会受到扰动,此时菌体生长和代谢也会受到影响,而对L-赖氨酸产量的影响尤为明显。因此,细菌可能会将代谢产物的合成转换为电子吸收体,以避免高还原环境的有害作用。该研究为进一步解析辅因子NADPH调控L-赖氨酸产生菌的胞内微环境的生理机制奠定了基础。
