Antagomir-30d对大鼠骨髓基质干细胞成骨分化的影响
2021-06-20汪艳金琼陈威黄慧
汪艳,金琼,陈威,黄慧
1.温州医科大学附属口腔医院 种植科,浙江 温州 325027;2.温州医科大学附属口腔医院 儿童口腔科,浙江 温州 325027;3.上海交通大学医学院附属第九人民医院 修复科,上海 200011
微小RNA(microRNA,miRNA)是小的内源性RNA,可在转录后调节基因表达[1]。本课题组在前期对成骨调控的研究过程中发现miRNA参与釉基质蛋白诱导小鼠前成骨细胞系MC3T3-E1细胞成骨分化过程,挑选出了一系列发生显著表达异常的miRNAs。其中miR-30家族成员miR-30a、miR-30b、miR-30c和miR-30d在成骨分化过程中显著下调,同时这些家族成员的抑制剂则可以促进成骨分化[2]。有学者发现miR-30家族成员可恢复骨吸收与骨生成间的平衡[3]。由于miRNA动物实验的体内环境复杂、实验周期较长,对miRNA产品的稳定性提出了更高的要求,本研究将采用稳定性更好、可靠性更高的化学修饰miRNA antagomir进行体外实验,在细胞水平进行miR-30d拮抗剂(antagomir-30d)及其阴性对照(NC)的转染实验,验证antagomir-30d在细胞水平对成骨分化的调控作用,并通过转染不同浓度后成骨基因表达水平确定其最佳转染浓度。
1 材料和方法
1.1 材料 4周龄SPF级Wistar雄性大鼠由上海交通大学医学院附属第九人民医院动物实验中心提供。α-MEM培养基购自美国Invitrogen公司,DME培养基购自美国Gibco公司,SYBR®PrimeScript®RTPCR Kit购自日本Takara公司,RNAse Free Water购自美国Ambion公司,引物购自上海生工生物技术有限公司,cDNA合成试剂购自日本Takara公司,碱性磷酸酶(alkaline phosphatase,ALP)染色试剂盒购自碧云天生物技术研究所。
1.2 方法
1.2.1 大鼠骨髓基质干细胞(bone mesenchymal stem cells,BMSCs)的获取和培养方法:大鼠脱臼处死,置于75%乙醇中浸泡消毒10 min,无菌条件下取其胫骨和股骨,剔除周围附着肌肉,将其两端干骺端剪除,显露骨髓腔。10 mL无菌注射器吸取含有肝素(200 U/mL)和10% FBS的α-MEM培养液反复冲洗骨髓腔至由红色变白色。细胞悬液以1 800 r/min的转速离心10 min,弃上清液,并加入标准培养液10 mL,用滴管轻轻吹散细胞团后接种于10 cm培养皿。放置于37 ℃、5% CO2、饱和湿度的培养箱中培养。次日首次换液后每3 d换一次液。待镜下观察细胞增殖至80%时,吸弃培养液,0.25%胰酶和0.02%EDTA消化培养皿底贴壁细胞,约1~2 min至镜下见贴壁细胞皱缩后,加入适量培养液终止消化,吸取培养液轻吹尚未脱落的细胞至所有细胞悬起,然后转移至离心管内,吹打使之分散均匀。用血细胞计数板计数细胞数量。将细胞悬液以1 000 r/min离心5 min,弃上清液,加入α-MEM培养液,调整细胞浓度为1×105/mL,轻轻吹打使细胞分散均匀,接种于数个10 cm培养皿内,置于37 ℃、5% CO2、饱和湿度条件培养箱中培养,每3 d换一次液,倒置显微镜下观察细胞生长情况和形态变化。待细胞增殖至80%时按上述操作进行传代。采用第2或3代细胞进行后续实验。细胞行成骨诱导分化时,需采用成骨诱导培养液。
1.2.2 待转染试剂准备方法:Antagomir-30d是经过特殊化学修饰的miR-30d的拮抗剂,适用于细胞实验、动物实验。NC采用无意义的一段核苷酸,用于antagomir-30d的阴性对照;antagomir-30d、NC以及用于检测转染效率经Cy3荧光标记的NC均由广州锐博生物科技有限公司合成提供,由于经过特殊化学修饰,使用时无需转染试剂即可跨越细胞膜进入细胞内。产品以冻干粉的形式,常温运输,并于-80~-20 ℃保存。使用前需将其配置为20 μmol/L的储备液,操作步骤:低速条件下离心储存管,让冻干粉聚集在试管的底部。轻轻打开管盖,加入DEPC水若干,配成20 μmol/L的储备液,柔和地用移液枪吹打储备液5次。根据具体用量分装,避免多次冻融,重新贮存时注意密封好EP管,-80 ℃贮存备用。为避免外界因素(包括酶、极端pH或温度条件等)导致产品降解,所有操作均严格遵循RNA操作规则。实验过程中试剂于冰上放置。
1.2.3 细胞处理方法:采用第2或3代BMSCs铺板于六孔板底,每孔的细胞密度为5×104个/mL。分为3组:不同浓度的antagomir-30d(antagomir-30d组)、阴性对照(NC组)和未做转染的BMSCs(空白组),每组3个复孔。铺板后次日antagomir-30d组与NC组分别加入antagomir-30d与NC,终浓度依次为50、100、150、200 nmol/L,空白组不做处理。48 h后更换成骨诱导液,每3 d换一次液,培养至7 d,收集细胞。选用不同浓度的antagomir-30d及其NC进行BMSCs的转染,通过RT-PCR技术测定成骨基因ALP、骨钙素(osteocalcin,OC)和Runt相关转录因子2(runt-related transcription factor 2,RUNX2)的mRNA表达量,以确定最佳转染浓度。
1.2.4 RT-PCR方法:TRIzol法抽提细胞总RNA。依照反转录试剂盒说明反转录成cDNA。根据NCBI网站GenBank数据库查询大鼠相关基因的mRNA序列,应用Oligo 6.71软件进行引物设计。实验内参基因选用GAPDH基因,引物序列为网站上已报道的序列。引物由上海生工生物工程公司(http://www.sangon.com/)合成,保存浓度为100 pmol/μL,工作浓度为10 pmol/μL。将所有cDNA样品分别配置RT-PCR反应体系,加样。表达量的计算采用2-ΔΔCt法。引物序列见表1。

表1 RT-PCR使用的引物序列
1.2.5 荧光显微镜观察转染方法:采用第2或第3代BMSCs铺板于六孔板底,每孔中加入不含抗生素的培养基,每孔的细胞密度为5×104个/mL,使转染时的细胞密度能够达到30%~50%(推荐转染密度),另设2个复孔。铺板次日,将Cy3荧光(红色荧光染料)标记的NC加入六孔板中,使其浓度达到最佳转染浓度。48 h后取出六孔板,去原液,用PBS洗涤3遍后置荧光显微镜下(Olympus IX71)观察,显微参数为550 nmol/L激发波长,570 nmol/L发射波长。100倍视野下两人同时独立计数相同视野下红色荧光数,每孔共计5个高倍镜视野。每孔转染效率(%)=红色荧光数/总细胞数×100%。每孔5个高倍镜视野取平均值,最终每组3孔平均值确定为转染效率。
1.2.6 ALP染色方法:采用第2或3代BMSCs铺板于六孔板底,每孔的细胞密度为5×104个/mL。共分3组:空白组、antagomir-30d组、NC组。铺板后次日antagomir-30d组与NC组分别加入antagomir-30d与NC,终浓度为RT-PCR检测的最佳浓度,空白组不做处理。48 h后更换成骨诱导液,每3 d换一次液,培养至7 d,行ALP染色,检测ALP活性。
1.3 统计学处理方法 采用SPSS18.0统计软件进行处理。计量资料用±s表示,多组间比较用单因素方差分析,组间两两比较用SNK进行分析。P<0.05为差异有统计学意义。
2 结果
2.1 显微镜下细胞形态观察 全骨髓接种5 d后贴壁细胞主要为BMSCs,贴壁细胞形成大小不等分散的细胞集落,形态多呈梭形,见图1A。7 d后细胞集落数量明显增加,且集落内细胞呈漩涡状排列,集落明显增大,并呈放射状向周围扩张,细胞集落间相互融合成为单层,见图1B。待细胞融合度达80%即可消化传代。
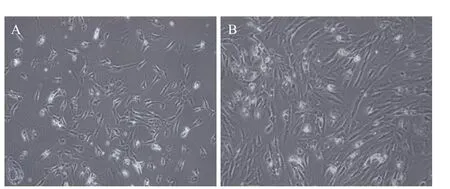
图1 原代大鼠BMSCs的形态(×100)
2.2 不同浓度各组细胞成骨基因表达 成骨诱导7 d后,antagomir-30d组、NC组和空白组均可检测到成骨相关基因的表达,见图2。各浓度NC组与相同浓度空白组成骨基因ALP、OC及RUNX2的mRNA表达量差异无统计学意义(P>0.05)。当转染浓度为150 nmol/L,antagomir-30d组ALP、OC和RUNX2的mRNA表达量与NC组和空白组比均上调,差异有统计学意义(均P<0.05)。
2.3 细胞最佳转染浓度确定 选用0、50、100、150、200 nmol/L浓度的antagomir-30d对BMSCs进行转染并经成骨诱导。150 nmol/L浓度的antagomir-30d ALP的mRNA表达量与0 nmol/L比显著上调,差异有统计学意义(P<0.05)。各浓度的antagomir-30d OC和RUNX2 mRNA表达量与0 nmol/L比差异均有统计学意义(P<0.05);当antagomir-30d浓度为150 nmol/L时成骨效果最佳,见图3。
2.4 BMSCs转染效率观察 Cy3荧光标记的NC以最佳浓度150 nmol/L转染BMSCs 48 h后,光镜见BMSCs形成一层贴壁细胞,增殖至约70%,漂浮死细胞较少;荧光显微镜观察示BMSCs细胞转染效率可达68.75%±8.54%,见图4。
2.5 各组ALP染色结果 150 nmol/L antagomir-30d组、NC组和空白组7 d后BMSCs ALP染色均呈紫色(+);空白组与NC组染色程度接近,均浅于antagomir-30d组,见图5。
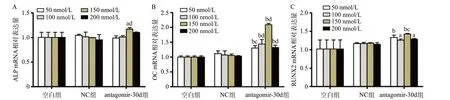
图2 不同浓度各组BMSCs成骨诱导7 d后成骨基因mRNA表达水平比较
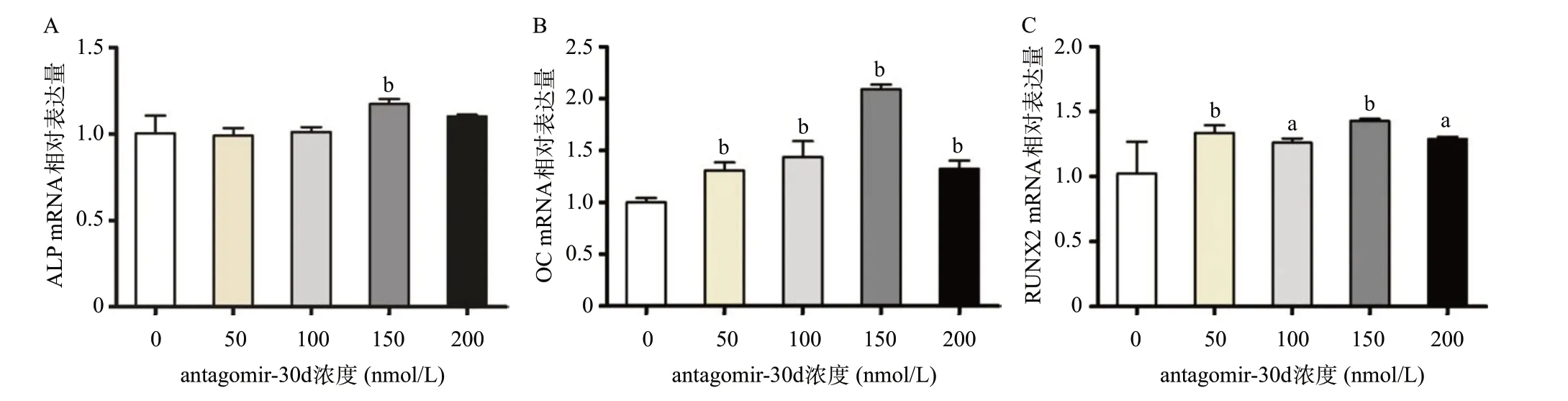
图3 各浓度antagomir-30d各成骨基因mRNA表达水平比较
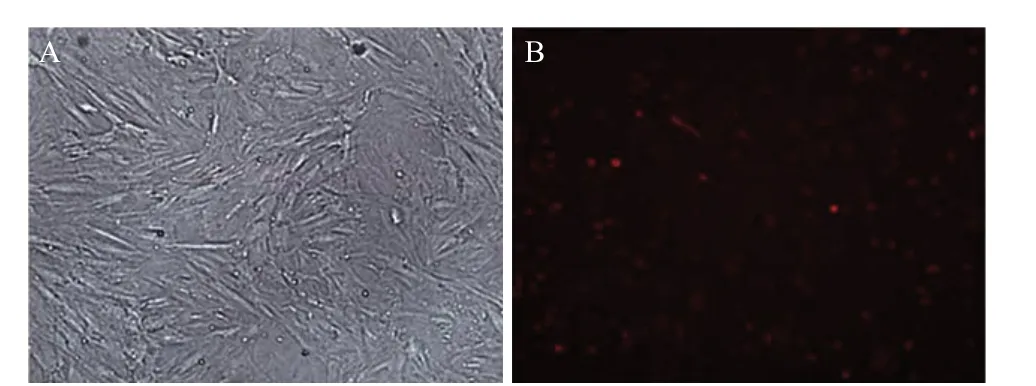
图4 BMSCs转染效率观察

图5 各组ALP染色结果比较
3 讨论
研究表明miR-30a和miR-30d在人骨形态发生蛋白2(human bone morphogenetic protein 2,BMP-2)诱导C2C12间质干细胞成骨分化过程中发生下调[4]。本课题组前期实验在对成骨调控的研究过程中发现miRNA参与釉基质蛋白诱导小鼠前成骨细胞MC3T3-E1的成骨分化过程,并挑选出一系列发生显著表达的miRNAs,其中miR-30家族成员miR-30a、miR-30b、miR-30c和miR-30d在釉基质蛋白诱导的MC3T3-E1成骨分化过程中显著下调。进一步实验表明Smad1和RUNX2是miR-30家族的靶基因,当Smad1和RUNX2过表达时会显著减少miR-30家族对成骨分化的抑制作用[2]。因此miR-30家族是成骨分化关键的负性调控因子,并通过负调控Smad1和RUNX2的表达而发挥成骨抑制作用。本研究挑选miR-30d作为调节因子,选用稳定性更好、可靠性更高的化学修饰的miR-30d拮抗剂antagomir-30d及其无意义对照链NC进行实验。
BMSCs作为成骨细胞的主要来源,是骨髓腔中的主要细胞,它是一种具有自我更新能力及多重分化能力的干细胞,在特定条件下可以向骨、软骨、脂肪等多种组织细胞分化[5]。BMSCs在矿化诱导的培养条件下,可以向成骨细胞分化,并表现出较高的ALP活性,可分泌OC和I型胶原等细胞外基质。BMSCs可在骨重建和损伤再生中发挥重要的作用[6]。另外,BMSCs体外增殖能力强,取材容易,免疫原性低,并且能够趋化成骨前体细胞至骨缺损部位诱导激活植入体处早期骨形成的通路,目前被认为是促进体内成骨的优良种子细胞源。
BMSCs的成骨分化能力与其合成分泌的酶以及细胞外基质蛋白关系密切。ALP是细胞发生分化时所分泌产生的酶,成骨细胞从其前体细胞开始即表达ALP,在成熟的成骨细胞中ALP表达增加,但在成熟的骨细胞中ALP活性逐渐消失。因此,ALP活性被认为是反映成骨细胞成熟状态的一个重要指标,又被认为是成骨的早期指标。ALP表达活性越高说明BMSCs向成骨细胞的分化越明显[7]。OC是含量最丰富的骨非胶原蛋白,由成熟的成骨细胞合成。OC主要出现在矿化形成期,是反映成骨细胞成熟的标志,而且能准确代表成骨细胞的活性和骨转换。RUNX2是调节成骨分化的关键转录因子,可以调节ALP、OC等多种下游成骨基因的表达,RUNX2的表达反映新骨的形成[8]。
MiRNA产品的最佳工作浓度因细胞类型及研究目的不同而异。可根据实验具体情况优化转染浓度,建议10~200 nmol/L。在研究miR-196b的表达与白血病的发展关系的实验中,研究人员采用100 nmol/L浓度的antagomir-196b进行野生型C57BL6小鼠的骨髓基质细胞的转染[9]。为了明确antagomir-30d及其NC转染至大鼠BMSCs的最佳转染浓度,本研究共采用转染因子的5个浓度梯度0、50、100、150、200 nmol/L进行比较,并检测各成骨基因ALP、OC、RUNX2 mRNA的相对表达量。
由于转染时所接种的细胞密度是影响转染效率的关键因素之一,因此细胞接种密度过高和生长过度会削弱细胞活力,降低细胞的转染效率。有学者研究发现在将anti-miR-21(miR-21的反义链)运用LipofectamineTM2000转染至人HXO-RB44细胞48 h后,流式细胞仪显示其转染效率可达约69.85%[10]。国内有学者构建了大鼠microRNA-327重组腺病毒载体并转染至心肌细胞,48 h后倒置荧光显微镜观察结果显示腺病毒转染效率为90.15%±5.15%,流式细胞仪检测结果显示其转染效率为85.46%±3.08%[11]。锐博公司推荐转染时应使接种细胞密度能够达到30%~50%。荧光标记的miRNA产品可采用激光共聚焦显微镜、流式细胞仪、荧光显微镜等观察到,可直观地评估miRNA产品的转染效率。本研究结果显示,当转染浓度为150 nmol/L时,转染48 h后通过荧光显微镜观察,转染效率可达68.75%±8.54%。
Antagomir-30d通过转染BMSCs后可以促进其成骨分化,与空白及NC组比,相关成骨基因ALP、OC、RUNX2 mRNA表达上调,ALP染色活性增加;当转染浓度为150 nmol/L时,antagomir-30d促进成骨分化的效果最好,各成骨基因的表达量上调最明显。
