Nrf2基因敲除加剧单侧输尿管梗阻肾纤维化模型中巨噬细胞介导的炎症损伤作用
2021-06-20吴存造陆红朱恒悦翁敏施程浩林周豪白永恒
吴存造,陆红,朱恒悦,翁敏,施程浩,林周豪,白永恒
温州医科大学附属第一医院,浙江 温州 325015,1.泌尿外科;2.检验科;3.浙江省胰腺肝脏危重性疾病诊治新技术研究重点实验室
氧化应激损伤是各种类型肾损伤的重要病理因素,可直接或间接地引起肾皮质固有免疫细胞活化及周围组织、血管中大量炎症细胞的浸润。浸润的炎症细胞又可释放炎症介质,使肾皮质缺氧程度进一步加重,进而引起肾小管损伤、肾缺血和纤维化,形成恶性循环[1]。巨噬细胞是肾氧化应激损伤过程中重要的免疫细胞和炎症细胞,其活化通过释放诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)等物质,诱导局部炎症损伤,参与间质纤维化进程[2]。核转录因子Nrf2(nuclear factor erythroid 2-related factor 2)是机体重要的抗氧化应激损伤分子[3]。氧化应激损伤时,反应性氧代谢产物(reactive oxygen species,ROS)等可诱导Nrf2解耦联,使之进入细胞核并与抗氧化反应元件(antioxidative response element,ARE)结合,激活下游多种基因的转录,从而发挥其抗氧化活性[4]。然而,Nrf2是否参与肾纤维化过程中的炎症反应及影响巨噬细胞活化尚不十分清楚。本研究以临床上常见的单侧输尿管梗阻(unilateral ureteral obstruction,UUO)诱导肾纤维化模型作为研究对象,通过分析Nrf2基因敲除后,巨噬细胞的活化及其调控机制,以明确抗氧化应激分子Nrf2在肾炎症损伤和纤维化中的作用。
1 材料和方法
1.1 材料
1.1.1 动物:Nrf2(Nfe212)基因敲除小鼠(B6.129X1-Nfe212tm1ywk/J)购于南京大学南京生物医药研究院,动物许可证号为SCXK(苏)2015-0001。野生型B6小鼠(C57BL/6)购于温州医科大学实验动物中心,动物许可证号:SYXK(浙)2019-0009。所有实验动物喂养程序严格按照温州医科大学制定的实验动物保护条例执行。
1.1.2 试剂:PAS染色试剂购于上海碧云天生物公司;Masson试剂盒购于北京Solarbio公司;免疫组织化学试剂盒购于北京中杉金桥公司;抗CD68单克隆抗体购于美国Santa Cruz公司;iNOS试剂盒购于武汉Proteintech公司;干扰素调节因子5(interferon regulatory factor,IRF5)抗体购于美国Proteintech公司;TRIzol试剂购于美国Invitrogen公司;RNA反转录试剂盒购于日本Toyobo公司。
1.1.3 仪器:MyCycler梯度PCR仪购于美国Bio-Rod公司;7500 Fast定量PCR仪购于美国Applied Biosystens公司;Varioskan Flash全波长多功能扫描仪购于美国Thermo Scientific公司;DM4000B LED荧光正置显微镜购于德国Leica公司。
1.2 方法
1.2.1 实验动物的分组和UUO模型的制备:将实验小鼠分为:Nrf2野生型UUO组(Nrf2Wild-typeUUO)、Nrf2野生型假手术组(Nrf2Wild-typeSham)、Nrf2敲除型UUO组(Nrf2KOUUO)和Nrf2敲除型假手术组(Nrf2KOSham),每组6只。用10%水合氯醛成功麻醉小鼠,对腹部进行常规消毒后,取左侧腹部切口,找到左肾下极并游离左侧输尿管,并于靠近肾盂处结扎左侧输尿管,随后将腹内脏器复位后腹壁缝合。假手术组仅分离肾脏及游离输尿管,随即缝合腹壁。各组小鼠于术后7 d,取左肾组织用于后续实验。
1.2.2 PAS染色检测肾组织病理学改变:肾组织样本取出后,使用4%多聚甲醛对其进行固定。肾组织经过脱水、透明、浸蜡、包埋等步骤后,切成4 μm厚组织切片,制备成石蜡切片。切片经过脱蜡、梯度乙醇后,通过PAS染色,最后使用中性树胶封片。通过显微镜观察肾组织皮质和髓质的病理学改变。
1.2.3 Masson染色检测肾组织纤维化:脱蜡后4 μm的石蜡切片根据Masson试剂盒说明书进行实验操作。使用苏木素-三氯化铁染核10 min,流水稍洗;盐酸乙醇分化后,流水冲洗;氨水返蓝,水洗;丽春红酸性染液进行染色10 min,醋酸清洗1 min;1%磷钼酸作用2 min,苯胺蓝染色2 min;然后用95%乙醇分化30 s;脱水、透明、封片、镜检。在Masson染色之后,肌纤维为红色,胶原纤维为蓝色。Masson染色组织评分标准参照文献[5]。
1.2.4 免疫组织化学染色检测CD68和IRF5的表达:已制作的石蜡切片采用免疫组织化学链霉菌抗生物素蛋白连接的过氧化酶法进行染色。对CD68、iNOS和IRF5等一抗按1:200进行稀释。常规脱蜡水化后,枸橼酸盐高温进行修复抗原,以二抗相同来源的血清封闭。使用一抗稀释液作为阴性对照,细胞核、细胞浆或胞膜出现黄褐色颗粒即为阳性表达。最后用Image-Pro Plus 6.0软件分析每个视野下阳性表达区域的平均光密度值(累积光密度/分析面积)。
1.2.5 ELISA检测iNOS的水平:取100 mg肾组织,充分匀浆溶解于1 mL的PBS液内,离心分离出上清液,制成100 g/L蛋白原液,根据试剂盒说明书,采用双抗体夹心ELISA法,检测样品吸光度值,然后根据标准曲线计算样本浓度。
1.2.6 Western blot检测IRF5蛋白的表达:使用RIPA裂解肾组织,收集离心后的上清液,检测蛋白浓度;制备12%聚丙烯酰胺分离胶和4%积层胶,样品5×SDS上样缓冲液,设置恒压200 V,电泳60 min;设置恒压100 V,湿法电转移60 min;转膜后的PVDF膜经5% TBST脱脂奶粉室温封闭1 h;然后加IRF5一抗(1:1 000),于4 ℃摇床孵育过夜。随后TBST清洗3次,加入二抗(1:5 000),室温摇床孵育1 h,TBST清洗3次,加入ECL发光液孵育膜5 min,暗室压片曝光,显影定影后胶片保存。蛋白表达量以目标蛋白与内参蛋白条带灰度值的比值表示。
1.2.7 qRT-PCR检测炎症基因mRNA表达:采用TRIzol法提取肾组织中的RNA,根据RNA反转录试剂说明书将其反转录为cDNA。设计小鼠IL-1β、IL-6、TNF-α mRNA特异性引物,以β-actin作为内参(由上海生工公司合成,见表1),进行PCR扩增,扩增体系为:5 μL 2×SYBR Green荧光定量试剂、2 μL引物(上、下游各1 μL,终浓度为200 nmol/L)、2 μL反应缓冲液,以及1 μL待测样品cDNA。PCR反应体系为:95 ℃ 3 min预变性;95 ℃ 5 s,60 ℃ 35 s,反复40个循环。采用相对定量法计算得到数据,通过溶解曲线分析数据结果的可靠性。相对表达量=2-ΔΔCt,ΔΔCt=[Ct目的基因(待测样品)-Ct内参照(待测样品)]-[Ct目的基因(校正样品)-Ct内参照(校正样品)]。

表1 引物序列
1.3 统计学处理方法 采用GraphPad Prism 8.0软件包对实验数据进行统计学分析。计量资料以±s表示,多组比较采用单因素方差分析,两两比较应用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 敲除Nrf2加重UUO模型肾组织损伤和纤维化程度 PAS染色结果显示,UUO组与假手术组相比,其肾小管明显扩张,间质面积显著增加,同时伴有炎症性充血和水肿。Nrf2KOUUO组与Nrf2Wild-typeUUO组相比,其肾皮质区域小管扩增与间质炎症水肿更为明显(P<0.01),见图1。Masson染色结果显示,与Nrf2Wild-typeUUO组相比,Nrf2KOUUO组的肾组织胶原累积程度更为明显(P<0.05),见图2。
2.2 敲除Nrf2加剧UUO模型肾组织CD68阳性的巨噬细胞浸润 免疫组织化学染色结果显示,与Sham组比,UUO组的CD68的表达明显增强(P<0.01);与Nrf2Wild-typeUUO组相比,Nrf2KOUUO组CD68的表达更为明显(P<0.05),见图3。深入分析显示,炎症型巨噬细胞标志物iNOS的表达在UUO中较Sham组高(P<0.01);与Nrf2Wild-typeUUO组比,Nrf2KOUUO组iNOS的表达水平更高(P<0.05),见图4。
2.3 敲除Nrf2提高UUO模型肾组织炎症因子的释放 qRT-PCR结果显示,与Sham组相比,UUO组术后炎症因子IL-1β、IL-6、TNF-α mRNA的表达水平明显升高(P<0.05)。深入分析显示,Nrf2KOUUO组与Nrf2Wild-typeUUO组相比,肾组织中IL-1β、IL-6、TNF-α mRNA的表达水平更高(P<0.05)。见图5。
2.4 敲除Nrf2促进UUO模型肾组织IRF5的表达Western blot结果显示,与Sham组比,UUO组肾组织中IRF5的表达水平明显升高(P<0.001),与Nrf2Wild-typeUUO组比,Nrf2KOUUO组肾组织中IRF5的表达更为明显(P<0.01),见图6。此外,免疫组织化学染色结果同样证实,敲除Nrf2提高了UUO模型肾组织IRF5的表达水平(P<0.01),见图7。
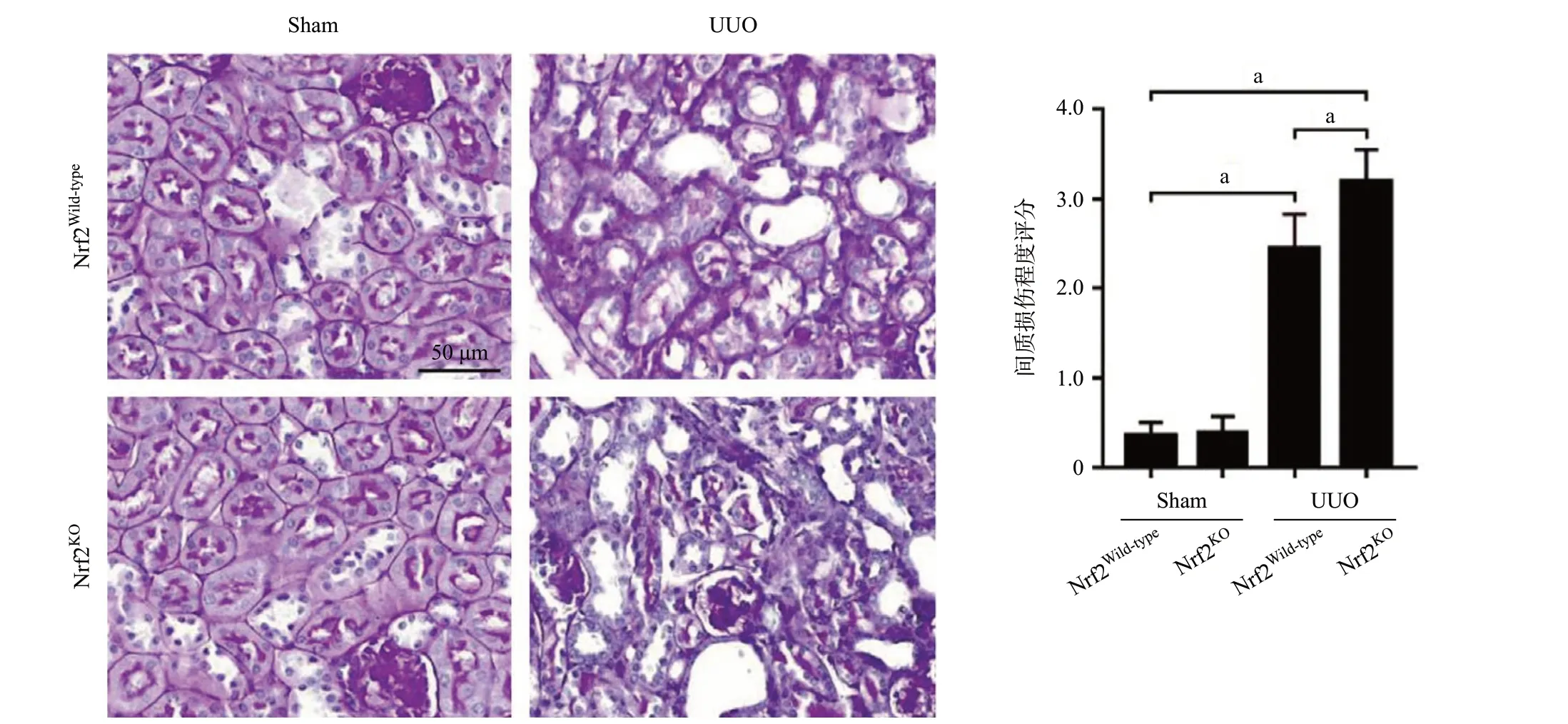
图1 UUO模型中PAS染色显示肾组织病理学改变(aP<0.01)

图2 UUO模型中Masson染色显示肾组织胶原累积程度(aP<0.05,bP<0.01)
3 讨论
氧化应激是指体内氧化作用与抗氧化作用失衡的一种状态。氧化应激损伤常常直接或间接地引起肾内不同类型细胞的损伤,从而导致了包括巨噬细胞在内多种炎症细胞的浸润和活化,从而加剧局部损伤程度。在此过程中,抗氧化应激信号可被激活,发挥拮抗氧化应激损伤的作用。Nrf2/ARE通路是机体十分重要的抗氧化信号。本研究发现在UUO模型中,肾组织局部炎症损伤和纤维化病变,同时也伴随着Nrf2的活性明显升高。有研究也证实,在肾损伤过程中,Nrf2/ARE信号可被反馈性地活化,参与肾组织损伤与修复[6]。靶向敲除Nrf2不仅加剧了局部的氧化应激损伤,同时也可推动急性肾损伤向慢性肾纤维化转变[7]。在缺血性肾损伤中,缺氧可诱导线粒体信号介导Nrf2水平下调,从而调控肾小管上皮细胞中HIF-1α的活化[8]。一旦恢复氧供应,Nrf2和HIF-1α相互作用,提供最佳的代谢方式,缓解局部氧化应激损伤[8]。因此,基于Nrf2具有潜在的肾损伤保护作用,开发诱导Nrf2活化的治疗药物是当下肾脏疾病新治疗策略之一[9]。

图3 免疫组织化学染色检测UUO模型中CD68的表达(aP<0.05,×400)
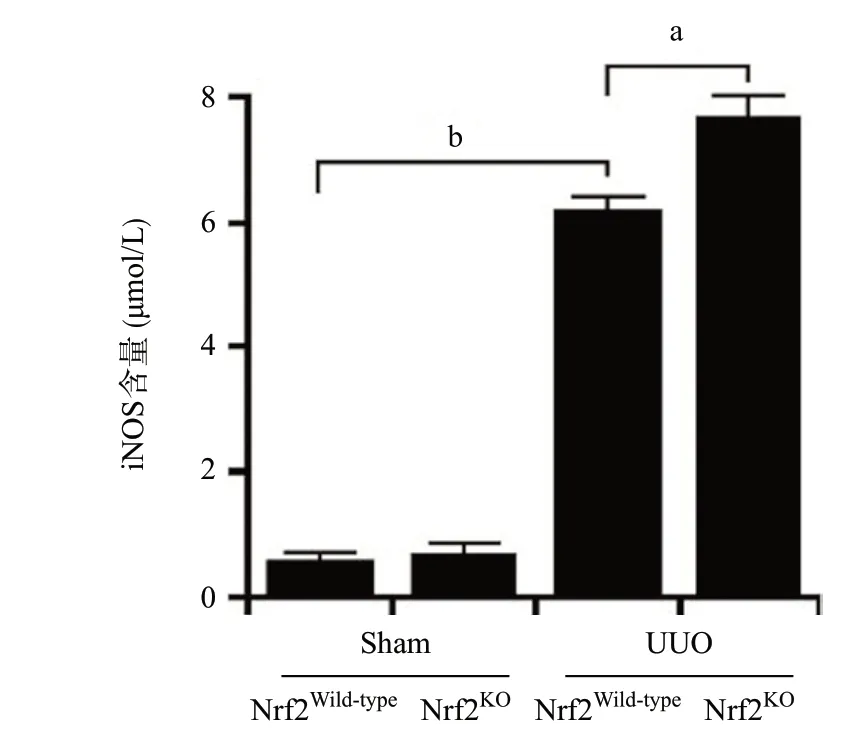
图4 ELISA检测UUO模型中iNOS的水平(aP<0.05,bP<0.01)

图5 qRT-PCR检测UUO模型中炎症因子的释放(aP<0.05)
在UUO肾纤维化模型中我们注意到,Nrf2的活化与巨噬细胞介导的炎症损伤同时存在。本课题组前期研究表明,促炎型巨噬细胞的浸润与活化是推动肾纤维化病变的重要诱因[10]。促炎型巨噬细胞可通过诱导TNF-α、IL-1β等炎症因子的高表达,促进肾组织炎症损伤,同时也可通过释放MMP-9等细胞因子,诱导肾间质纤维化[11]。然而,Nrf2调控促炎型巨噬细胞活化的机制尚未完全明确。本研究发现,与Nrf2Wild-typeUUO组相比,Nrf2KOUUO组肾组织中CD68阳性的巨噬细胞的浸润明显增加,同时促炎型巨噬细胞标志物iNOS的表达也明显增加。上述结果提示:敲除Nrf2加剧UUO模型肾组织促炎型巨噬细胞的浸润和活化。
通过进一步研究,我们认为敲除Nrf2诱导促炎型巨噬细胞活化的机制可能是通过上调IRF5表达实现的。IRF5是维持巨噬细胞炎症表型的一种关键转录因子[12]。研究发现,IRF5可促进Ly6C高表达的单核细胞分化为炎症性CD11c+巨噬细胞,从而促进了肠道炎症[13]。脂多糖可通过IRF5的介导,诱导炎症型巨噬细胞活化,并促进TNF-α、IL-1β和IL-6等的释放,引起神经系统炎症反应。因此,IRF5可作为中枢神经系统炎症性疾病的治疗靶标[14]。我们的研究也发现,与Nrf2Wild-typeUUO组相比,Nrf2KOUUO组肾组织中IRF5的表达水平明显增强,同时,炎症因子TNF-α、IL-1β和IL-6的合成与释放也明显升高。这些证据支持了敲除Nrf2基因通过诱导IRF5介导的炎症型巨噬细胞活化,促进炎症因子表达和释放,加剧了UUO肾纤维化模型中的炎症损伤作用。
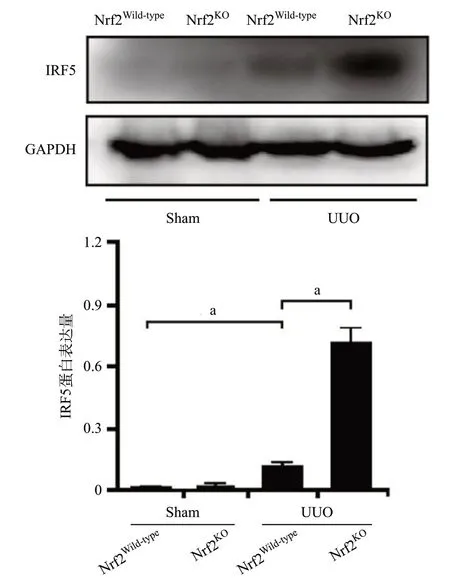
图6 Western blot检测UUO模型中IRF5的表达(aP<0.01)
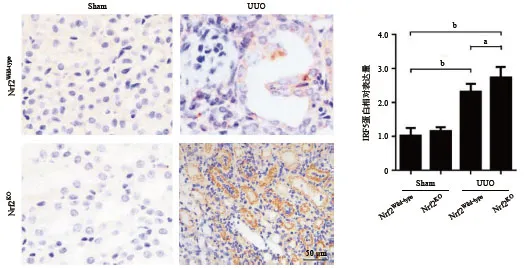
图7 免疫组织化学染色检测UUO模型中IRF5的表达(aP<0.05,bP<0.01,×400)
本研究也存在一些不足之处,没有通过免疫双荧光染色技术,分别对Nrf2及IRF5与CD68进行标记,从而明确炎症型巨噬细胞作为Nrf2的靶细胞及其IRF5的调控作用,有待后续进一步研究。
综上所述,在肾损伤与纤维化中,Nrf2基因敲除加剧UUO肾纤维化模型中的炎症损伤作用。其机制可能与促进IRF5介导的炎症型巨噬细胞浸润,进而增加炎症因子的合成与释放有关。因此,Nrf2参与巨噬细胞活化机制的调控有助于从分子层面阐释肾损伤与纤维化发生机制,同时也为肾损伤的临床治疗提供了一定的指导意义。
