超高压处理对太平洋牡蛎(Crassostrea gigas)肠道菌群的影响
2021-06-19梁山泉刘枝浩王敬宇朱常亮牟海津
梁山泉,刘枝浩,王敬宇,朱常亮,牟海津
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
牡蛎已在世界各地被广泛养殖,在满足人类营养需求和促进渔业经济发展方面具有巨大价值[1]。然而,牡蛎体内的微生物种类繁多,其中包含着副溶血性弧菌和创伤弧菌等致病微生物,这些致病微生物会带来食品安全的风险。此外,由于牡蛎的高水分和养分含量可为多种微生物的生长和繁殖提供有利的条件,从而导致牡蛎易腐败[2]。通过常规培养和高通量测序发现,东部牡蛎(Crassostrea virginica)肠道微生物以变形菌门(Proteobacteria)为主,占了所有细菌的70%以上,此外还包括疣微菌门(Verrucomicrobia)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、柔膜菌门(Tenericutes)和厚壁菌门(Firmicutes)等[3]。太平洋牡蛎(C.gigas)体内的微生物以假单胞菌属为主,占三分之一以上,其它菌属包括弧菌属、不动杆菌属(Acinetobacter)和气单胞菌属[4]。
牡蛎在收获后会经历运输和储存等工序,在此过程中其体内的微生物多样性会发生显著的变化。因此,在消费之前进行有效的处理来减少牡蛎体内微生物是有必要的。近年来,超高压处理这种非热加工技术在海产品杀菌方面的研究越来越受到关注,该技术可在不破坏海产品营养成分的前提下[5],有效抑制细菌的生长繁殖并灭活[6]。LOPEZ-CABALLERO等[7]报道当牡蛎经过400 MPa处理10 min后,大肠杆菌、产H2S的细菌和总活菌数可减少到检测阈值以下。HE等[8]研究表明高静水压处理后的牡蛎在存储过程中(3℃超过27 d)细菌总数保持在较低的水平。从260 MPa处理后的牡蛎中分离出的细菌主要是腐败希瓦氏菌(Shewanella putrifaciens)和荧光假单胞菌(Pseudomonas fluorescens)。而经过500 MPa或800 MPa处理的牡蛎则主要为假单胞菌属[9]。CAO等[10]发现高静水压处理可极大地改变牡蛎在冷藏过程中腐败菌群的组成,经300 MPa处理2 min的变质牡蛎中以嗜冷杆菌属(Psychrobacter)(42.3%)为主,而交替假单胞菌属(32.2%)和希瓦氏菌属(19.5%)在未经高静水压处理的变质牡蛎中占主导地位。在这些研究中,有关超高压处理的大多数报道都集中在致病微生物的灭活和牡蛎整体菌群的变化。牡蛎肠道是牡蛎体内微生物主要存在的部位之一,目前并没有关于超高压处理对牡蛎肠道菌群影响的报道。
本试验通过16S rRNA测序方法对100、200 MPa和400 MPa超高压处理5 min的牡蛎肠道进行菌群结构的分析,探究超高压与菌群的相关性,为利用超高压技术在防控牡蛎体内致病微生物的实际应用提供参考。
1 材料与方法
1.1 材料与试剂
太平洋牡蛎(Crassostrea gigas):青岛市团岛农贸市场;RNA提取试剂盒:美国Omega Bio-tec公司;琼脂糖:西班牙Biowest公司;FastPfu高保真DNA聚合酶:中国TransGen公司;AxyPrep DNA凝胶回收试剂盒:美国Axygen公司;NEXTFLEX DNA测序建库试剂盒:美国Bioo Scientific公司;MiSeq基因测序试剂盒:美国Illumina公司。
1.2 仪器与设备
L1-600/10超高压设备:天津华泰森淼生物科技有限公司;N13462C移液器、5424 R高速台式冷冻离心机:德国Eppendorf公司;NanoDrop 2000超微量分光光度计:美国Thermo Fisher Scientific公司;ELx800酶标仪:美国Biotek公司;QL-901涡旋混合器:海门其林贝尔仪器制造有限公司;GeneAmp9700型PCR仪:美国ABI公司;NextSeq 500测序仪:美国Illumina公司;QuantiFluorTM-ST微型荧光计:美国Promega公司。
1.3 试验方法
1.3.1 新鲜牡蛎的采集与处理
将牡蛎用自来水冲洗干净,单个封装放进高温蒸煮袋中。之后进行超高压处理,具体流程:100、200、400 MPa处理5 min,其中升压速度为20 MPa/s,泄压时间可忽略不计。样品处理完之后迅速在冰上用无菌手术刀取出肠道内容物,放入液氮固定10 min后置于-80℃冰箱中待用。
1.3.2 RNA的提取与质量分析
根据RNA试剂盒的说明书进行RNA抽提;超微量分光光度计检测提取的RNA浓度和纯度;之后用反转录试剂盒将提取的RNA反转成cDNA,利用1%琼脂糖凝胶电泳检测RNA和cDNA的质量,用338F(ACTCCTACGGGAGGCAGCAG)和806R(GGACTACH VGGGTWTCTAAT)引物对V3~V4可变区进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。
1.3.3 高通量测序
本部分由上海美吉生物医药科技有限公司完成。使用2%琼脂糖凝胶回收PCR产物,利用DNA凝胶回收试剂盒进行纯化,Tris-HCl洗脱,2%琼脂糖凝胶电泳检测。利用微型荧光计进行定量检测。根据Illumina MiSeq平台标准操作规程将纯化后的扩增片段构建双端测序的文库。构建文库步骤如下。
1)连接“Y”字形接头。
2)使用磁珠筛选去除接头自连片段。
3)利用PCR扩增进行文库模板的富集。
4)加入氢氧化钠变性,产生单链DNA片段。
利用Miseq PE300平台进行测序。原始数据上传至美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库中。
1.3.4 生物信息学分析
本部分也由上海美吉生物医药科技有限公司完成。原始测序序列使用Trimmomatic软件质控,使用FLASH软件进行拼接。
1)设置50 bp的窗口,如果窗口内的平均质量值低于20 bp,从窗口前端位置截去该碱基后端所有序列,之后再去除质控后长度低于50 bp的序列。
2)根据重叠碱基overlap将两端序列进行拼接,拼接时overlap之间的最大错配率为0.2,长度需大于10 bp。
3)根据序列首尾两端的barcode和引物将序列拆分至每个样本,barcode需精确匹配,引物允许2 bp的错配,去除存在模糊碱基的序列。使用的UPARSE软件(version 7.1,http://drive5.com/uparse/),根据 97%的相似度对序列进行操作分类单元(operational taxonomic unit,OTU)聚类,去除单序列和嵌合体。利用RDP classifier(http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,比对Silva数据库(SSU123),设置比对阈值为70%。
2 结果与分析
2.1 新鲜牡蛎肠道菌群多样性分析
新鲜牡蛎肠道菌群的检测结果如表1所示。

表1 牡蛎肠道菌群中检测到的主要属Table 1 Major bacterial genus detected in the gut microbiota of fresh oyster

续表1 牡蛎肠道菌群中检测到的主要属Continue table 1 Major bacterial genus detected in the gut microbiota of fresh oyster
新鲜牡蛎肠道菌群主要包括拟杆菌门(Bacteroi-detes,21%)、Epsilonbacteraeota(1%)、厚壁菌门(4%)、梭杆菌门(Fusobacteria,6%)、变形菌门(43%)和柔膜菌门(22%);在主要属(至少一个样品中占整个群落的1%)中,弧菌属最多,其次是支原体属(Mycoplasma)和Roseimarinus属,其它的还有葡萄球菌属、丙酸菌属、气单胞菌属、Psychrilyobacter、油螺旋菌属和黄单胞菌属。
PIERCE等[3]分析了东部牡蛎的菌群多样性,发现在门水平上主要以变形菌门、柔膜菌门、厚壁菌门等为主;曹荣等[11]采用了高通量测序方法分析牡蛎的微生物群落,结果发现在目的分类水平上,弧菌目(Vibrionales,49.3%)、交替单胞菌目(Alteromonadales,12.2%)占优势;在科的分类水平上,主要是弧菌科(Vibrionaceae,36.8%)、希瓦氏菌科(Shewanellaceae,10.3%)和交替假单胞菌科(Pseudoalteromonadaceae,7.2%);在属的分类水平上,弧菌属(28.3%)、希瓦氏菌属(10.3%)、交替假单胞菌属(7.2%)比例相对较高。这些报道与本研究的结果相似。
2.2 超高压处理对牡蛎肠道菌群结构的影响
超高压处理后,对牡蛎肠道菌群进行了多样性分析,结果见表2。Chao1指数和ACE指数表征微生物总物种的数量,Shannon指数代表细菌群落的多样性。

表2 超高压处理后牡蛎肠道菌群多样性的变化Table 2 Effect of UHP treatment on the diversity of oyster gut microbiota
由表 2 可知,与 0.1MPa(对照组)相比,100、200MPa和400 MPa组的Chao1和ACE指数有所提高,但是没有达到显著水平,这表明超高压处理可以使牡蛎肠道菌群的总量有所变化。经过超高压处理后,Shannon指数有所下降,这表明超高压处理可以使牡蛎肠道菌群的多样性降低。而且4个组的测序覆盖率都大于0.99,表明检测数据可信。
为了解不同压强的超高压处理后牡蛎肠道中的菌群结构发生的变化,分析了牡蛎肠道菌群的Shannon稀释曲线、Sobs稀释曲线、聚类分析和主成分分析,结果如图1所示。
从图1a可以看出对照组(0.1 MPa)和200 MPa的距离较远。经过超高压处理后,如图1d所示,肠道菌群的PC1和PC2都发生了很大的变化。此外,由聚类分析可知,与对照组相比较,经过超高压处理后牡蛎肠道菌群结构发生改变,而且随着压强的升高,这种差异越来越大。

图1 超高压处理对牡蛎肠道菌群结构的影响Fig.1 Effect of UHP treatment on the structure of oyster gut microbiota
为更深入地了解超高压处理后牡蛎肠道菌落结构发生的变化,在门水平进行了分析,具体见图2。

图2 超高压处理前后牡蛎肠道菌群在门水平上的相对丰度Fig.2 Relative abundance of oyster gut microbiota at the phylum level before/after UHP treatment
由图2a可知,在门水平上,牡蛎肠道中主要的优势菌门为变形菌门、拟杆菌门、柔膜菌门、厚壁菌门、Epsilonbacteraeota和梭杆菌门6个门。由图2b~图2d可知,与对照组相比,超高压处理对变形菌门、拟杆菌门和柔膜菌门的相对丰度产生了很大的影响。其中超高压处理显著增加了拟杆菌门的相对丰度,与对照组相比,400 MPa组中拟杆菌门的相对丰度升高了57.31%。100 MPa和200 MPa组拟杆菌门的相对丰度则分别升高了5.77%和0.69%。与对照组相比,超高压处理显著降低了柔膜菌门的相对丰度,经过100、200 MPa和400 MPa处理后柔膜菌门的相对丰度分别降低21.94%、21.07%和22.16%。变形菌门的相对丰度在经过100 MPa和200 MPa处理后有所升高,而当压强升高到400 MPa时,其相对丰度却显著下降了23.90%。
牡蛎肠道中变形菌门、拟杆菌门和柔膜菌门是三大优势菌[3,10]。变形菌门细菌都为革兰氏阴性菌,且包括很多致病细菌,如大肠杆菌、沙门氏菌和霍乱弧菌等。超高压处理是一种很有效的杀灭致病菌的加工方式[12],CAO等[10]研究发现牡蛎经过300 MPa处理2 min后变形菌门的相对丰度由77.5%下降到60.0%。由此表明超高压处理后牡蛎肠道菌群趋向于健康的方向发展。
为更进一步了解超高压处理对牡蛎肠道优势菌群的影响,在科水平和属水平上进行了分析,结果如图3所示。

图3 超高压处理前后牡蛎肠道科水平和属水平优势菌群Fig.3 Dominant gut microbiota of oyster at the family level and genus level before/after UHP treatment
由科水平上的相对丰度(图3a)可知,超高压处理后,各组肠道菌群在科水平上主要分为黄杆菌科(Flavobacteriaceae)、弧菌科、Nitrincolaceae、支原体科(Mycoplasmataceae)、Cryomorphaceae、 葡 萄 球 菌 科(Staphylococcaceae)、红杆菌科(Rhodobacteraceae)、Prolixibacteraceae、黄单胞菌科(Xanthomonadaceae)、明串珠菌科(Leuconostocaceae)、气单胞菌科(Aeromonadaceae)和梭杆菌科(Fusobacteriaceae)12个科。在对照组中,弧菌科、支原体科、Prolixibacteraceae和梭杆菌科的占比较大;100 MPa组和200 MPa的肠道菌群组成较为相似,其中黄杆菌科、Nitrincolaceae和葡萄球菌科的占比较大;而400 MPa组的肠道菌群变化最为明显,其肠道菌群主要由黄杆菌科组成,占比超过70%。由图3b可以看出,各组肠道菌群在属水平上主要分为Pseudofulvibacter、弧菌属、Amphritea、葡萄球菌属、支原体属、Roseimarinus、黄单胞菌属、气单胞菌属、Pseudophaeobacter、Psychrilyobacter、Flaviramulus、黄杆菌属(Flavobacterium)、 极 地 杆 菌 属 (Polaribacter)和Tenacibaculum等14个属。在对照组中,弧菌属、支原体属和Roseimarinus占比较大;100 MPa组中,Pseudophaeobacter占比最大;而200 MPa组和400 MPa的肠道菌群变化较大且这两组的菌群组成也较为相似,主要以黄杆菌属、气单胞菌属、葡萄球菌属、黄单胞菌属和Amphritea为主。CRUZ-ROMERO等[9]报道260 MPa超高压处理的牡蛎中分离出的细菌是恶臭希瓦氏菌和荧光假单胞菌,而经过500MPa处理后牡蛎中主要的微生物是芽孢杆菌属(Bacillus)、微球菌属(Micrococcus)、Alcaligenes、 葡 萄 球 菌 属 、 莫 拉 氏 菌 属(Moraxella)和不动杆菌属。
2.3 超高压处理对牡蛎肠道的显著菌群影响
为更清楚地了解超高压处理后牡蛎肠道中具体哪些菌群发生了显著的变化,本研究采用了LEfSe分析,结果见图4。
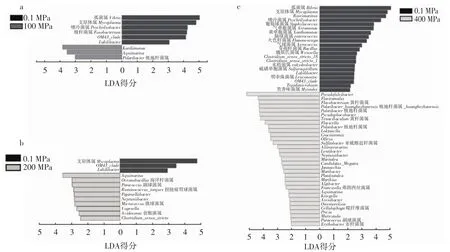
图4 LEfSe分析100、200、400 MPa和对照组之间在属水平上的显著差异菌群Fig.4 The significantly different flora between control group and 100 MPa,200 MPa,400 MPa at the genus level identified by LEfSe analysis
经过100 MPa处理后,在属水平上,弧菌属、嗜冷菌属(Psychrilyobacter)、支原体属、梭杆菌属(Fusobacterium)、OM43_clade和 Labilibacter的相对丰度显著降低。而经过100 MPa处理后,Kordiimonas、Aquimarina和极地杆菌属(Polaribacter)的相对丰度显著增加(图4a)。经过200 MPa处理后,支原体属、OM43_clade和Labilibacter的相对丰度显著降低,这与100 MPa处理后的变化一致。而海洋杆菌属(Oceanobacillus)、Aquimarina、扭链瘤胃球菌属(Ruminococcus__torques)、副球菌属(Paracoccus)、Vogesella、Pajaroellobacter、微球菌属、Clostridium_sensu_stricto、Neptuniibacter和食酸菌属(Acidovorax)的相对丰度显著增加(图4b)。经过400MPa处理后有54种显著差异菌,其中21种菌属的相对丰度显著降低,33种菌属的相对丰度显著增加。在显著降低的菌属中,除了弧菌属、支原体属、Psychrilyobacter、OM43_clade 和 Labilibacter之外,还有葡萄球菌属、气单胞菌属、黄单胞菌属、肠球菌属、火色杆菌属(Flammeovirga)、气球菌属、芽孢杆菌属、魏斯氏菌属(Weissella)、水栖菌属(Enhydrobacter)、明串珠菌属(Leuconostoc)、硫磺单胞菌属(Sulfurospirillum)、Tepidimicrobium 和类香味菌属(Myroides)等。而显著增加的菌属中,除了极地杆菌属、Aquimarina、副球菌属外,黄杆菌科的Pseudofulvibacter、Flaviramulus、黄杆菌属、极地杆菌属(Polaribacter)、Tenacibaculum、Flavicella、Olleya、Maribacter、Algibacter、Kriegella、Arenibacter、噬纤维菌属(Cellulophaga)、Pricia和 Muricauda等菌属的相对丰度显著增加;红杆菌科的Loktanella、Sulfitobacter、Aliiroseovarius、Lentibacter、Jannaschia、Pseudophaeobacter和Planktotalea的相对丰度也显著增加(图4c)。
弧菌属是一种广泛存在于水环境中的革兰氏阴性细菌,在牡蛎养殖水体中较为常见,包含多种食源性致病微生物,霍乱弧菌、创伤弧菌和副溶血性弧菌是其中最常见的致病微生物[13];梭杆菌属可能与炎症性肠病相关,包括溃疡性结肠炎和克罗恩氏病,其丰度的增加会导致疾病的发生[14-15];葡萄球菌属广泛分布在各种环境中,包括人和动物的皮肤和黏膜以及土壤、沙子和水,并可引起食源性疾病,如金黄色葡萄球菌(S.aureus)[16];气单胞菌属广泛存在于淡水、鱼类和贝类中,是常见的食源性致病微生物,可引起自限性腹泻,其中儿童是最易受感染的人群[17];肠球菌属是重要的人类病原体,如最常见的人类分离株粪肠球菌(E.faecalis)和屎肠球菌(E.faecium),可引起尿路、腹内、骨盆和伤口感染[18];类香味菌属是常见于环境来源的细菌,例如水和土壤,同时也是一种病原微生物,倾向于侵染免疫功能低下的宿主[19];气球菌属是成簇生长的革兰氏阳性细菌,被认为是一种人类病原体,可引起尿路感染和败血症[20]。经过超高压处理后,这些致病菌属的相对丰度显著降低,而且仅经过100 MPa处理5 min后,弧菌属和梭杆菌属相对丰度就有大幅的降低,表明超高压处理能有效减少牡蛎肠道中的有害微生物。
除此之外,试验还发现经过超高压处理后的牡蛎未发现(或相对丰度<0.1%)牡蛎中常见的腐败微生物,如交替假单胞菌属和希瓦氏菌属。交替假单胞菌属和希瓦氏菌属可使水产品在贮藏过程中产生不良气味,已被证实是多种水产鱼类和贝类低温贮藏过程中的特定腐败菌[11,21]。因此,超高压处理还能降低牡蛎在贮存过程中发生腐败的风险,并且有助于改善牡蛎的贮藏品质,延长货架期。
Kordiimonas包含棒状、严格需氧的耐盐细菌,存在于海洋沉积物中[22]。Aquimarina的细菌均从海水、沉积物、海胆和海洋海绵中分离出来,表明该属的成员广泛分布于海底环境中[23]。海洋杆菌属、副球菌属、Vogesella、Pajaroellobacter、Neptuniibacter 和微球菌属大多分布于海洋环境中,具有较好的耐压性[24-27]。黄杆菌科的微生物广泛分布于海洋环境中,如嗜冷黄杆菌(F.psychrophilum)和柱状黄杆菌(F.columnare),以及包含许多具有环境和生物技术意义的细菌[28]。同样,红杆菌科的微生物也大多分布于海洋中,而且红杆菌科的微生物是地球生物化学循环的关键参与者,在远洋环境中占细菌群落的30%,并且通常与真核生物共生[29]。超高压处理后,上述这些海洋源菌属的相对丰度显著增加,表明了海洋源的微生物具有一定的耐高压的能力。海洋微生物所处的环境中有高压的存在,在长期的进化中这些微生物已经适应了在一定压强的环境下存活,所以短时间超高压处理并不能很好地杀灭这部分微生物。
3 结论
超高压技术目前作为非热杀菌成为牡蛎高品质加工的重要趋势,但该技术对处理后牡蛎体内菌群轮廓不清晰、保证牡蛎产品安全性的超高压技术参数不全面。针对这些问题,本文主要研究了100、200 MPa和400 MPa处理5 min对牡蛎肠道菌群多样性的影响。首先分析了牡蛎肠道菌群的结构变化,然后分析了高静水压对牡蛎肠道菌群在门、科和属水平上的变化,最后通过LEfSe分析显著变化的肠道菌群。研究结果表明,超高压处理可使牡蛎肠道菌群的总量有所变化,降低肠道菌群的多样性。超高压处理更有利于弧菌、气单胞菌等致病菌相对丰度的减少,100 MPa、5min的处理即可达到显著降低致病菌相对丰度的效果,从而有效降低牡蛎的食用风险。此外,超高压处理后能有效杀灭水产品中常见的腐败微生物,如交替假单胞菌属和希瓦氏菌属,从而降低牡蛎在贮存过程中发生腐败的风险,并且有助于改善牡蛎的贮藏品质,延长货架期。海洋源的菌属表现出很好的耐压性,400 MPa、5 min处理的牡蛎肠道菌群主要由黄杆菌科组成,占比超过70%。
