主动脉分支支架的血流动力学分析
2021-06-19王晓天冯海全胡何节
洪 磊 王晓天 冯海全 胡何节
中国科学技术大学第一附属医院血管外科,安徽 合肥 230001
近年来,Stanford B型主动脉夹层的发病率逐年升高,且病死率较高。主动脉弓上有供应脑部、上肢等重要器官血供的动脉分支。对于锚定区不足的主动脉夹层患者,为了获得足够锚定区,将覆膜支架前移可能导致主动脉弓部分支(无名动脉、左颈总动脉、左锁骨下动脉)被封堵,而直接封堵分支动脉又会造成脑部及上肢供血不足。植入分支支架能保证分支血管血供,但行分支支架植入术后,随着时间的推移,分支支架内再狭窄和内漏的发生率较高。因此,本研究通过计算机模拟构建胸主动脉主体支架和左锁骨下动脉分支支架,探究分支血管流场变化情况。近年来,借助模拟计算机流体动力学(computational fluid dynamics,CFD)获得血流动力学参数具体分布情况的方法被广泛应用于评估临床治疗复杂的主动脉夹层病变效果,其安全性和有效性得到了验证,并获得多数学者和医师的认可[1-2]。通过CFD模拟获得主动脉夹层病变患者的功能学信息,成为个性化诊断和治疗的趋势[3],但关于分支支架内的血液流动特性,目前鲜有报道。本研究模拟主动脉分支支架的血流动力学数据,提供临床上亟待寻找的分支支架的血流动力学参数,探讨分支支架植入术后再狭窄的发生原因,现报道如下。
1 试验与方法
1.1 数据处理
影像数据来源于中国科学技术大学第一附属医院2020年12月收治的1例Stanford B型主动脉夹层患者,男性,69岁,将计算机断层扫描血管造影(computed tomography angiography,CTA)原始数据另存为DICOM格式。扫描参数:层厚1.30 mm,层间距1.25 mm,扫描电压100 kV,X线管电流250 mA。
1.2 模型重建
在计算流体力学中,前期三维模型合理重建对计算结果具有重要意义。将患者CTA增强影像DICOM标准格式的断层数据导入Mimics 20.0医学图像处理软件中,采用自动化阈值分割算法,阈值为226 HU,这一阈值能够清晰地分辨出血管及其周围组织[4-5],并通过手动调整、蒙版编辑(将血管周围组织剔除)和区域增长对血管区域进行图像分割,建立三维模型。在三维视角中,利用区域增长功能将主动脉周围骨头等组织尽可能剔除,进一步提取发生病变的主动脉夹层三维重建模型。测量显示夹层破口距左锁骨下动脉开口远心端15 mm。为了模拟不同分支支架截面类型,需要在2D俯视图中再次利用区域增长工具手动设置不同深度分支支架模型。之后将三维重建模型在Mimics 20.0医学图像处理软件保存为STL格式,并导入Geomagic Studio 12.0逆向工程软件中,进一步行光顺性处理,精确曲面,生成NURBS曲面片分布,最后拟合曲面片,以IGES格式导出,见图1。
当主动脉夹层锚定区不足15 mm时,将覆膜支架前移封堵左锁骨下动脉,再植入左锁骨下动脉分支支架,将左锁骨下动脉分支支架突入主干支架内不同的深度(0、3、6、10 mm)(图2),同时设置未植入分支支架的模型作为对照,比较植入不同深度的分支支架对分支血管血流动力学的影响。
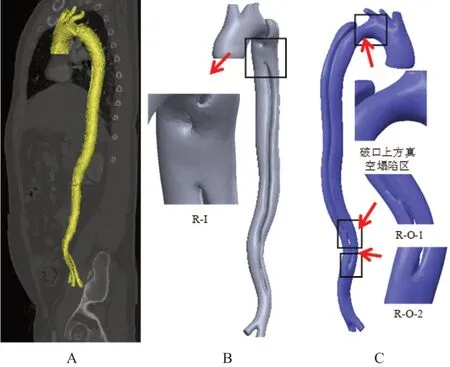
图1 主动脉夹层个性化模型

图2 分支支架植入不同深度
1.3 计算方法
采用ANSYS Fluent 15.0模块进行求解分析,根据已有资料设定血液为不可压缩的牛顿流体,正常层流,血液密度为ρ=1060 kg/m3,血液运动黏度系数μ=0.0035 kg/(m·s)[6]。入口条件:血流速度取人体主动脉血流速度的平均值0.8 m/s。流域部分出口条件:设定所有出口的流动已经稳定,出口条件设立为零牵引力,即相对压力为0 Pa条件。流域的整体内环境按照血管正常的内压设为800 Pa。为方便计算机数据模拟,设定管壁满足无滑移条件。选用SIMPLEC算法进行压力-速度耦合计算,梯度、压力和动量分别选用基于最小二乘单元、标准和二阶迎风格式的离散格式,并且将残差设置为10-4,计算前对计算模型入口进行初始化。在胸主动脉中,血液的流动应该遵守质量守恒的连续性方程和动量守恒的Navier-Stokes方程。
2 结果
2.1 冠状剖面速度矢量图
对照模型分支血管近心端一侧形成了无序低速涡流区域,分析是由于血液是在离心力和横向压力阶差的作用下产生的。然而,在相对的另一侧,血流速度明显大于低速涡流区域,且与主干流速相近,方向沿着分支血管壁(图3对照)。随着支架置入深度的增加,模型3A中的分布规律与对照组相近,模型3B分支中的血流强度明显较对照模型和模型3A有所减弱,涡流区域有所增大。模型3C、3D随着植入深度的增加,分支供血量相较于对照模型、模型3A和模型3B明显降低,在分支的中心出现涡流区域,分析主要是由于分支覆膜支架改变了血流方向所致,并且在分支入口处也产生不同强度的速度涡流区域。
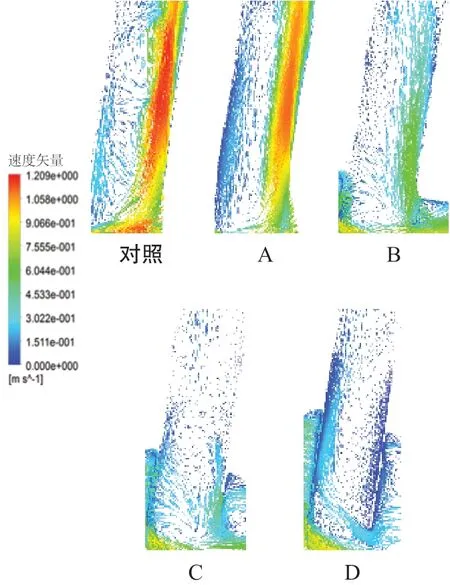
图3 主动脉分支血管冠状剖面的速度矢量图
2.2 矢状剖面速度矢量图
从矢状剖面看,模型4A的整体分布趋势与对照模型一致,血流强度有所减弱,分析是由于覆膜支架对分支血管血流产生的摩擦力所致。整体上,分支血流强度随着分支支架植入的深度而逐渐减弱,但在分支血管内部管腔中仍然有两个对称的涡流区,最终血流方向均保持向上流动的趋势(图4)。

图4 主动脉分支血管矢状剖面的速度矢量图
2.3 横断剖面速度矢量图
从主动脉分支血管血流入口处横断面的速度矢量图看,模型5A与对照模型并无明显区别,血流方向从近心端低速区向远心端高速区运动(即图中从左至右)。但随着植入支架深入模型5B、5C、5D的血流强度大幅度减弱,并且整体表现出两个对称的、从远心端向近心端逆向回流的涡流区域(图5)。
2.4 分支血管壁面剪切力分布
在分支支架植入前,血液对分支血管壁面的剪切力多为1~5 Pa(图6对照)。在远心端一侧相对于近心端的壁面剪切力明显偏高。分析其原因可能是由于远心端一侧改变了血液的流动方向,增加了与血管壁面的摩擦力,使该侧壁面所受的冲击力较大所致。由于人在正常生理状态下,动脉系统的剪切力为1~7 Pa,试验结果在此范围之中,一定程度上证明了本研究结果的合理性。
模型6A在血流出口处(即未被分支支架覆盖区域)又呈现出与对照模型相一致的壁面剪切力分布规律。因此,模型6A的流体动力学结果相对更为理想。但又考虑到分支支架在血液的冲刷下会发生一定的位移从而使术后发生内漏,不得不考虑将支架植入一定深度。模型6B支架覆盖外区域的低壁面剪应力区域面积相较于模型6A有所增大,而模型6C和6D支架覆盖外区域呈现出大面积的低壁面剪应力区域。分析其原因主要是在低流速涡流区内易形成血流瘀滞区,从而呈现出大面积的低壁面剪切力区域。而大面积的低剪切力区域使血小板滞留于该区域,易被诱导从而与血管内皮下组织中的Ⅵ型胶原蛋白、纤维连接蛋白及层粘连蛋白发生黏附,使内膜异常增生,动脉粥样硬化的发生风险进一步加大。

图6 不同模型中分支血管壁面剪切力分布图
3 讨论
Etheredge等[7]首先报道了胸腹主动脉瘤的开放手术治疗方法,开放手术成为治疗胸腹主动脉瘤的金标准。然而,传统手术易导致的肾功能衰竭、截瘫等术后并发症发生,且发生率较高。主动脉腔内隔绝术是针对主动脉夹层、胸腹主动脉瘤的一种微创治疗方法,能够降低术后并发症的发生率[8]。然而,对累及重要分支血管的主动脉病变,传统的主动脉腔内修复术会导致重要脏器缺血,因此应用受限。随着分支支架/开窗技术的发展,全腔内修复术适应证有所增加。20世纪90年代后期,开窗支架首先被应用于累及肾动脉的腹主动脉瘤,目的在于维持肾动脉通畅。后期越来越多的保留分支血管的技术在临床上得到应用,包括杂交去分支技术、平行支架技术和开窗/分支支架技术。平行支架技术(“烟囱”“潜望镜”“八爪鱼”“三明治”)不需要特殊制备的支架,操作相对简单,但远期Ⅰ型内漏和分支支架再狭窄的发生率较高。Pitoulias等[9]发现,随访2年,烟囱支架分支支架的再狭窄率为7.8%。相对于平行支架技术,支架开窗/分支支架技术的远期通畅率高,内漏发生率低,在临床上得到广泛应用。支架开窗技术包括原位开窗和预开窗。原位开窗是指先将主体支架释放到位,利用导管导丝通过无名动脉、锁骨下动脉或颈动脉穿刺主体支架覆膜,建立通路后植入分支支架。2004年,McWilliams等[10]报道了利用原位开窗技术治疗1例胸主动脉瘤累及锁骨下动脉的患者。原位开窗技术常用的开窗方式包括激光、射频、RUPS100穿刺针和Fu-Through原位穿刺系统。其中,激光和射频在开窗过程中因覆膜碎屑脱落可能导致远端动脉栓塞。针刺破膜开窗技术在破膜时可能损伤大血管,从而导致大出血。另外,部分弓上分支动脉与主动脉弓角度过小引起穿刺方向偏移,无法有效传递机械力,容易导致穿刺失败。体外预开窗技术利用患者术前计算机断层扫描影像资料,通过计算机重建,计算分支血管开口位置。在体外,将主动脉覆膜支架释放后,根据测量数据预先在主动脉覆膜支架上开窗,或利用3D打印技术通过计算机断层扫描数据构建患者主动脉模具,将主动脉覆膜支架套入模具中进行预开窗。随着计算机模拟结果的越来越精确和开窗技术的改进,体外预开窗手术的成功率越来越高。研究发现,预开窗分支支架的1年通畅率达95.2%,内漏发生率为11.3%[11]。各种支架材料、器械和手术方式的不断改进使主动脉腔内隔绝术成为胸腹主动脉疾病治疗的首选。然而,分支支架通畅率和内漏仍是制约开窗支架技术发展的两个主要因素。
已有研究对于主体支架内血流动力学的变化情况进行探讨,但很少有研究涉及分支血管支架内的血流动力学改变[12]。本研究基于患者的 CTA数据分别模拟植入不同深度分支支架对支架内血流动力学的影响。通过CFD模拟获得分支支架截面血液流速、血流状态、壁面压力和壁面剪应力等血流动力学参数,对分支支架内血流动力学进行功能学评估,以便更好地了解分支支架植入后支架内血流动力学变化情况。从冠状剖面分析,锁骨下动脉近心端形成无序低速涡流区域,流速减慢,而远心端一侧血流速度明显加快,血流呈现出与主干血管相似的层流。随着分支支架植入深度的增加,远心端和近心端分支支架涡流区域均增加,血液流速减弱。从矢状剖面分析,分支血流强度随着分支支架植入深度逐渐减弱,同时涡流区域增加。横断面血流分析结果显示,随着分支支架植入深度的增加,血流愈发紊乱。本研究对分支支架管壁剪切力的变化进行分析,结果显示,随着分支支架植入深度的增加,管壁低剪切力区域增加,且累及支架远端。在植入分支支架后,在分支支架覆盖的区域均呈现出大面积的低壁面剪切力,如图6所示,分析主要是由于覆膜的存在削弱了对壁面的直接作用力。研究表明,内膜增生程度与剪切力呈负相关,低壁面剪切力区域的内膜增生厚度明显高于高壁面剪切力区域。究其原因,血管低壁面剪切力区域的形成破坏了正常血液流动的层流状态,促进炎性细胞迁移至局部血管内皮下层,从而使血小板活性增强,并在血管内皮下层发生黏附和聚集[12-13]。低剪切力加速脂质颗粒和炎性分子在血管内膜沉积,促进血管平滑肌细胞增殖以及胶原蛋白和弹力蛋白合成,使血管内膜增生,管腔狭窄,管壁增厚[14-15]。形态学分析结果显示,在支架剪切力最低的区域,内膜增生最为显著。低速血流形成的涡流区域引起内皮细胞功能受损,局部亦容易形成血栓。本研究结果提示,分支支架置入主体支架内越深,分支支架内血流速度越缓慢,剪切力越低,支架内再狭窄或血栓形成的概率越大。另一方面,若分支支架伸入主体支架过短,则会增加发生内漏和支架移位的概率。
基于以上研究结果,理想的分支支架既能避免其伸入主体支架,又能保证其与主体支架之间连接紧密,避免内漏发生,而一体式分支支架能很好地解决这两方面的矛盾。根据患者主动脉及分支动脉解剖特点定制一体式支架是一个较为理想的选择,但定制周期较长,价格昂贵,限制了其在临床上的使用。目前,分支型一体式支架既能避免分支支架植入主体支架内,同时分支支架与主体支架间无缝连接又能减少内漏的发生。分支型一体式支架提供了不同的主体支架及分支支架直径规格,可选择的范围较大,已广泛应用于弓部三分支受累的主动脉夹层的治疗。一项多中心、单臂、前瞻性的临床试验结果亦显示,对患者平均随访48~72个月,分支型一体式支架的通畅率达93%,内漏的发生率为5%[16]。因此,认为分支型一体式支架是未来分支支架技术发展的主流方向。
综上所述,对于复杂多变的主动脉夹层,分支支架植入主体支架内的深度不同,血流动力学参数不同。其中,分支支架植入主体支架内越深,血流动力学改变越明显。通过逆向建模技术和CFD模拟可以得到具有时效性的主动脉夹层分支支架内血流动力学参数,为进一步对病例的数值分析和治疗方案的制定提供有效的评估依据。
