miR-338-3p通过靶向RUNX2负调控人骨髓间充质干细胞成骨分化且促进骨质疏松
2021-06-18刘国樑秦明照
刘国樑,秦明照
(首都医科大学附属北京同仁医院干部医疗/老年医学科,北京 100730)
骨质疏松症是一种内分泌和代谢性疾病,常伴随并发骨矿物质密度和骨质量的降低[1-2]。导致患者易发生脆性骨折[3]。人骨髓间充质干细胞(human bone marrow stromal cells,hBMSCs)的分化调控参与多种分子途径调控,在成骨性疾病的干细胞治疗中显示出较良好的潜力[4]。微核糖核酸(micro ribonucleic acids,miRNAs)通过调控靶基因的表达参与生物学过程,在骨骼发育、骨质疏松症发病机制中发挥着重要作用,可作为治疗骨类疾病的新的潜在靶点[5-6]。miRNA-153通过靶向II型骨形态发生蛋白受体抑制人间充质干细胞的成骨分化[7]。在成骨细胞分化过程中,miRNA-214的上调增加了骨质疏松小鼠间充质干细胞的数量[8]。RUNX2作为成骨细胞分化的关键调节因子,对正常骨骼发育和分化至关重要[9-10]。本研究通过探讨miRNA-338-3p在hBMSCs成骨分化中的作用及其与RUNX2的相互关系,旨在为骨质疏松症的治疗提供新的思路。
1 资料与方法
1.1 一般资料
选取2019年1月至2019年12月首都医科大学附属北京同仁医院收治的60例骨质疏松症患者为研究对象。其中,男性36例,女性24例;平均年龄(73.12±8.27)岁;所有患者均符合骨质疏松症的相关诊断标准[11]。排除标准:(1)恶性肿瘤患者;(2)合并脑出血或颅内出血史;(3)合并严重心、肝等系统性疾病者;(4)合并感染、自身免疫类疾病者。另选60名同期非骨质疏松者作为对照组。两组性别、年龄等一般资料比较,差异无统计学意义(P>0.05),具有可比性,见表1。
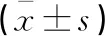
表1 两组一般资料比较
两组入院时,收集其病历资料,包括年龄、性别、体质指数、吸烟饮酒情况及合并基础病等。入院后清晨,采集两组静脉血8 mL,静置30 min后,4 ℃,3 000 g/min离心10 min。取上清(非溶血状态)在4 ℃再次离心,135 000 g/min,持续15 min。随后,将血清标本分装,每管200 μL,-80℃ 保存备用。
1.2 hBMSCs的分离和培养
首先,采用骨髓粘连法从骨质疏松症患者和对照组中提取10 mL新鲜骨髓置于无菌离心管中,采用密度梯度离心法分离hBMSCs细胞,倒置显微镜下观察hBMSCs细胞生长情况及形态,选用第3代对数生长期细胞用于实验研究[12]。分离的hBMSCs培养在phenol red-free α-minimum Eagle’s培养基中 (α-MEM;HyClone,Logan,UT,USA),含10%胎牛血清 (FBS-HI)(Gibco,Grand Island,NY,USA),100 U/mL青霉素和100 μg/mL链霉素(Gibco,Grand Island,NY,USA)。培养基每两天更换1次,细胞传代至90%融合度。然后,将hBMSCs在phenol red-free α-minimum Eagle’s培养基中培养 (α-MEM;HyClone,Logan,UT,USA),含1%胎牛血清 (fetal bovine serum,FBS-HI)( Gibco,Grand Island,NY,USA),100 U/mL青霉素和100 μg/mL链霉素(Gibco,Grand Island,NY,USA),抗坏血酸50 μg/mL(Gibco,Grand Island,NY,USA),10 mM甘油磷酸酯和0.1 μg /mL地塞米松(Sigma-Aldrich,St.Louis,MO,USA),进行成骨诱导。每3 d更换1次成骨诱导培养基。
1.3 细胞转染
miRNA-338-3p模拟物(miRNA-338-3p mimics,5’-GGGTCCAGCATCAGTGATT-3’)、miRNA-338-3p抑制剂(miRNA-338-3p inhibitor,5’-CCCAGGTCGTAGTCACTAA-3’)、RUNX2过表达质粒(RUNX2)或阴性对照(miR-NC)均购自上海基因制药有限公司(中国上海)。按照Lipofectamine RNAIMAX转染试剂盒(Invitrogen公司,美国)的说明书,将miRNA-338-3p模拟物、miRNA-338-3p抑制剂、RUNX2过表达质粒或阴性对照转染到hBMSCs细胞系中。转染前24 h,将融合度为75%的细胞接种于6孔板中培养;转染当天将Lipofectamine RNAIMAX转染试剂与opti-MEM培养液及合成的miRNA-338-3p模拟物、miRNA-338-3p抑制剂、RUNX2或阴性对照均匀混合,室温孵育5~10 min后加入细胞培养液中;转染48 h后,胰酶消化细胞,磷酸缓冲盐溶液(phosphate buffer saline,PBS)冲洗1次,保存备用。
1.4 RNA提取和实时定量PCR
严格按照TRIzol试剂操作说明(Invitrogen,Carlsbad,CA,USA)提取骨质疏松患者、对照组血清和hBMSCs中的总RNA。采用Nanodrop光谱仪(Thermo Fisher Scientific,Waltham,MA,USA)检测RNA纯度和浓度。随后,使用逆转录系统将RNA反向转录为cDNA (Thermo Scientific,CA,USA)。采用ABI PRISM 7500序列检测系统(ABI),采用实时荧光定量PCR 2 x SYBR qPCR Mix(北京中曼生物技术有限公司,中国)检测miR-338-3p的水平。扩增体系如下:PCR反应包含2 μL cDNA、0.4 μL正向引物、0.4 μL反向引物、7.2 μL H2O2和10 μL SYBR;扩增条件为25 ℃,10 min,48 ℃,30 min,95 ℃,5 min,U6作为实验内参。SYBR Green检测RUNX2蛋白、骨钙素(osteocalcin,OCN)、骨桥蛋白(osteopontin,OPN)、I型胶原蛋白(collagen I)mRNA表达水平,GAPDH作为实验内参,采用2-ΔΔCt法计算表达水平。所用引物如表2。

表2 RT-qPCR引物序列
1.5 Western blot
为探讨miR-338-3p对RUNX2蛋白表达的影响,采用冷的PBS洗涤hBMSCs两次,然后用RIPA裂解缓冲液裂解(江苏Beyotime生物技术研究所)和蛋白酶抑制剂(Roche,中国)提取所用总蛋白。使用BCA蛋白分析试剂盒(江苏Beyotime生物技术研究所)对蛋白进行定量分析。取50 μg总蛋白上样,经10% SDS-PAGE分离并转移到PVDF膜上,在37 ℃下用5%脱脂乳封闭1 h,加入一抗(RUNX2 (1∶1 000;Abcam,USA)),GAPDH浓度1∶1 000)在4 ℃下孵育过夜,随后,将聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)膜用三乙醇胺缓冲盐水溶液(tris buffered saline,TBS)洗涤3次,每次10 min。加入羊抗兔二抗(1∶1 000,Cell Signaling Technology Inc.,MA,USA)室温孵育2 h,TBS洗涤3次,每次10 min。采用Fusion FX5图像分析系统进行分析。
1.6 碱性磷酸酶(alkaline phosphatase,ALP)活性检测
用磷酸盐缓冲溶液洗涤hBMSCs (PBS;Gibco,Grand Island,NY,USA),用1% Triton X-100裂解15 min,10 000 g离心5 min。收集上清液,根据碱性磷酸酶测定试剂盒说明书测定碱性磷酸酶活性(DALP-250,Abcam,Cambridge,MA,USA),采用酶标仪(Promega,Madison,WI,USA)在波长为450 nm下检测光密度(optical density,OD)。
1.7 茜素红染色
采用冷的PBS洗涤hBMSCs两次,用70%乙醇预冷固定,吸去固定液,采用ddH2O洗涤hBMSCs 5次。随后用40 mm茜素红染色10~15 min,用ddH2O清洗5次。最后用倒置显微镜(Olympus,Tokyo,Japan)观察并捕获钙化结节(橙色)。
1.8 双荧光素酶报告基因检测
将hBMSCs细胞接种于24孔板中,转染前孵育24 h,待细胞达到60%融合时,将miR-338-3p模拟物和miR-NC分别于RUNX2 3’-UTR野生型或突变型重组质粒共转染。转染48 h后,使用Renilla luciferase报告基因(pRL-CMV;Promega,USA)检测荧光素酶活性。报告基因活性采用荧光素酶检测试剂盒(Promega,USA)根据生产厂家的方案进行测定。所有实验重复3次。
1.9 统计学分析
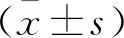
2 结果
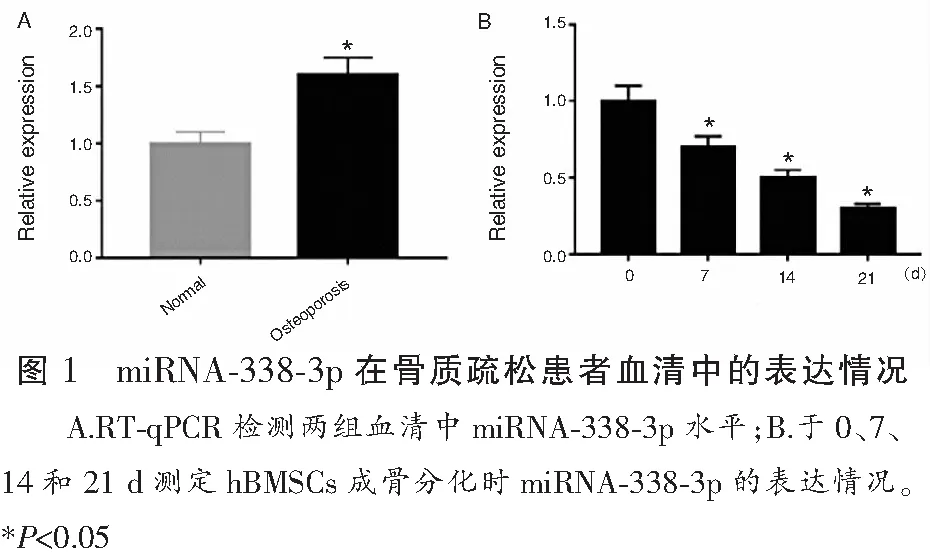
2.1 miRNA-338-3p在骨质疏松患者血清中的表达情况
RT-qPCR分析显示,骨质疏松患者血清中miRNA-338-3p水平相比健康对照组表达量上升(P<0.05)(图1A);此外,分别在0、7、14和21 d测定hBMSCs成骨分化中miRNA-338-3p的表达,数据显示,miRNA-338-3p的表达随着成骨诱导时间的延长而逐渐降低(P<0.05)(图1B)。
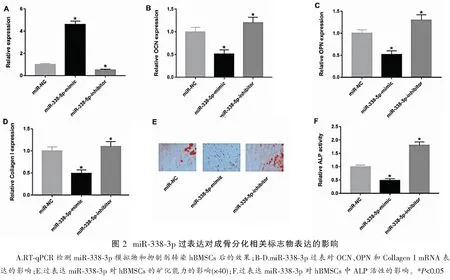
2.2 miR-338-3p过表达对成骨分化相关标志物表达的影响
为了阐明miR-338-3p在成骨分化中的潜在功能,构建miR-338-3p模拟物和抑制剂,RT-qPCR检测转染hBMSCs后的效果发现,miR-338-3p模拟物和抑制剂转染成功(图2A)。miR-338-3p过表达下调了OCN、OPN和Collagen I mRNA的表达,相反,miR-338-3p敲低上调了OCN、OPN和Collagen I mRNA表达水平(图2B-D)。与对照组相比,miR-338-3p过表达削弱了其矿化能力(P<0.05)(图2E)。过表达miR-338-3p的hBMSCs细胞系中ALP活性下降(P<0.05)(图2F)。
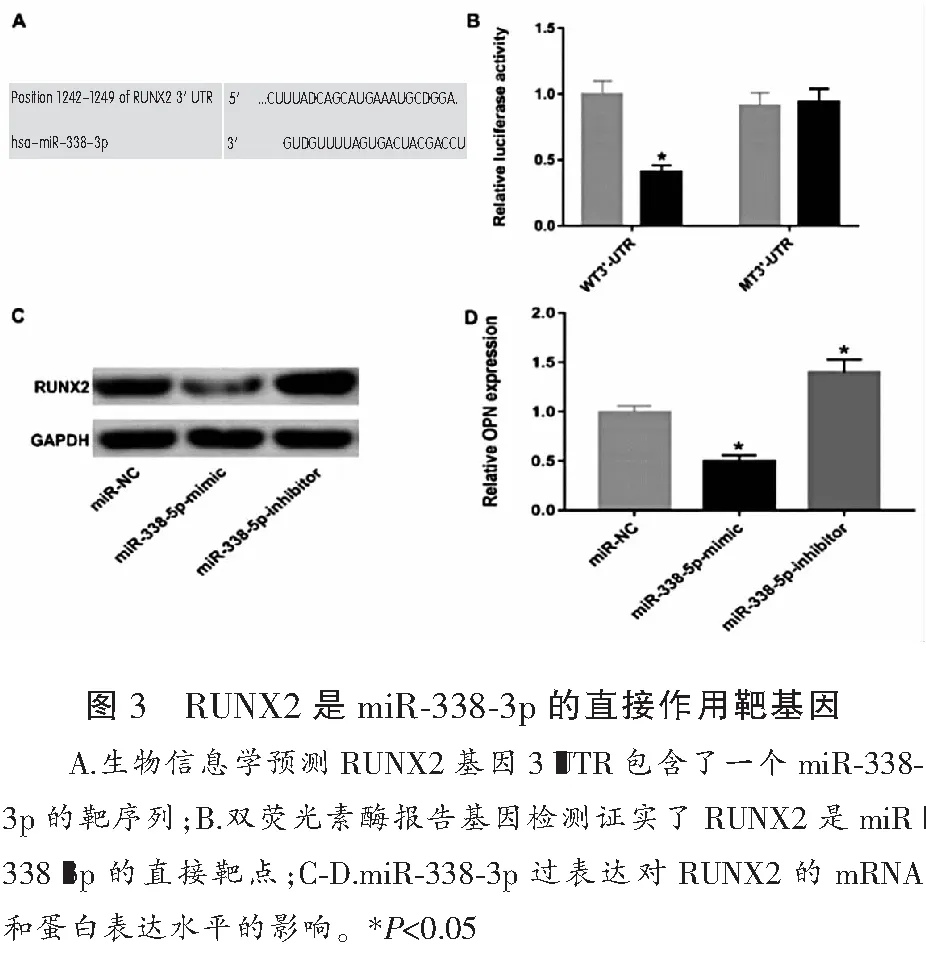
2.3 RUNX2是miR-338-3p的直接作用靶基因
生物信息学预测显示,RUNX2基因的3’端非编码区(3’UTR)包含了一个miR-338-3p的靶序列(图3A)。在hBMSCs细胞系中,双荧光素酶报告基因检测进一步证实了RUNX2是miR-338-3p的直接靶点(WT:miR-NC(1.10±0.22),miR-338-5p-mimic(0.45±0.05);MT:miR-NC(0.98±0.16),miR-338-5p-mimic(1.01±0.18)(图3B)。此外,western blot和RT-qPCR分析表明,与对照组相比,miR-338-3p过表达降低了RUNX2的mRNA和蛋白表达水平(图3C-D);相反,miR-338-3p敲低上调了RUNX2的mRNA和蛋白表达水平(图3C-D)。
2.4 miR-338-3p通过抑制RUNX2的表达抑制成骨分化
为进一步探讨miR-338-3p在成骨分化中的作用机制,在hBMSCs细胞系中分别转染miR-NC、miR-338-3p模拟物和miR-338-3p模拟物+RUNX2。结果表明,过表达miR-338-3p可显著降低ALP活性,而RUNX2过表达可以逆转这一现象(图4A)。同样,茜素红染色显示,过表达miR-338-3p的hBMSCs细胞系矿化能力明显受到抑制,而通过共转染miR-338-3pp模拟物和RUNX2,矿化程度进一步升高(图4B)。过表达miR-338-3p,OCN、OPN和collagen I mRNA的相对表达水平下调。而在RUNX2过表达后,OCN、OPN和collagen I mRNA水平升高(图4C-E)。
3 讨论
骨质疏松症是一种常见的复杂疾病,其主要表现为骨骼微结构恶化,强度受损,使之更易发生骨脆性骨折[13]。据估计,全球骨质疏松症的患病人数超过7 500万人,每年与骨质疏松症相关的骨折超过150万人,到2050年髋部骨折预计将达到630万人[14-15]。骨骼的微观结构由矿化的细胞外基质和骨重塑单元组成,包括骨细胞,成骨细胞,破骨细胞等[16]。破骨细胞和成骨细胞对于骨骼的维持和重塑至关重要。骨形成和骨吸收之间的不平衡会导致代谢性骨疾病,如骨吸收的过程快于新骨的形成,骨质疏松症将会发生[17]。本研究发现,骨质疏松患者血清miR-338-3p水平相比对照组表达量明显上升,miR-338-3p过表达影响OCN、OPN和Collagen I mRNA的水平,且明显削弱了hBMSCs矿化能力和ALP活性。双荧光素酶报告基因检测证实,RUNX2是miR-338-3p的直接靶点。RUNX2过表达可逆转miR-338-3p 对hBMSCs成骨分化的抑制作用。可见,miR-338-3p通过靶向RUNX2负调控hBMSCs的成骨分化,从而促进骨质疏松的进展。

miRNA是长度为20~22个碱基的小型非编码RNA,被认为是一种重要的表观遗传修饰分子,可通过影响细胞分化和凋亡来介导目标基因的转录后调控[18]。miRNA在破骨细胞和成骨细胞生长和分化中的作用已得到广泛的研究[19]。其中成骨细胞的分化是骨稳态的重要过程, miRNA可以调节成骨细胞分化的生物学过程[20]。有研究[21]表明,miR-375通过靶向RUNX2抑制成骨细胞分化,同时降低了一些关键的成骨细胞标志物的活性。miR-96通过抑制成骨细胞中HB-EGF/EGF受体信号传导来促进成骨细胞分化[22]。本研究发现,骨质疏松患者血清中miRNA-338-3p水平相比健康对照组表达量明显上升,此外,分别在0、7、14和21 d测定hBMSCs成骨分化中miR-338-3p的表达数据显示,miR-338-3p的表达随着成骨诱导时间的延长而逐渐降低。可见,miR-338-3p可能通过抑制成骨分化,进而影响骨质疏松症的进展。
miR-338-3p通过下调WNT2B蛋白增强卵巢癌细胞对顺铂的敏感性[23],通过抑制MACC1基因阻碍结直肠癌的进展[24],通过靶向蛋白磷酸酶4调节亚单位1(protein phosphatase 4 regulator subunit 1,PP4R1)调节蛋白磷酸酶4 (protein phosphatase 4,PP4)表达来介导肝细胞核因子4α(hepatic nuclear factor 4α,HNF-4α)[25]。miR-338-3p的过表达还可抑制成骨细胞分化标记物的表达,从而减少成骨细胞分化[26]。可见,miR-338-3p有可能成为治疗多种疾病的潜在靶点,且与骨质疏松症的发生及发展密切相关。ALP、Collagen I是早期成骨分化的标志物,而OCN和OPN是其晚期分化的标志物[27]。本研究发现,miR-338-3p过表达显著下调了OCN、OPN和Collagen I mRNA的表达,相反,miR-338-3p敲低上调了OCN、OPN和Collagen I mRNA表达水平。此外,miR-338-3p过表达削弱了hBMSCs矿化能力和ALP活性,表明miR-338-3p对成骨分化具有较明显的抑制作用。
hBMSCs在成骨分化的过程中有多种转录因子参与调节,如RUNX2/Cbfa1、Osx等[28]。其中RUNX2对于成骨细胞分化和软骨细胞成熟至关重要。RUNX2在成骨细胞和软骨细胞中均有表达,在敲除RUNX2的小鼠中,成骨细胞和骨形成,软骨细胞成熟均明显受到抑制[29]。近年来,有研究[30]发现,miRNA通过调控RUNX2的表达来影响成骨分化。如,miR-133通过靶向RUNX2抑制小鼠C2C12细胞分化为成骨细胞。Kim等[31]发现,上调小鼠C3H10T1/2细胞中的miR-433,可直接抑制RUNX2和BMP-2的转录后水平。Vimalraj等[32]证明了Smurf1通过蛋白酶体途径降解RUNX2。而在BMSCs中,miR-15b通过下调Smurf1可上调RUNX2水平。可见,RUNX2与上下游分子相互作用,进一步影响骨骼的生长发育,在骨质疏松症中起重要作用。本研究通过生物信息学预测显示,RUNX2基因的3’UTR包含了一个miR-338-3p的靶序列,双荧光素酶报告基因检测进一步证实了RUNX2是miR-338-3p的直接靶点。miR-338-3p过表达降低了RUNX2的mRNA和蛋白表达水平。而RUNX2过表达可以逆转miR-338-3p对成骨分化的抑制作用。可见,RUNX2在骨质疏松症中至关重要。
综上所述,miR-338-3p在骨质疏松中高表达,随着成骨分化时间的延长其表达逐渐减少。此外,miR-338-3p通过靶向RUNX2负调控hBMSCs的成骨分化,从而促进骨质疏松的进展。
