腹腔镜肝切除术对原发性大肝癌的近期疗效
2021-06-18马翔
马翔
(蚌埠医学院第一附属医院肝胆外科,安徽 蚌埠 233000)
原发性肝癌是临床常见的恶性肿瘤,好发于中老年男性,发病率和死亡率均较高。据报道[1],肝癌发病率居恶性肿瘤的第5位,死亡率居第2位,造成了沉重的社会疾病负担。以手术切除为主的综合治疗是目前临床救治的主要手段,包括常规开腹切除术和腹腔镜肝切除(laparoscopic hepatectomy,LH)。目前,普遍认为LH已成为直径≤5 cm原发性肝癌的首选,手术更加微创,切口更美观,明显减轻患者身心痛苦,相关报道[2-3]也较多。但对于原发性大肝癌,LH是否适合开展和推广应用尚无权威定论。随着LH技术经验积累和适应症逐步扩大,LH逐渐用于治疗原发性大肝癌,其临床价值日益受到重视,但其手术效果和安全性与开腹肝切除术相比,是否具备显著优势尚未明确,需大量研究论证探讨[4]。本研究回顾性分析LH对84例原发性大肝癌的手术资料进行分析,重点探讨LH的近期疗效及其对血清肿瘤标志物的影响。
1 资料和方法
1.1 一般资料
收集2016年1月至2019年12 月在蚌埠医学院第一附属医院肝胆外科接受肝切除术治疗的84例原发性大肝癌患者。纳入标准:(1) 符合《原发性肝癌诊疗规范》[5]中“原发性大肝癌”的诊疗标准,且经手术病理证实;(2) 肝功能Child-Pugh分级A级;(3) 术前经科室专家风险评估,术前情况良好,能耐受全麻和肝切除手术;(4) 术前详细沟通,告知可供术式选择及不同术式的潜在风险及收益,手术均在患者及家属知情同意下进行,具体术式选择以患者意愿为准;(5) 相关资料保留完整。排除标准:(1) 合并肝内外转移、肝癌破裂、需要联合其他脏器切除;(2) 存在其他恶性肿瘤疾病。依据患者术式意愿分为LH组(n=43)和开腹组(n=41)。两组原发性大肝癌患者的基线资料比较,差异无统计学意义(P>0.05)。见表1。
1.2 方法
手术均在气管插管吸入和静脉复合全身麻醉下进行,术前30 min预防性使用第二代头孢抗生素,手术均由科室肝切除术经验丰富的医师操作。(1) LH组:脐上穿刺建立CO2气腹,气腹压维持12~14 mmHg,脐下穿刺孔作为观察孔。根据术前检查的肿瘤位置及大小,在上腹作3~4个操作孔。确定Trocar位置后进行腔镜探查,观察肝脏形态、肝硬化程度和肿瘤位置、大小、边界等情况,观察腹盆腔有无肿瘤侵犯和种植,若发现肿瘤破裂、侵犯临近脏器或肝内转移,需中转开腹。严格按照无瘤原则,明确肿瘤切除范围和肝静脉走向,并在肝表面用电凝钩进行标记。超声刀沿着标记线逐步离断肝实质,完整切除肿瘤,确保足够切缘,双极电凝止血。用无菌蒸馏水反复冲洗肝断面,观察有无渗血和胆汁渗漏,若出现活动性出血或胆汁渗漏,用4-0或5-0无损伤Prolene线缝扎即可,并再次确认。延长脐下孔切口,将标本置入标本带并取出,常规放置引流管。(2) 开腹组:进行常规开腹肝切除术,于肋缘下行反“L”形切口,全方位腹腔拉钩充分暴露术野,仔细探查腹腔内情况,观察腹腔内有无血性积液、肝硬化程度、肿瘤位置、肿瘤大小及有无肝内转移、肿瘤破裂和其他脏器受累等情况,并明确肿瘤切除范围并标记。术中游离肝周韧带,预置肝门阻断带,超声刀离断肝实质前分离结扎病变肝动脉、门静脉和相关的肝胆管,对肝断面的处理同LH组,留置引流管。两组术后均给予抗感染、护肝、营养支持和镇痛等常规对症处理,术后2~3 d拔除尿管,腹腔引流管拔除时机根据引流量和性状决定。术后1~3个月内门诊至少复查1次,院后3个月后可每半年复查1~2次。
1.3 观察指标
两组手术近期疗效依据手术指标、术后恢复情况、术后并发症评价,手术指标包括手术时间、术中出血量、输血率、R0切缘以及切缘;术后恢复指标包括首次下床活动时间、腹腔引流管留置时间和住院时间;术后并发症采用常用的Clavien分级系统[6],肝切除术后Clavien I~II级并发症如难治性腹水、肺部或其他部位感染,Clavien≥III级的并发症为严重并发症,如反应性胸腔积液、肝断面包裹性积液、胆汁漏、呼吸衰竭、单个或多个器官功能障碍甚至死亡。总并发症率=发生并发症的患者例数/总例数×100%。术前和术后30 d均检测血清甲胎蛋白(alpha fetoprotein,AFP)、癌坯抗原(carcino embryonic antigen,CEA)、糖类抗原199(carbohydrate antigen 199,CA199)水平,晨起空腹采血并收集血清样本,-20 ℃冷存,由检验科人员采用电化学发光全自动免疫分析仪(罗氏Cobas E411型)检测。
1.4统计学分析
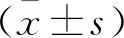
2 结果
2.1 两组原发性大肝癌患者基线资料比较
LH组和开腹组原发性大肝癌患者性别、年龄、肿瘤直径、乙肝表面抗原(+/-)、肿瘤部位以及有无肝硬化方面比较,差异无统计学意义(P>0.05)。见表1。
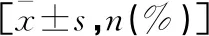
表1 两组原发性大肝癌术前基线资料比较
2.2 两组围手术期相关指标比较
LH组和开腹组手术时间、术中出血量、输血率、R0切缘和切缘比较,差异无统计学意义(P>0.05);LH组术后首次下床活动时间、引流管留置时间、住院时间均短于开腹组,差异有统计学意义(P<0.05)。见表2。
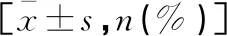
表2 两组围手术期相关指标比较
2.3 两组术后并发症发生率比较
LH组术后总并发症率低于开腹组,差异有统计学意义(P<0.05)。见表3。

表3 两组术后并发症比较[n(%)]
2.4 两组血清AFP、CEA、CA199水平比较
LH组和开腹组术后30 d复查时血清AFP、CEA、CA199水平均较术前明显下降(P<0.05);两组术后30 d血清AFP、CEA、CA199水平比较,差异无统计学意义(P>0.05)。见表4。
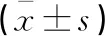
表4 两组血清AFP、CEA、CA199水平比较
3 讨论
我国是肝癌高发地区,肝癌患者人数占世界肝癌人数的50%以上[7]。LH是直径≤5 cm肝癌患者的首选术式,且不受肿瘤部位的影响,使外科治疗更加微创和精细化。但肝癌起病隐匿,早期多无明显或特异性症状,使得临床确诊收治的原发性大肝癌患者占大多数,且常伴有慢性乙型肝炎和肝炎后肝硬化,引起肝功能不同程度受损,易引起门静脉高压和凝血功能异常[8],导致患者对手术的耐受程度下降,手术操作难度和并发症风险随之增加。随着LH技术经验积累,原发性肝癌伴肝硬化接受LH也能取得良好手术效果,术中注重保护腹壁侧支循环和淋巴管道,术后腹水和感染发生率降低,安全性明显提高。近些年,LH开始逐渐用于原发性大肝癌患者,但其临床应用仍存在一定疑虑和挑战,可供采纳参考的循证偏少,其临床价值需进一步论证和总结。
本研究收集的肝癌患者肿瘤直径5~10 cm,与目前LH技术水平和肿瘤学特点有关,直径>10 cm肿瘤多存在明显的占位效应,侵犯周围组织,手术操作安全风险高,且难以达到R0切缘,是LH治疗的严格禁忌证,故予以排除。本研究显示,LH组和开腹组手术时间、术中出血量、输血率和R0切缘方面接近,但术后首次下床活动时间、引流管留置时间、住院时间均少于开腹组,表明LH和开腹切除术均能达到满意的肿瘤切除效果,但LH在促进患者术后恢复方面有明显优势,这与先前的报道[9-10]相符,原因与二者手术创伤程度有关,开腹术需行20~25 cm的反“L”型切口,手术创伤大,疼痛明显,早期下床活动困难,延长术后恢复时间。本研究显示,LH组术后总并发症率为18.60%,低于开腹组的36.59%,表明LH在减少手术并发症方面占优势,有利促进术后恢复和缩短住院时间。本研究由于纳入病例偏少和观察年限较短,未能观察二者的预后生存差异,存在着一定的不足之处。LH和开腹术对直径≤5 cm原发性肝癌患者的1年、3年和5年的总生存(overall survival,OS)和无复发生存期(progression-free survival,PFS)无明显影响,二者远期预后相当,但二者术式对原发性大肝癌患者远期预后有无显著影响尚不明确。有报道[11]指出,LH治疗直径5~10 cm原发性肝癌患者的3年OS、PFS分别为80.00%、66.67%,与开腹术79.31%、65.52%接近,提示二者的远期预后效果相当,但该报道例数偏少,且为单中心回顾性分析,还需后续多中心大样本研究进行探究。血清AFP、CEA、CA199是肝癌常用的肿瘤标志物,敏感性高,在肝癌疾病诊断、病情变化和手术疗效评估方面具有重要监测价值[12]。李少华等[13]指出,大肝癌患者接受射频消融术(radio frequency ablation,RFA)联合经皮肝动脉栓塞化疗(transcatheter arterial chemoembolization,TACE)后血清AFP、CA199水平显著下降。本研究也显示,两组术后30 d血清AFP、CEA、CA199水平均较术前明显下降,且组间比较差异无统计学意义,表明LH和开腹术的手术近期疗效均较好,均能有效稳定病情和改善预后。
LH治疗原发性大肝癌需注意以下几点:(1) 控制出血。术中腔镜超声仔细探查,明确肿瘤毗邻肝内血管和胆道的走行及解剖关系,避免离断肝实质过程中,因操作不当对主要管道结构造成误伤。术者利用腹腔镜的放大功能,根据肿瘤所在肝段,充分游离肝脏和解剖肝门,使预切除肝段充分显露,确保视野良好,便于及时发现和处理出血点。同时选择合适的肝血流阻断方法,解剖型肝切除术者选择区域性入肝血流阻断,非解剖性切除术者选择Pringle手法间歇性阻断。离断肝实质时无需阻断肝静脉,以免血液回流不畅,间接加重肝断面出血和影响术后肝功能恢复[14]。(2) R0切缘。无瘤原则是外科治疗肝癌的关键,为确保R0切缘,需借助影像学仔细检查,观察肿瘤部位和周围管道结构的解剖关系,术中在预留肝脏体积足够的前提下,选择大范围解剖性肝切除术,熟练操作,精细解剖,确保切缘阴性[15]。此外,操作者的经验水平是影响LH近期疗效的重要因素,相对开腹术而言,LH术操作更加精细,对解剖和风险预估处理要求更高,因此不断提供LH操作水平,术中控制出血和确保R0切缘,是LH手术成功的重要环节。
本研究不足之处在于样本量偏少,未能随访比较不同术式对患者远期预后的影响,再加上本研究系回顾性分析,难免存在一定的偏倚,后续研究需予以完善。总体而言,LH和开腹术治疗原发性大肝癌的手术效果相当,术后血清AFP、CEA、CA199水平均显著下降,但前者更加微创,患者术后恢复快,住院时间段,并发症发生率低,手术切口也更加美观,近期疗效占有明显优势。随着LH技术进步和临床经验积累,LH治疗原发性大肝癌的有效性、实用性和安全性均会进一步完善,使其成为临床治疗的首选术式方案。
