二甲双胍通过抑制Wnt/β-catenin信号通路对胃癌干细胞增殖和凋亡的研究
2021-06-18王冬梅冯永刚姚鸿萍
王冬梅,冯永刚,姚鸿萍
(西安交通大学第一附属医院药学部,陕西 西安 710061)
胃癌在全世界的患病及致死率较高,主要与患者术后肿瘤细胞发生转移及再复发有关,因此寻找安全有效的药物是目前临床防治胃癌及改善其预后的研究焦点[1-3]。胃癌干细胞作为胃癌细胞抗化疗、诱导肿瘤转移复发的根源,因此抑制胃癌干细胞增殖及诱导其凋亡才是治疗胃癌的关键[4]。Jung等[5]研究表明,人类表皮生长因子受体(human epidermal growth factor receptor 2,HER2)过表达可激活与胃癌干细胞相关的Wnt/β-catenin信号通路,进一步诱导胃癌细胞的侵袭及转移,说明胃癌干细胞的增殖、转移、凋亡等生物行为学机制与Wnt/β-catenin信号通路被激活密切相关。二甲双胍是临床上常用于治疗糖尿病的一线药物,具有防止肝脏糖异生、提高骨骼肌葡萄糖摄取率的作用[6-7]。研究[8-12]发现,二甲双胍在抗肿瘤细胞及肿瘤干细胞活性上具有重要价值。然而,关于二甲双胍通过作用Wnt/β-catenin信号通路来影响胃癌干细胞增殖、凋亡机制的研究鲜有报道。本研究对胃癌MKN-45细胞株分离培养并鉴定,并通过不同剂量二甲双胍分别处理,探究胃癌干细胞的增殖、凋亡及Wnt/β-catenin信号通路相关基因表达情况。
1 材料与方法
1.1 材料
人胃癌细胞株MKN-45 由武汉普诺赛生命科技有限公司提供;二甲双胍由美国Sigma-Aldrich公司提供;CCK-8试剂盒由日本Dojindo公司提供;RPMI-1640完全培养基、CD44+磁珠由北京诺为生物技术有限公司提供;兔抗CD44购自美国abcam公司;RNA提取试剂盒由Invitrogen公司提供;SYBR® Premix Ex TaqTM II试剂盒由宝生物工程有限公司提供;β-连环蛋白(β-catenin)、糖原合成酶激酶-3β (glycogen synthase kinase-3β,GSK-3β) 以β-actin引物交由Takara公司设计;BCA试剂盒由AmyJet Scientific公司提供;性别决定区Y框蛋白2(sex-determining region Y-box protein 2,SOX2,兔抗)、八聚体结合转录因子4(octamer-binding transcription factor4,OCT4,兔抗)、同源域蛋白(nanog homeobox,nanog,兔抗)和磷酸甘油醛脱氢酶(reduced glyceraldehyde-phosphate dehydrogenase,GAPDH,兔抗)由Cell Signaling Technology公司提供;ImageJ2x软件由National Institutes of Health公司提供;荧光显微镜由浙江湖州莱特科技有限公司提供(型号XSP-63X);PCR引物及PrimeScript RT试剂盒由宝日医生物技术公司提供;流式细胞仪由美国BD公司提供(型号FACSCalibur)。
1.2 方法
1.2.1 MKN-45细胞及其干细胞培养 将MKN-45细胞在含有10%胎牛血清RPMI-1640完全培养基中,于37 ℃、5%CO2培养箱中培养,待细胞贴壁后,取对数生长期MKN-45细胞胰酶消化,放于含无血清1640培养液(含有1%青霉素、20 μg/L碱性成纤维细胞生长因子、100 μg/L表皮细胞生长因子、1%N-2添加剂、2%B-27添加剂)的96孔超低吸附培养皿中培养,在倒置显微镜下定期观察悬浮球体细胞成型情况。并按照1∶3进行传代。
1.2.2 胃癌干细胞分选 取对数生长期MKN-45细胞,胰酶消化成单细胞悬液,细胞计数,细胞浓度1×107/mL,离心重悬,向其中加入20 μL CD44磁珠,4 ℃ 孵育15 min,冲洗离心取上清液,重悬后,将磁珠分选分离柱放置于磁珠分选器中,对从磁珠分选分离柱中流出的细胞(CD44-)进行收集,每次待柱内液体流尽时,予以缓冲液冲洗,收集总的流出液,将柱子卸下,与离心管相接,之后予以泵压,分选洗液细胞即为CD44+细胞[13]。胃癌干细胞分选分选成功标准[13]:通过分选前、后MKN-45细胞中CD44+含量变化情况来判断胃癌干细胞分选成功与否,具体方法如下:(1)免疫荧光法鉴定CD44+表达情况:取分选前及分选后MKN-45肿瘤细胞球,胰酶消化成单细胞悬液,种于6孔培养板(细胞浓度1×108/L),培养于10%胎牛血清RPMI1640培养基中,12 h后将细胞取出,弃培养液,PBS漂洗,丙酮室温放置10 min,PBS洗涤,用10%山羊血清于室温封闭0.5 h,弃血清,向其中加入CD44抗体(稀释1∶200),4 ℃过夜孵育,滴加荧光标记的相应二抗,室温避光孵育1 h,于荧光显微镜下拍照,图片中绿色荧光显示为含有CD44+的细胞。(2)为进一步对MKN-45肿瘤细胞球中CD44+含量进行定量分析,采用流式细胞术检测分选前及分选后CD44+胃癌干细胞比例:取分选前及分选后MKN-45细胞,胰酶消化成单细胞悬液,离心弃去上清液,PBS洗涤,加入CD44+抗体,冰上孵育1 h,离心弃去上清液,PBS洗涤,离心后,流用含有1%BSA的PBS重悬,于400目滤网中将细胞悬液过滤,置入流式管中,通过流式细胞仪检测分选前、后CD44+细胞所占比例,来判断CD44+细胞分选成功与否。
1.2.3 胃癌干细胞的鉴定 通过检测胃癌干细胞标记物SOX2、OCT4、Nanog表达情况进一步对1.2.2分选的MKN-45细胞干细胞特性进行鉴定。免疫印迹法鉴定肿瘤干细胞标记物(SOX2、OCT4、Nanog)的表达:提取悬浮MKN-45肿瘤细胞球和贴壁细胞中干细胞标记物SOX2、OCT4、Nanog的总蛋白。通过BCA试剂盒测定蛋白浓度。将提取的蛋白与上样缓冲液混合,95 ℃煮10 min、离心,10%聚丙烯酰胺凝胶电泳,转膜。室温下5%脱脂乳在TBST中封闭1 h,滴加一抗(1∶1 000稀释)SOX2、OCT4、Nanog和GAPDH 4 ℃孵育过夜,室温下磷酸盐缓冲液洗涤,加入相应的二抗37 ℃孵育l h,洗涤,化学发光试剂显影,蛋白印记图像用ImageJ2x软件分析,蛋白水平通过灰度值/GAPDH条带灰度值进行表示。
1.2.4 CCK-8检测各组MKN-45干细胞增殖活力 取第3代MKN-45干细胞,予以PBS清洗,进行胰酶消化,制成单细胞悬液。计数后,以每孔1×105/L细胞浓度接种于96孔板中,在培养箱孵育24 h,换液,分别向其中加入3中浓度的二甲双胍(0、1、5、10 mmol/L)溶液,培养24、48、72 h时,取出培养板,根据CCK8试剂盒说明书,加入10 μL CCK8继续培养2 h,在490 nm处读取吸光度值(OD),制作增殖曲线图。
1.2.5 流式细胞术检测MKN-45干细胞凋亡情况 取第3代MKN-45干细胞,予以PBS清洗,进行胰酶消化,制成单细胞悬液。以细胞浓度为1×1010/L接种于培养瓶中,常规培养1 d,换液,分别加入3中浓度的二甲双胍(0、1、5、10 mmol/L)溶液,培养24、48、72 h时,取出培养瓶,胰酶消化成单细胞悬液,离心分离去上清,收集细胞于离心管中,PBS洗涤,加1 mL预冷的70%乙醇,4 ℃固定,24 h后离心分离去上清,加1 mL预冷PBS,使细胞悬浮混匀;并加0.5 mL碘化丙啶予以染色,37 ℃避光孵育30 min,通过流式细胞仪于488 nm波长处测定MKN-45干细胞凋亡情况。
1.2.6 RT-qPCR检测MKN-45干细胞wnt/β-catenin信号通路相关基因表达情况 收集1.2.4中不同浓度二甲双胍处理的(24、48、72 h)MKN-45干细胞,通过RNA提取试剂盒提取细胞总RNA。按照PrimeScript RT试剂盒说明书将RNA逆转录为cDNA,逆转录体系10 μL。β-catenin、GSK-3β以β-actin作为内参,引物序列见表1。参照SYBR® Premix Ex TaqTM II试剂盒说明书进行PCR扩增预变性、变性、退火、延伸反应条件为:94 ℃ 5 min,94 ℃ 40 s,55~60 ℃ 40 s,72 ℃ 1min,40个循环,72 ℃再延伸10 min。予以2-ΔΔCt法进行数据分析。
1.3 统计学分析
2 结果
2.1 胃癌干细胞的培养及鉴定
胃癌细胞系MKN-45在无血清培养基7 d后形成各自的悬浮球体细胞(图1A);随着培养时间的继续延长,培养到15 d时肿瘤球体细胞排列致密,中心密度高,呈现肿瘤细胞富集(图1B)。免疫荧光检测结果显示,与胃癌干细胞分选前相比,分选后MKN-45肿瘤细胞球中CD44+(绿色荧光显示含有CD44+的细胞)数量增加(图1C、图1D)。进一步流式细胞术对CD44+定量显示,与胃癌干细胞分选前相比,分选后CD44明显富集,CD44+比例在MKN-45细胞中由5.70%富集至89.32%(图1E、图1F),提示CD44+细胞分选成功;免疫印迹结果显示,悬浮MKN-45肿瘤细胞球中肿瘤干细胞标志物SOX2、OCT4、Nanog蛋白高于贴壁细胞 (P<0.05)(图1G、图1H),提示悬浮球体细胞具有肿瘤干细胞特性。
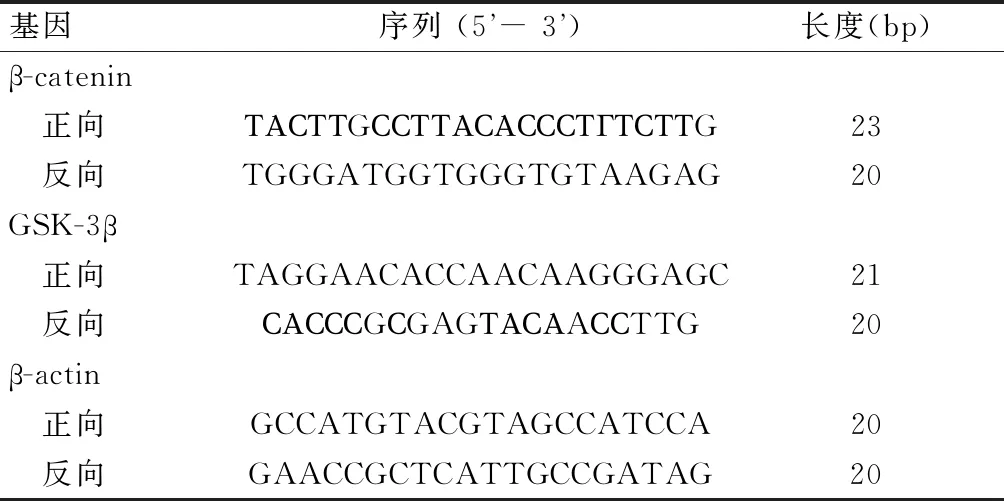
表1 引物序列
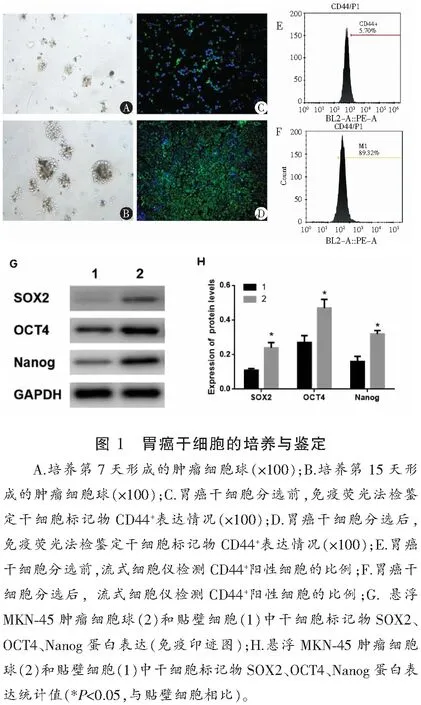
2.2 不同浓度二甲双胍对MKN-45干细胞增殖活力的影响
与未处理的MKN-45干细胞相比,经不同浓度(1、5、10 mmol/L)二甲双胍处理的MKN-45干细胞在48 h及72 h增殖能力下降 (P<0.05),且呈时间与剂量依赖性。见图2。
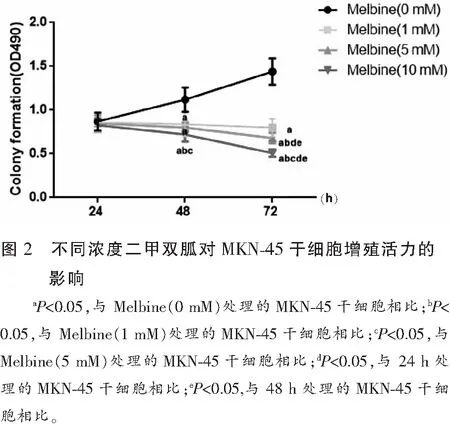
2.3 不同浓度二甲双胍对MKN-45干细胞凋亡情况的影响
与未处理的MKN-45干细胞相比,经不同浓度(1、5、10 mmol/L)二甲双胍处理的MKN-45干细胞随时间延长(48~72 h)及浓度增加,细胞凋亡率也随之增加(P<0.05),且呈时间与剂量依赖性。见图3。
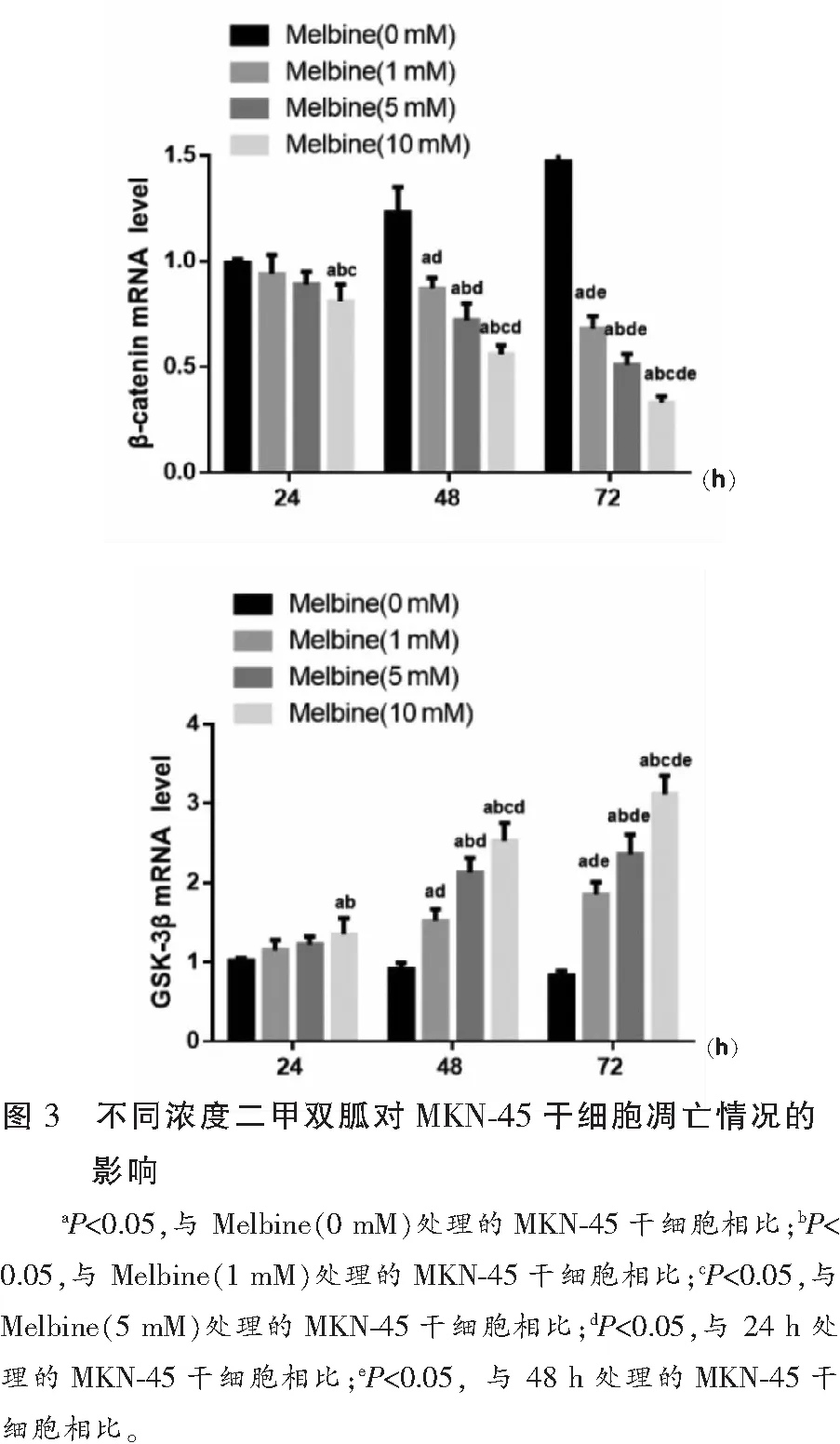
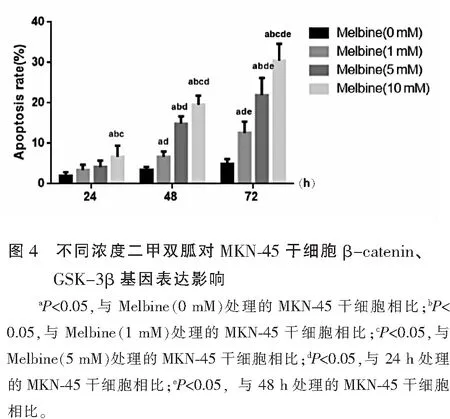
2.4 不同浓度二甲双胍对MKN-45干细胞β-catenin、GSK-3β基因表达影响
与未处理的MKN-45干细胞相比,随着二甲双胍处理浓度增加及处理时间的延长,MKN-45干细胞β-catenin mRNA表达呈下调趋势,GSK-3β mRNA表达呈上调趋势(P<0.05),且呈时间与剂量依赖性。见图4。
3 讨论
肿瘤干细胞在肿瘤组织中数量极少,具有较强的自我更新、多向分化及无限增值的能力殖。近些年来,越来越多的研究报道了在胃癌、结肠癌、乳腺癌、肝癌、肺癌等多种肿瘤中存在肿瘤干细胞[14]。已有研究[15-16]证实,胃癌干细胞在化疗药物的耐药方面显著强于普通胃癌细胞。因此,靶向胃癌干细胞已成为现阶段临床治疗胃癌新的方向。
本研究中胃癌细胞株MKN-45在超低粘附板中培养,在无血清培养基7 d后形成各自的球体细胞,培养15 d时肿瘤球体细胞排列致密,中心密度高,呈现肿瘤细胞富集。研究[17-18]显示,CD44+、SOX2、OCT4、Nanog是肿瘤干细胞中常见生物标记物,本研究通过检测肿瘤干细胞标记物来鉴定胃癌干细胞的培养及分选情况,免疫荧光显示,与分选前相比,胃癌干细胞分选后,CD44+表达增加,且流式细胞术也显示,分选后CD44+明显富集,CD44+比例在MKN-45细胞中由5.70%富集至89.32%,同时悬浮MKN-45肿瘤细胞球中肿瘤干细胞标志物SOX2、OCT4、Nanog蛋白高于贴壁细胞。进一步证实本研究胃癌干细胞分选成功,可成为靶细胞应用于二甲双胍抗胃癌作用机制的研究[19]。
二甲双胍是一种用于治疗2型糖尿病的临床药物,有研究[20]认为,该药对预防癌症的发生及降低癌症死亡风险具有促进作用,已有多项研究表明,二甲双胍可通过调控相关基因起到抑制肿瘤增殖及诱导肿瘤细胞凋亡的作用。Teufelsbauer等[20]报道发现,二甲双胍可通过间接介导人脂肪基质细胞的支持活性在乳腺癌中发挥抗癌活性。Gulati等[9]研究认为,塞来昔布联用二甲双胍可通过抑制局部粘着斑激酶(focal adhesion kinase,FAK)、n-钙粘蛋白和基质金属蛋白酶-9活性来抑制非小细胞肺癌细胞的迁移和侵袭。本研究CCK-8结果显示,与未处理的MKN-45干细胞相比,经过不同浓度(1、5、10 mmol/L)二甲双胍处理的MKN-45干细胞在48 h及72 h增殖能力下降,且呈时间与剂量依赖性,表明二甲双胍具有抗胃癌干细胞的增殖的活性,且与其剂量及作用时间成正比。同时本研究又对胃癌干细胞的凋亡机制进行了研究,结果显示,与未处理的MKN-45干细胞相比,经过二甲双胍处理时间的延长(48~72 h)及浓度增加,MKN-45干细胞凋亡率也随之显著增加,且呈时间与剂量依赖性,说明二甲双胍浓度越高,作用时间越长,其诱导胃癌干细胞的凋亡就越显著。分析原因可能与二甲双胍肿瘤抑制机制有关:(1)通过活化调控胰岛素/胰岛素样生长因1轴、腺苷活化蛋白激酶、阻滞肿瘤细胞周期以及调节能量代谢平衡等,进而起到直接抑制肿瘤细胞增殖的作用[21];(2)通过调节肠道菌群、激活免疫机制,并与各类抗肿瘤药物协同发挥间接抑制肿瘤的作用[21];(3)二甲双胍可能激活Wnt/β-catenin信号通路,调节细胞黏附分子如β-catenin,来调节肿瘤细胞的增殖迁移,并激活下游相关增殖凋亡基因(cyclilnD1、c-myc)表达,来调控肿瘤细胞的增殖凋亡[22]。
多项研究[23-24]已表明,Wnt/β-catenin信号通路参与胃癌细胞及其干细胞的增殖、凋亡等生物学作用机制,通过采用合适的治疗手段来抑制胃癌干细胞内Wnt/β-catenin信号通路的活性,已成为现阶段靶向治疗胃癌的重要研究方向。Fan等[25]研究报道,通过上调胃癌干细胞中miR-501-5p表达,可使Wnt/β-catenin信号通路被过度激活,进而介导胃癌干细胞样表型。Akrami等[26]研究报道,布洛芬可通过改变Wnt/β-catenin信号通路及其下游相关基因的表达等来抑制Wnt信号通路,起到抗胃癌干细胞增殖的作用。
Wnt/β-catenin信号通路中β-catenin因子分布于细胞膜,起到维持同型细胞间黏连的作用,其表达的上调可激活Wnt/β-catenin 信号通路,而GSK-3β作为Wnt/β-catenin信号通路的负调节因子,可与轴蛋白、结肠腺瘤息肉易感基因等形成复合体,促进β-catenin的磷酸化,致使β-catenin被水解[27]。然而现阶段关于二甲双胍通过介导Wnt/β-catenin信号通路来影响胃癌干细胞增殖凋亡机制的研究鲜有报道。本研究RT-qPCR检测结果显示,与未处理的MKN-45干细胞相比,随着二甲双胍处理浓度增加及处理时间的延长,MKN-45干细胞β-catenin mRNA表达呈显著下调趋势,GSK-3βmRNA表达呈显著上调趋势,提示二甲双胍对胃癌干细胞的增殖抑制及凋亡促进与抑制Wnt/β-catenin信号通路的激活有关。
综上所述,随着二甲双胍浓度的增加及作用时间的延长,可促进胃癌干细胞增殖活性的增强及凋亡率降低,其作用原因可能与抑制Wnt/β-catenin信号通路的激活有关。本研究存不足之处在于,由于实验条件有限,未直接验证Wnt/β-catenin信号通对胃癌干细胞增殖凋亡机制的影响,仅对二甲双胍影响胃癌干细胞增殖凋亡机制与Wnt/β-catenin信号通路关系可能性进行初步探讨,后续可就此问题进一步深入研究。
