响应面法优化西兰花种子中异硫氰酸酯的酶解制备工艺
2021-06-18弓小星王雅杰郝晓庆梁轩铭
杨 杜,弓小星,王雅杰,郝晓庆,梁轩铭,巩 强,苏 锐,
(1.中北大学化学工程与技术学院,山西太原 030051;2.山西省食品质量安全监督检验研究院,山西太原 030012)
癌症是威胁人类生命最严重的恶性疾病之一,治疗难度大,治疗癌症最有效的举措是控制其发生[1]。植物及其天然产物具有防癌抗癌的潜能,多项流行病学研究发现,多食用十字花科蔬菜,如西兰花、甘蓝、莴苣和白萝卜等,可以降低患癌的风险[2]。主要原因是十字花科植物中富含重要的次生代谢产物硫代葡萄糖苷(简称硫苷),硫苷在内源性黑芥子酶的催化下,先水解成D-葡萄糖和一种不稳定的糖苷中间产物,进一步转化为活性物质包括异硫氰酸酯(Isothiocyanates,ITCs)、硫氰酸盐、腈、亚硫腈或噁唑烷-2-硫酮等[3-5],如图1所示。其中ITCs是一类具有R-N=C=S结构通式的化合物,是II相解毒酶的天然诱导剂,可使致癌物质分解,起到抑制癌细胞增殖的作用,是天然的抗肿瘤活性物质[6-8]。除此以外,ITCs还具有抑菌、抗炎、抗氧化等多种生物学活性,可作为天然抑菌剂、食品添加剂、杀虫剂以及抗肿瘤药物等[9-10],具有广泛的应用价值。
目前,制备ITCs的方法主要有化学合成法和酶法,其中化学合成法步骤繁琐,合成率低,且对环境不友好[11]。酶法制备是利用十字花科植物中硫代葡萄糖苷-黑芥子酶这一系统[12-13],从植物体中提取ITCs,具有操作简单,环保安全,产率相对较高的特点。但酶解产物的形成取决于硫苷的结构以及酶解反应条件,主要包括酶解时间、温度、压力、pH和Fe2+的存在。Latte等[14]研究发现,当反应溶液pH为中性时,有利于前体GLS水解生成异硫氰酸盐,但在环硫特性蛋白(Epithiospecifierprotein,ESP)、Fe2+存在或在酸性条件下,酶解产物会形成大量的腈类等[15]。Yuan等[16]和Wu等[17]利用十字花科植物内源黑芥子酶,采用边水解边萃取的方法,考察了酶解时间、萃取时间以及金属离子对ITCs提取的影响。采用内源酶酶解制备ITCs工艺简单,但植物中内源黑芥子酶不能完全释放,导致酶解时间长,效率低。Guo等[18]预先制备黑芥子酶,采用添加外源酶水解的方式制备ITCs,酶活性高、酶解时间短,且ITCs的产率相对较高。同时,采用响应面的方法对pH、抗坏血酸和EDTA因素进行分析,结果表明,这三种因素对异硫氰酸盐的提取率有显著影响。只有在酶解条件适宜时,酶促反应动力学才会朝着有利于生成ITCs的方向进行。因此,优化硫苷的酶解浸提条件,是成功制备ITCs的关键环节。
ITCs的分析测定方法主要有:分光光度法和色谱法,其中色谱技术又包括高效液相色谱法[19]、气相色谱法和气质联用、液质联用。气相色谱-质谱联用[20]法结合了气相色谱和质谱的优点,具有灵敏度高、分析速度快等特点,可同时完成待测组分的分离和鉴定。
本研究以西兰花种子为原料,采用外源酶解的方法,制备ITCs。在单因素实验基础上,以酶解时间、酶解温度、酶解pH为自变量,以ITCs得率为响应值,利用Design-export10软件设计响应面实验,同时采用硫脲法和GC-MS作为ITCs的定量定性检测方法,优化ITCs的酶解提取工艺,为ITCs制备和综合利用提供参考依据。
1 材料与方法
1.1 材料与仪器
磷酸二氢钠 天津市科密欧化学试剂有限公司;碳酸氢钠 天津市北辰方正化学试剂厂;乙二胺四乙酸 天津市光复科技发展有限公司;抗坏血酸、二硫苏糖醇 阿达玛斯试剂有限公司;石油醚、二氯甲烷 上海泰坦科技股份有限公司;以上试剂 均为分析纯。
BGZ-240电热鼓风干燥箱 上海博迅医疗生物仪器股份有限公司;BJ-400粉碎机 上海拜杰实业有限公司;MYP11-2磁力搅拌器 常州方科仪器有限公司;TDL-5000dR冷冻离心机 上海安亭科学仪器厂。
1.2 实验方法
1.2.1 黑芥子酶的制备 取烘干、粉碎后的西兰花种子,过60目筛,石油醚脱脂三次,真空抽滤,得到西兰花种子粉末,至锥形瓶中备用。另取新鲜的芥菜籽,加入液氮粉碎,过60目筛,并脱脂处理,加入0.2 moL/L的磷酸缓冲液,超声振荡20 min,4000 r/min下冰浴离心30 min,并经硫酸铵分级沉淀,透析得粗黑芥子酶液,冷冻干燥,得黑芥子酶粉末。参照Li等[21]的方法,以黑芥子硫苷酸钾为底物,测得制备的粗酶液酶活为1.267 U/g。
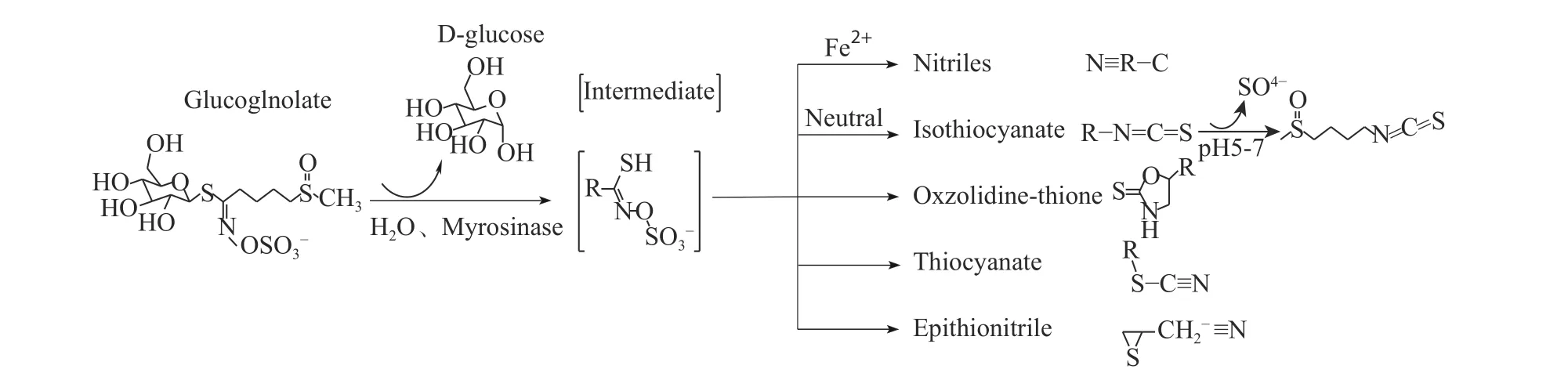
图1 硫苷酶解过程Fig.1 Hydrolysis of glucosinolates schematic
1.2.2 ITCs提取工艺 向西兰花粉末中加入用磷酸盐溶解的粗黑芥子酶,并加入0.2%的抗坏血酸,在一定温度下,酶解一定的时间,酶解结束后,加入一定量的二氯甲烷浸提液,室温浸提2 h,之后离心取下层浸提液,测ITCs提取率。
1.2.3 单因素实验
1.2.3.1 酶量对ITCs提取率的影响 以脱脂西兰花种子粉末为底物,称取5等份,每份0.2 g,按照1.2.1的方法提取ITCs,在酶解时间为3 h,酶解温度为30 ℃,浸提料液比为1:20 g/mL,pH为6.5的条件下,按酶与底物的质量比(1:5、1:4、1:3、1:2、1:1)混合,考察粗酶用量对ITCs提取率的影响。
1.2.3.2 酶解时间对ITCs提取率的影响 以脱脂西兰花种子粉末为底物,称取5等份,每份0.2 g,按照1.2.1的方法提取ITCs,在酶与底物的质量比为1:3,酶解温度为30 ℃,pH为6.5,浸提料液比为1:20 g/mL的条件下,考察不同酶解时间(2、3、4、5、6 h)对ITCs提取率的影响。
1.2.3.3 酶解温度对ITCs提取率的影响 以脱脂西兰花种子粉末为底物,称取5等份,每份0.2 g,按照1.2.1的方法提取ITCs,在酶与底物的质量比为1:3,酶解时间为3 h,pH为6.5,浸提料液比为1:20 g/mL的条件下,研究在不同酶解温度(30、35、40、45、50 ℃)对ITCs提取率的影响。
1.2.3.4 酶解pH对ITCs提取率的影响 以脱脂西兰花种子粉末为底物,称取5等份,每份0.2 g,按照1.2.1的方法提取ITCs,当酶与底物的质量比为1:3,在酶解时间为3 h,酶解温度为30 ℃,浸提料液比为1:20 g/mL的条件下,研究在不同pH(4.5、5.5、6.5、7.5、8.5)对ITCs提取率的影响。
1.2.3.5 浸提料液比对ITCs提取率的影响 以脱脂西兰花种子粉末为底物,称取5等份,每份0.2 g,按照1.2.1的方法提取ITCs,在酶与底物的质量比为1:3,酶解时间为3 h,酶解温度为30 ℃,pH为6.5的提取条件下,研究了不同浸提料液比(1:10、1:15、1:20、1:25、1:30 g/mL)对ITCs提取率的影响。
1.2.4 响应面试验 在单因素实验基础上,进行响应面实验[22],采用Box-Behnken模型[23-24],选取酶解时间(A)、温度(B)和pH(C)影响显著的因素为自变量,以ITCs提取率为相应值(Y),设计三因素三水平响应面实验,共17个处理组,各因素编码值见表1。
1.2.5 硫脲法测ITCs提取率 参考NY1956-2008标准[25],取0.2 g脱脂后的西兰花粉末,加40 mg粗芥子酶和2.0 mL pH 7.0缓冲溶液,旋涡混合器充分混合,35 ℃下酶促反应2 h。加2.5 mL二氯甲烷,用旋涡混合器混合均匀,在室温下振荡0.5 h,4000 r/min下离心20 min。取6 mL 80%氨乙醇于具塞试管,用微量进样器,取离心管下层有机相50 μL,加入到装有80%氨乙醇的具塞试管中,盖上塞。旋涡混合均匀,将具塞试管放入水浴锅,50 ℃下加热0.5 h,取出具塞试管,冷却至室温。用紫外分光光度计,10 mm石英比色皿测定光密度值,测定波长分别为235、245、255 nm,同时测定试样空白溶液。

表1 响应面试验因素水平设计Table 1 Factor level design of response surface test
试样中异硫氰酸酯的提取率(X)以每克干样中异硫氰酸酯的毫克数(mg/g)表示,按以下公式计算:
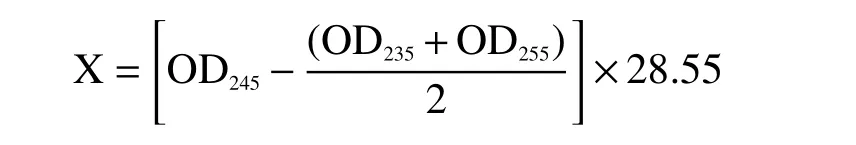
式中:OD235、OD245、OD255分别代表试样在245、235、255 nm处的光密度值。
1.2.6 GC-MS对酶解产物的分析 将含有ITCs的酶解提取产物,用有机滤膜过滤,注入GC进样口进行分析。GC/MS使用7890A气相色谱仪结合5975C Plus质谱仪分析。色谱条件如下[23]:气相色谱柱(30 m×250 μm×0.25 μm,HP-5MS)采用氦气为运载气体,恒定流速为1.5 mL/min;进样口温度为300 ℃,进样量为10 μL,分流比20:1。色谱柱升温程序为:50 ℃保持2 min,然后以10 ℃/min升至230 ℃,保持5 min;再以30 ℃/min升至300 ℃,保持15 min;质谱条件:EI离子源温度:230 ℃;接口温度:250 ℃;四极杆温度:150 ℃;EI能量:70 eV;扫描范围m/z:50~240。
定性定量方法:样品采用GC-MS进行分析,通过MSDCHEM化学工作站对采集的数据进行处理,并根据各个化合物的分子离子峰、特征碎片离子以及色谱保留时间等与NIST11谱库数据进行匹配,最终确定酶解产物的化学成分。并使用峰面积归一化法计算硫代糖苷酶解产物中各组分的相对含量。
1.3 数据处理
实验数据表示为三次重复(n=3)的平均值±标准差(SD),使用origin8对数据进行处理和绘图。
2 结果与分析
2.1 单因素实验结果
2.1.1 酶量对ITCs提取率的影响 酶与底物的质量比对ITCs提取率的结果如图2所示,当酶与底物的质量比为1:3时,ITCs的提取率达到最大。当底物量远大于酶的用量时,酶解反应速度与酶的用量呈正比关系,此时由于酶的用量不足,西兰花粉末中的糖苷底物不能完全得到水解,从而导致产物ITCs得率较低;增加酶的用量,底物能够得到充分的释放,但继续增加酶的用量,底物与酶的反应已达到饱和,产物的量也不再增加,而且还会增加后续浸提溶液的体积,综合考虑其最佳的酶与底物的质量比为1:3。
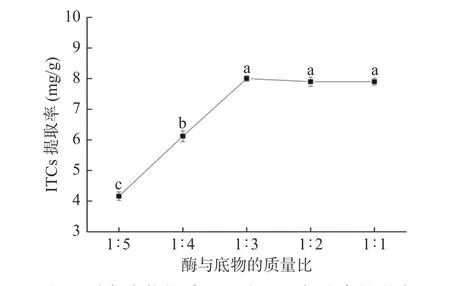
图2 酶与底物的质量比对ITCs提取率的影响Fig.2 Effect of the mass ratio of enzyme and substrate on the extraction rate of ITCs
2.1.2 酶解时间对ITCs提取率的影响 酶解时间对ITCs提取率的结果如图3所示,ITCs的提取率随着酶解时间的延长显著增加(P<0.05),在酶解时间为4 h时达到最高。但酶解时间超过4 h之后,ITCs提取率有所下降。酶解时间较短时,底物硫代葡萄糖苷没有得到充分酶解,产物ITCs得率较低;而在4 h之后,由于ITCs在水溶液中稳定性较差,发生加成反应而生成其他副产物。因此,随着酶解时间的延长,反而会使产物得率有所下降。综上,确定酶解最佳时间为4 h左右。
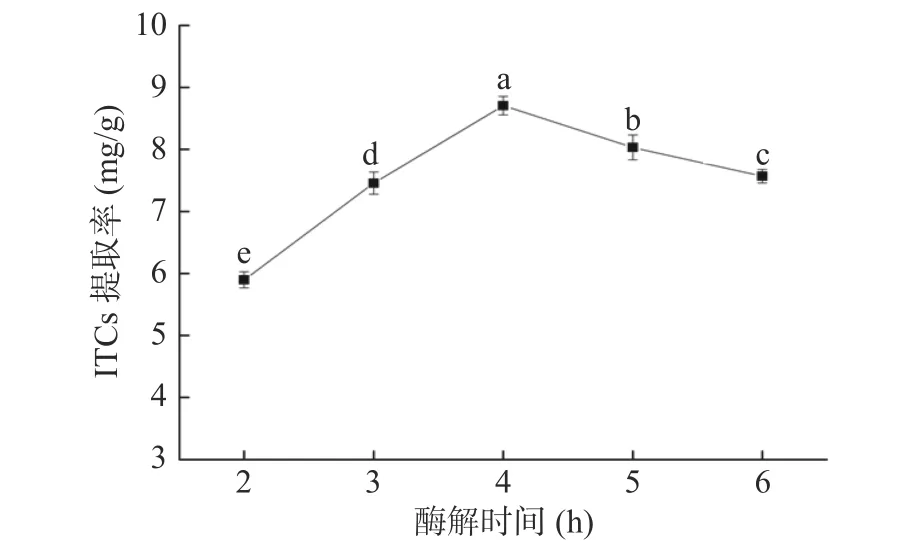
图3 酶解时间对ITCs提取率的影响Fig.3 Effect of enzymolysis time on extraction rate of ITCs
2.1.3 酶解温度对ITCs提取率的影响 不同酶解温度对ITCs提取率的影响如图4所示。当酶解温度低于40 ℃时,ITCs的提取率随温度的升高而逐渐增加。当酶解温度升高到40 ℃时,酶解产物ITCs提取率最高。之后,随着酶解温度的进一步升高,酶解产物急剧减少。因此,40 ℃为黑芥子酶的最适酶解温度。黑芥子酶是较为耐热的酶,适当提高酶解温度,有利于酶活力的提高;但酶解温度过高时,也会使酶钝化,降低酶的催化效率,同时还会影响酶解产物的稳定性。
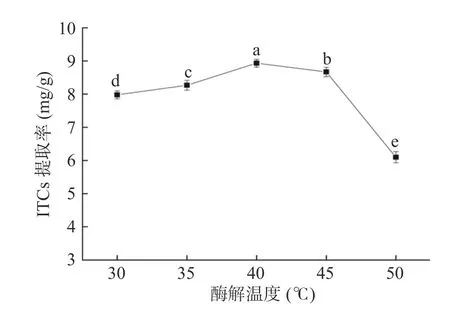
图4 酶解温度对ITCs提取率的影响Fig.4 Effect of enzymolysis temperature on extraction rate of ITCs
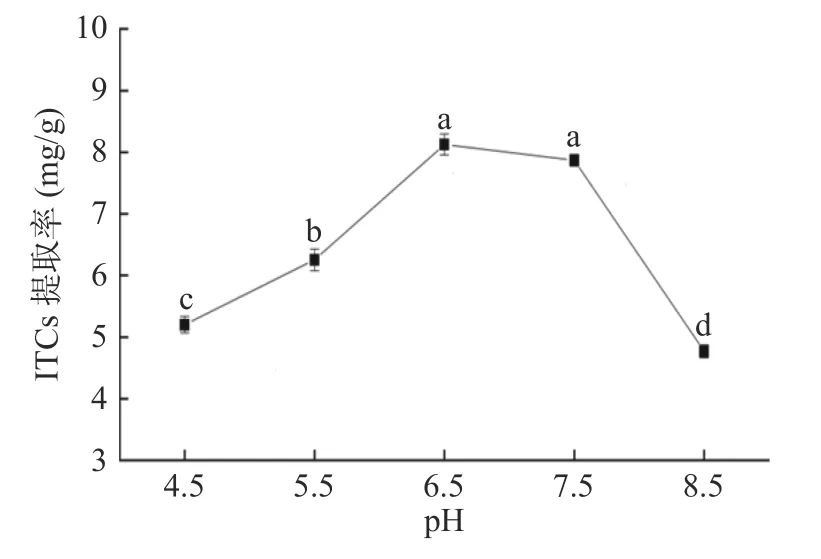
图5 不同pH对ITCs提取率的影响Fig.5 Effect of different pH value on extraction rate of ITCs
2.1.4 不同pH对ITCs提取率的影响 不同pH对ITCs提取率的影响如图5所示,pH是影响酶解效率的主要因素之一,不同的pH条件会影响酶解产物的类型。根据杨瑛洁等[5]研究,在中性条件下其前体硫代葡萄糖苷的酶解产物主要为ITCs,在有Fe2+或pH<5.0存在下,降解产物则以腈类为主。本实验结果也表明,酶解反应pH在4.5时,ITCs的提取率最低。而随着反应pH的增加,ITCs的提取率表现为先增后降的趋势,当pH为6.5时,ITCs的提取率最高,为最佳酶解反应pH。从本实验结果可以看出,ITCs受pH的影响较大,酶解反应中溶液pH过酸或过碱都会影响酶的活力、催化效率以及酶解反应进程,因此,选择pH5.5、6.5、7.5进行后续响应面试验。
2.1.5 浸提料液比对ITCs提取率的影响 不同的提取料液比对ITCs提取率的影响,如图6所示。当浸提料液比为1:20 g/mL时,ITCs的提取率最高,当浸提料液比为1:10~1:20 g/mL的范围内时,浸提液的量不足以萃取出全部的ITCs,提取率较低;浸提料液比过高时1:30 g/mL,不仅增加了缓冲液的用量,也没有有效提高ITCs的提取得率。因此,确定最佳浸提料液比在1:20 g/mL左右。
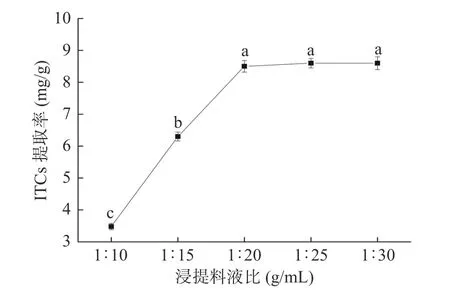
图6 浸提料液比对ITCs提取率的影响Fig.6 Effect of solid-liquid ratio on extraction rate of ITCs
2.2 响应面试验优化结果分析
2.2.1 响应面试验分析 从单因素实验结果可知,酶解时间、温度、pH对ITCs的提取率影响更为显著,因此选取这三个酶解因素作为响应面实验因素进行优化。根据Box-Bohnken中心组合设计原理,设计三因素三水平的响应面分析试验,17个实验组结果如表2所示。
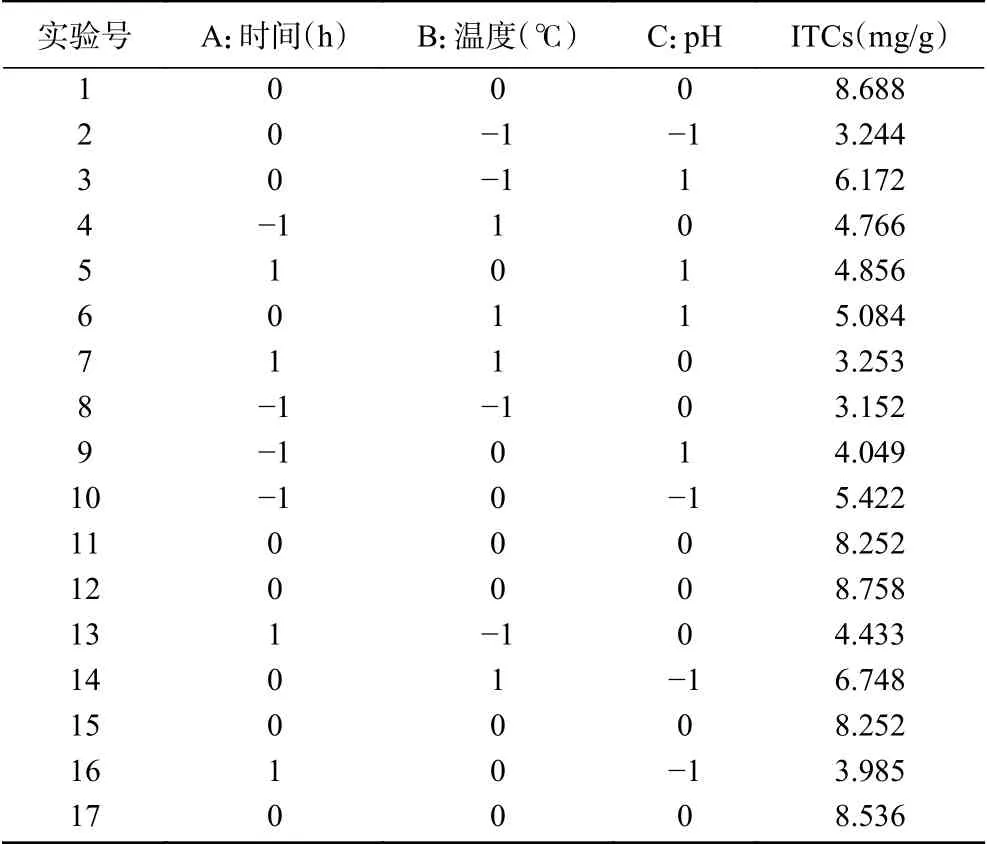
表2 响应面试验数据Table 2 Response surface experimental data
2.2.2 二次回归方程模拟及方差分析 用DesignExpert 9.0软件对表2中的实验结果进行分析后得到二阶响应表面模型方程:

对回归方程进行方差分析,结果如表3所示,显著性结果以P值表示,模型显著性检验P<0.05,表明该模型具有统计学意义。失拟项用来表示所用模型与实验拟合的程度,即二者差异的程度,失拟项P=0.0703>0.05,表明失拟不显著。模型决定系R2=0.9835,说明该模型拟和程度良好,实验误差小,该模型能够较好地描述各因素与响应值之间的真实关系。模型的校正决定系数R2adj=0.9624,说明该模型能解释约96%响应值的变化;
t检验和P值用于确定每个因素对ITCs提取率产生的影响。P值用作检查每个系数显着性的工具,数值越小,相应系数的显著性就越强。从表3中可知,二次项A2、B2、C2和交互项BC对ITCs的提取率均呈极显著性影响(P<0.01),交互项AB、BC呈显著性影响(P<0.05),三个因素对指标影响大小顺序为B>A>C。
利用上述回归方程确定最佳提取工艺条件:酶解时间3.95 h,酶解温度44.6 ℃,pH 6.52,在此条件下,进行验证试验,重复三次,ITCs提取率为8.36 mg/g,回归模型预测理论ITCs提取率为8.51 mg/g,验证值略低于预测值,其相对误差为1.80%,因此回归方程是可用的。
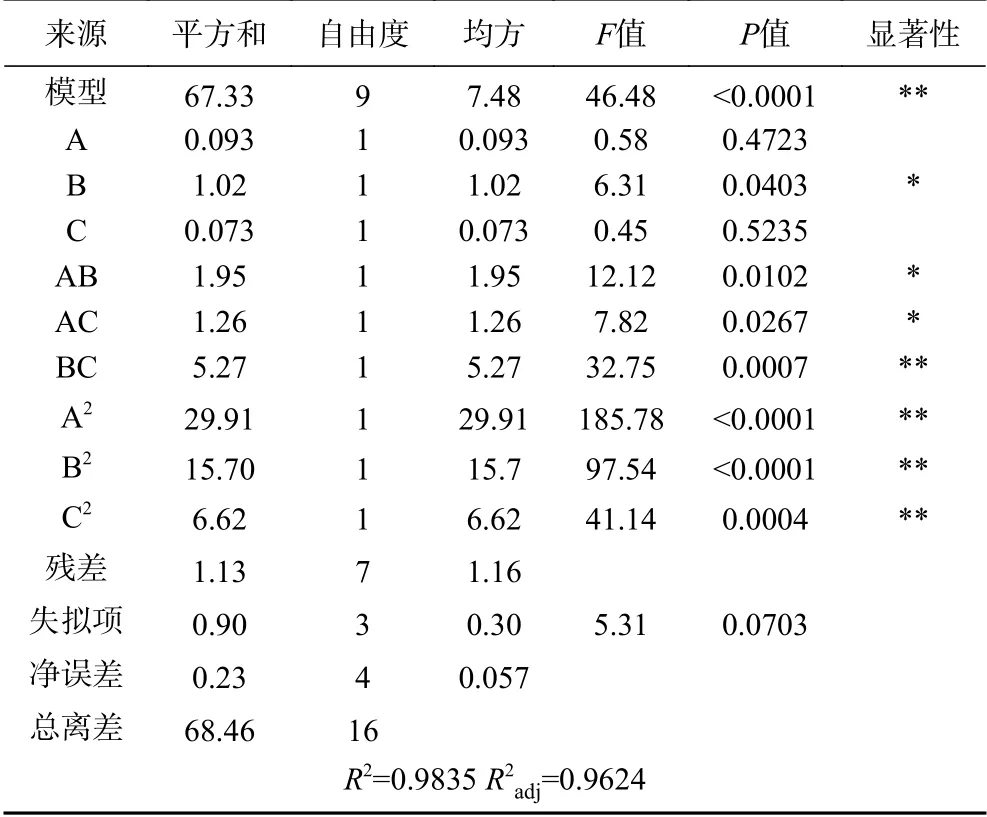
表3 模型的方差分析Table 3 Anova analysis for the response variables
2.2.3 各因素交互作用分析 回归方程显示,各因素之间存在着一定的交互作用,图7~图9的响应面图反映了各因素在酶解过程中对响应值的影响,其投影为等高线图。响应面图坡度的陡峭程度直观地反映了各因素对响应值的影响,结果与表3中交互项的显著性一致。
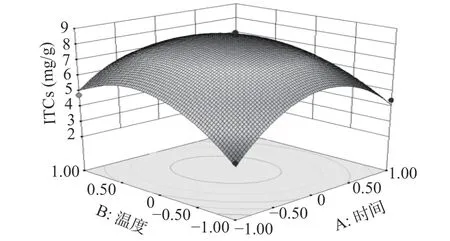
图7 Y=f(A,B)的响应面Fig.7 Responsive surface plot Y=f(A,B)
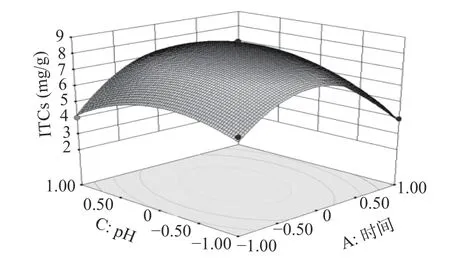
图8 Y=f(A,C)的响应面Fig.8 Responsive surface plot Y=f(A,C)
图9 Y=f(B,C)的响应面Fig.9 Responsive surface plot Y=f(B,C)
2.3 酶解产物的GC-MS分析结果
通过GC-MS分析了最佳酶解条件下制备的ITCs样品。选择峰面积作为总ITCs提取相对含量的分析信号,并将MS谱图与NIST标准质谱库进行比对,谱库检索结果匹配度达95%以上的物质中,鉴定出5种酶解相关化合物,分别是4-(甲硫基)丁腈、1-异硫代氰酸丁酯、萝卜硫腈、噁唑烷硫酮、萝卜硫素,整理见表4。其中,异硫氰酸酯类主要活性物质萝卜硫素在7.42 min被检测到,其得率也最高。从图10和图11可以看出,该活性产物的质谱图与NIST谱库中萝卜硫素的谱图(图12)吻合,其特征峰72、160与谱库中萝卜硫素的匹配度达98%以上,本实验检测结果也与Gu等[15]的研究结果是一致的。
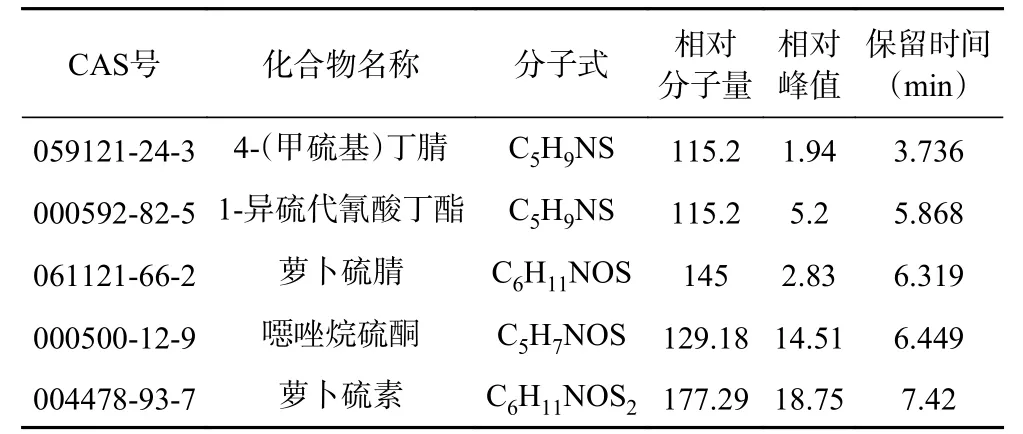
表4 GC-MS测定结果Table 4 GC-MS measurement results
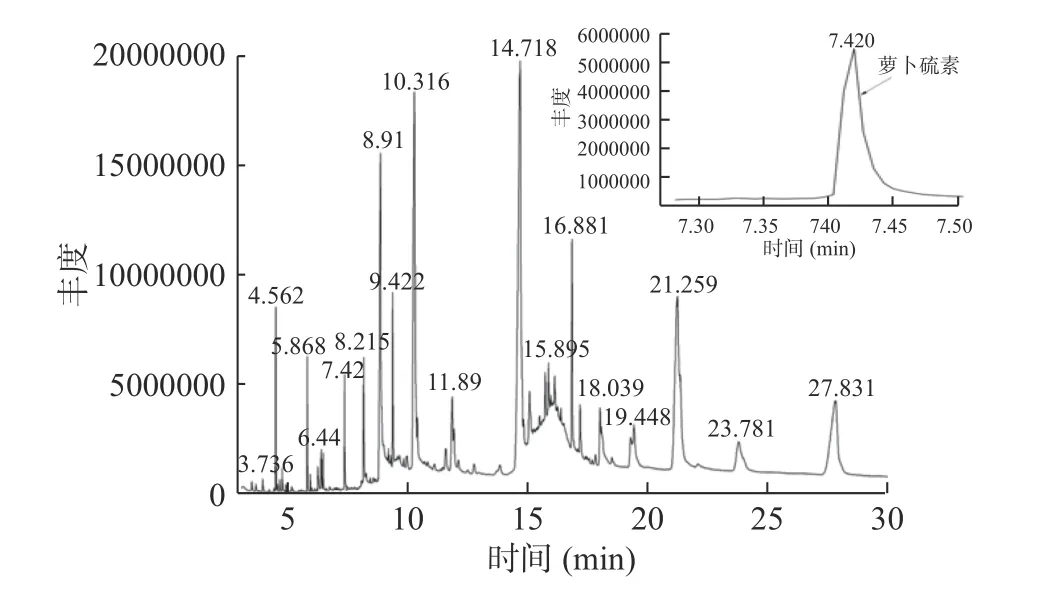
图10 GC-MS总离子流图Fig.10 GC-MS total ion current diagram
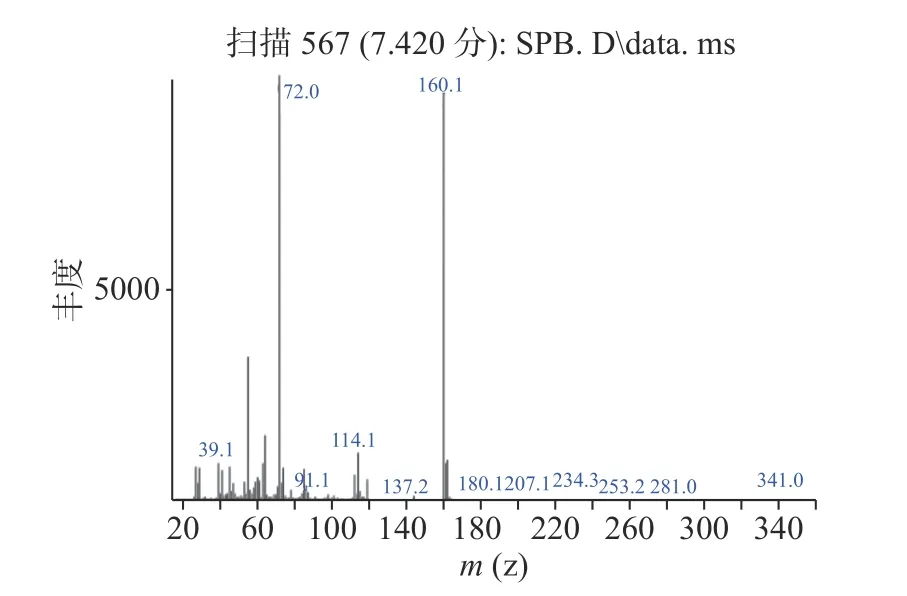
图11 保留时间7.42 min的质谱图Fig.11 Mass spectrum at retention time 7.42 min
3 结论
通过单因素和响应面试验研究了各因素对ITCs提取率的影响,综合考虑各方面的因素,最终确定西兰花种子中ITCs的最佳酶解提取条件:最适pH为6.52,酶解温度为44.6 ℃,酶解时间为3.95 h,ITCs的理论提取率为8.51 mg/g,经实验验证ITCs的提取率为8.36 mg/g,其相对误差为1.8%。在此基础上,对酶解产物进行了GC-MS分析,鉴定出异硫氰酸酯类相关化合物共五种,分别为有4-(甲硫基)丁腈、1-异硫代氰酸丁酯、萝卜硫腈、噁唑烷硫酮、萝卜硫素,其中目标产物萝卜硫素的相对含量最高,表明该工艺条件用于西兰花种子中异硫氰酸酯的提取是可行的,对于进一步研究、应用、开发ITCs相关产品具有现实意义。
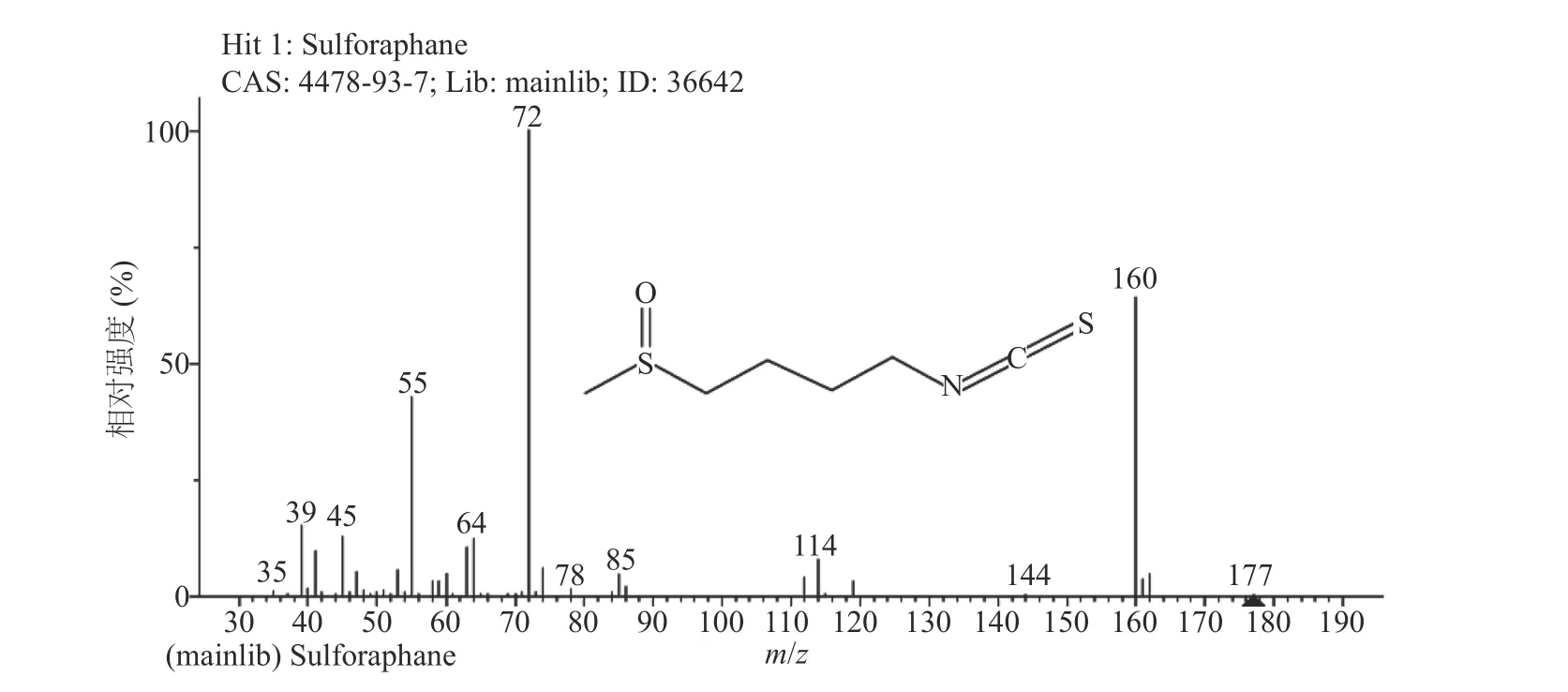
图12 NIST谱库中的萝卜硫素谱图Fig.12 Mass spectrogram of sulforaphane in the NIST library
