两种低钠咸味剂腌制大黄鱼片的贮藏品质比较
2021-06-18吴燕燕陶文斌暴伊芮赵永强王悦齐
吴燕燕,陶文斌,2,赵 娜,陈 茜,2,暴伊芮,4,赵永强,王悦齐
(1.中国水产科学研究院南海水产研究所,农业农村部水产品加工重点实验室,广东广州 510300;2.上海海洋大学食品学院,上海 201306;3.大连周水子机场海关,辽宁大连 116033;4.大连海洋大学食品科学与工程学院,辽宁大连 116023)
大黄鱼是我国养殖产量最大的海水鱼类,2019年产量达22.6万吨[1]。养殖大黄鱼富含蛋白质(17.16%)和脂肪(11.16%),高蛋白、高脂肪极易造成品质衰变,因而大黄鱼鱼肉的贮藏和加工尤为重要[2]。目前,养殖大黄鱼主要以食盐腌制加工和冷冻贮藏为主[3]。腌制是我国传统鱼类保藏方式,具有保藏期长且赋予产品独特风味的品质[4]。传统腌制通常采用高盐度腌制,虽然进一步延长了保藏期,但产品高盐高钠,过多食用易导致人体心血管疾病[5],不利于机体健康。所以减盐加工势在必行,探究低钠盐来的轻度腌制方式有一定意义[6]。目前以大黄鱼腌制加工的黄鱼鲞产品,主要采用冷冻贮藏的方式,这制约了其流通及销售,而采用冷藏、微冻结合真空包装、气调包装能够更有效的延长水产品的保藏期[7-9],同时也拓宽了水产品流通及销售渠道。
微冻保鲜是介于冷冻和冷藏之间的一种保鲜技术,其温度通常在-5~0 ℃,而此温度带是水产品冷冻过程中需快速通过的最大冰晶生成带,能够较大程度上地维持鱼肉的外观和新鲜度,延长保鲜期;气调包装(Modified atmosphere packaging,MAP)是将一种或几种气体按某种比例混合后替换食品包装袋中的空气以达到抑菌的目的技术[10],其有延长产品的保鲜期的作用,但是会对产品的汁液流失率造成一定的不良影响;真空包装通过对食品包装袋进行抽真空使食品所处环境中的氧气含量大量减少,从而达到抑制蛋白质、脂肪的氧化及微生物生长的目的,其具有延长食品保质期且方便运输、节约空间的优点。
本文以实验室开发的低钠咸味剂A和B[11],轻度腌制处理大黄鱼,并分别采用普通包装、真空包装和气调包装,考察其在冷藏(4 ℃)和微冻(-3 ℃)贮藏期间的品质变化,从而探明开发的低钠咸味剂是否适合腌制大黄鱼,以及获得最合适的包装方式和贮藏条件,为其在大黄鱼及其他鱼类的应用提供技术参考。
1 材料与方法
1.1 材料与仪器
鲜活养殖大黄鱼500~600 g 福建省宁德市金盛水产有限公司;食盐 广州盐业公司;酵母提取物(Yeast Extract,YE) 湖北武汉安琪酵母股份有限公司;氯化钾、葡萄糖酸钠、壳聚糖 食品级,广州馨之味食品配料有限公司。
DZ500/2D真空包装机 温州新泰包装机械厂;MAP-D400复合气调保鲜包装机 苏州森瑞公司;Sunrise-basic Tacan型酶标仪 瑞士TACAN公司;KjeltecTM2300蛋白自动分析仪 丹麦FOSS公司;CEM MARS5高压高通量微波消解装置 美国CEM有限公司;Agilent 7900电感耦合等离子体质谱仪 美国安捷伦公司。
1.2 实验方法
1.2.1 样品制备 将鲜活加冰运到实验室的大黄鱼去鳞、去内脏,沿背脊取鱼片,用清水冲洗干净后,沥水[11]。
1.2.1.1 分组 第一组(对照组)采用7.5%的氯化钠进行腌制;第二组(低钠咸味剂A)采用实验室开发的低钠咸味剂(氯化钠3.52%、氯化钾3.09%、葡萄糖酸钠0.60%)腌制[11];第三组(低钠咸味剂B)采用实验室开发的低钠咸味剂(氯化钠3.52%、氯化钾3.09%、葡萄糖酸钠0.60%、酵母提取物(Yeast extract,YE)0.30%、壳聚糖1.48%)腌制[11]。
1.2.1.2 腌制方法 将食盐、低钠咸味剂A、低钠咸味剂B根据鱼质量按比例称重后,分别溶于水中,再将鱼片按不同组别放入对应处理液中,腌制2.5 h;腌制温度为(4±1) ℃。
1.2.1.3 贮藏条件 将腌制好的大黄鱼片分别进行普通包装(regular packaging,RP,作为对照组)、真空包装(vacuum packaging,VP)及气调包装(modified atmosphere packaging,MAP),其中气调包装使用的包装袋为尼龙材质,通入的气体及比例为N2:CO2=1:3[8]。
将包装好的大黄鱼片分别在4及-3 ℃贮藏。在4 ℃贮藏的样品每2 d随机取3片鱼片进行指标测定,-3 ℃贮藏的样品每4 d随机取3片鱼片进行指标测定,每个指标平行测定3次,最后结果取平均值。
1.2.2 菌落总数的测定 根据GB 4789.2-2016《食品微生物学检验-菌落总数测定》进行[12]。
1.2.3 汁液流失率的测定 汁液流失率△M按照公式(1)计算:
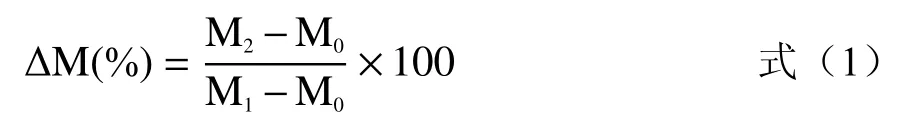
式中:M0:包装袋的重量,g;M1:包装袋、汁液和鱼肉的重量,g;M2:包装袋和汁液的重量,g。
1.2.4 pH的测定 根据GB 5009.237-2016《肉与肉制品 pH测定》进行[13]。
1.2.5 感官评定 大黄鱼片腌制完成后,将其蒸熟并进行感官评定。感官评定小组由10位接受过专业感官培训的人组成,以鲜鱼片为对照,对产品的外观、异味、滋味、质地四方面进行评价,总分为20分,评价标准如表1所示[14]。
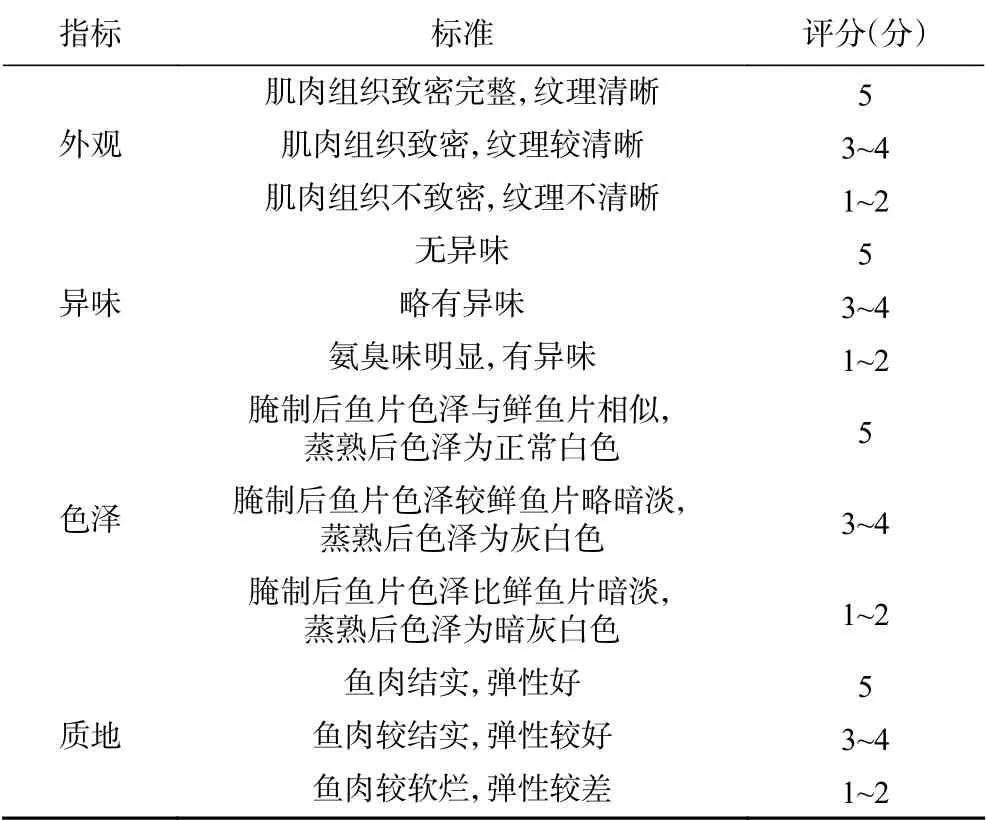
表1 感官评定标准Table 1 Sensory evaluation standard
1.2.6 硫代巴比妥酸值(TBARS)的测定 称取5.00 g鱼肉,并加入25 mL三氯乙酸溶液(7.5%,0.1%EDTA-2Na),常温振摇30 min,用双层滤纸进行过滤,收集滤液。取5 mL滤液加入5 mL 2-硫代巴比妥酸溶液(0.02 mol·L-1),并在沸水浴条件下保温40 min后冷却至室温,随后加入5 mL三氯甲烷,振摇5 min后静置,静置后的溶液出现分层后,测定上清液在532 nm处的吸光值,以蒸馏水代替上清液作为空白对照。丙二醛(malondialdehyde, MDA)用以表征TBARS的含量,丙二醛的含量通过绘制1,1,3,3-四乙氧基丙烷标准曲线进行标定计算得出,单位mg/kg[15]。
标准曲线的绘制:准确吸取每相当于丙二醛10 μg的标准溶液0.0、0.1、0.2、0.3、0.4、0.5、0.6 mL(相当于丙二醛含量为0、1、2、3、4、5、6 μg),置于纳氏比色管中,加水至总体积为5 mL,加入5 mL TBA溶液,然后测定上清液在532 nm处的吸光值,并将结果绘制成标准曲线,标准曲线方程为Y=0.1951x-0.1271 (R2=0.9972)。
1.2.7 挥发性盐基氮(TVB-N)的测定 根据国标GB 5009.228-2016《食品中挥发性盐基氮的测定》中的方法进行[16]。
1.3 数据处理
用Excel 2016软件处理数据,用Origin 9.0作图,再用SPSS 22统计分析软件对各参数进行显著性差异分析。
2 结果与分析
2.1 两组低钠咸味剂腌制大黄鱼片在4 ℃贮藏过程中的品质变化分析
2.1.1 菌落总数的变化 4 ℃条件下低盐腌制大黄鱼片在贮藏期间菌落总数的变化如图1所示。贮藏期间所有鱼片的菌落总数随贮藏时间的增加呈上升趋势。无论哪种包装方式,采用低钠咸味剂处理均优于对照组,而低钠咸味剂B腌制的大黄鱼贮藏期间菌落总数变化明显低于低钠咸味剂A和对照组。从包装方式来看,菌落总数的变化快慢依次是普通包装>真空包装>气调包装。以二级品鲜大黄鱼的细菌指标不超过5 lg CFU/g为基准[17]。
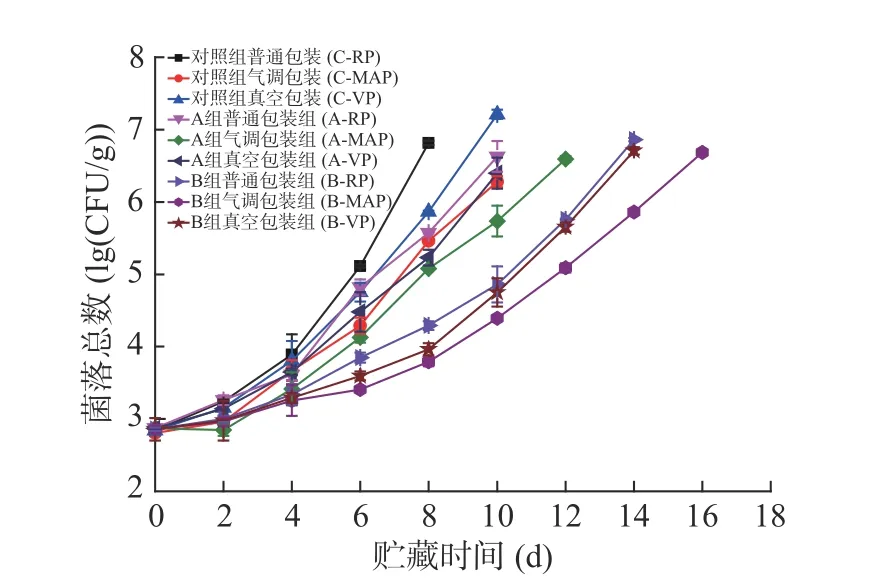
图1 腌制大黄鱼片在4 ℃贮藏过程中菌落总数的变化Fig.1 Changes in the total number of colonies of pickled yellow croaker fillets during storage at 4 ℃
分析表明,低钠咸味剂A、B、对照组达到菌落总数临界值的时间:普通包装分别为6.5、10.5和6 d,真空包装分别是7.5、11和6.5 d,气调包装分别是8、12和7 d。气调包装的鱼片贮藏天数更长,说明气调包装的气体环境对微生物的生长起到一定的抑制效果。低钠咸味剂B贮藏过程品质变化较缓慢,主要是与配方中含有能够抑菌的壳聚糖有关[18];因此,低钠咸味剂B腌制的大黄鱼片采用气调包装方式能够使鱼片菌落总数最低,最大限度的延长鱼片的贮藏时间。
2.1.2 汁液流失率的变化 鱼肉在贮藏过程中蛋白质发生不可逆的水解,因而鱼肉组织变得更加松散,细胞组织内的水分流出,造成汁液流失,而流失的汁液能够为微生物提供良好的生存环境,从而加快了鱼肉的腐败进程。因此,通过观察汁液流失率的变化可以判断鱼肉的品质状况[19-20]。从图2中可以看出,贮藏期间所有鱼片的汁液流失率虽然都是随贮藏时间的增加而增加,但普通包装的鱼片汁液流失率明显最低;而采用气调包装的鱼片汁液流失率最高。气调包装的鱼片处于较高浓度的CO2中,CO2溶解于鱼肉表面导致pH降低,对蛋白质的持水能力造成不利影响,因而出现渗出液[21]。本研究中气调包装使用的CO2体积占总体积的四分之一,浓度较高,因而气调包装组的鱼肉汁液流失率最高,该结果与孙丽霞[8]的结果一致。而真空包装的方式会对鱼片进行挤压,鱼肉细胞组织结构因为腌制而出现损伤,因此在真空的压力作用下汁液流失更严重,从而比普通包装的高。从结果来看,含有较高浓度CO2的气调包装造成的汁液流失比真空包装挤压鱼肉造成的汁液流失更严重。采用低钠咸味剂腌制处理的大黄鱼片,在相同包装条件下汁液流失率均低于对照组的,说明低钠咸味剂较食盐好,具有一定的保水能力,因而降低了水分流失。

图2 腌制大黄鱼片在4 ℃贮藏过程中汁液流失率的变化Fig.2 Changes in drip loss rate of pickled yellow croaker fillets during storage at 4 ℃
2.1.3 pH的变化 从图3中可以看出,各组鱼片的初始pH在6.7~6.9范围内,贮藏期间所有鱼片的pH随贮藏时间的增加呈现先下降后上升的趋势。这是因为鱼类死后首先呈现僵直状态,肌肉中的糖原由于无氧分解而产生乳酸,导致鱼肉的pH下降[22];鱼类死亡较长时间后,蛋白质在内源酶或微生物的作用下分解并生成含氮的碱性物质,导致pH上升[19]。从图3可见所有样品都是在贮藏前2 d pH大幅下降,而在第2~4 d时除了A组,其他各组下降趋势较平缓,在第4 d时除了B组的气调包装样品还未达到最低pH,其他各组都处于pH最低值,之后开始呈现上升趋势。B组的气调包装样品在第6 d才达到pH低点,随后呈现缓慢上升趋势。

图3 腌制大黄鱼片在4 ℃贮藏过程中pH值的变化Fig.3 Changes in pH value of pickled yellow croaker fillets during storage at 4 ℃
从包装方式来看,采用气调包装的鱼片pH变化较为其他包装组缓慢,这是由于气调包装的鱼片处于较高浓度的CO2中,CO2溶解于鱼肉表面导致pH降低。采用真空包装的鱼片pH高于普通包装的。在相同包装方式下,B组腌制的各鱼片的pH均低于A组及对照组,有研究表明壳聚糖的添加对鱼肉的pH没有显著性的影响[23],因而可能是B组配方中的YE的添加使鱼片pH下降。随着贮藏时间的增加,由于B组的鱼片中含有壳聚糖成分,能够有效抑制微生物的生长,从而腐败程度比其它两组的鱼片低,生成的含氮类的碱性物质相对较少,因而pH上升缓慢。
2.1.4 感官评分的变化 图4中可以看出,贮藏期间所有鱼片的感官评分均随贮藏时间的增加呈现下降趋势。采用低钠咸味剂咸制的大黄鱼感官评分都优于对照组,且随着贮藏时间的延长,低钠咸味剂B组的评分值下降速率较缓慢。从包装方式来看,感官评分下降速率快慢依次是普通包装>真空包装>气调包装,气调包装的鱼片贮藏时间最长,主要原因是气调包装的气体环境不仅对微生物的生长起到一定的抑制效果,而且也具有延缓鱼肉品质衰退的效果。第10 d时B组腌制的普通包装及真空包装的鱼片略有异味而气调包装的鱼片无异味,说明壳聚糖结合气调包装能够能够有效抑制微生物的生长,并延缓蛋白质及脂肪的氧化分解,起到保鲜作用。对照组中三种包装的鱼片在第8 d时出现异味,其中普通包装的鱼片呈现氨臭味。A组腌制的普通包装和真空包装的鱼片在第10 d时出现氨臭味,而气调组则出现轻微异味。各组样品在0~8 d内,影响感官评分的主要因素是气味和质地,而外观及色泽的变化不大。B组三种包装方式的感官评分在整个贮藏过程中处于较高水平,外观、气味及色泽的评分在整个贮藏过程中均较高,但质地评分较低,表现为鱼肉弹性较差。B组鱼片在第4 d之后均质地较软,鱼肉无弹性,但有研究表明添加壳聚糖能有效增加大黄鱼鱼肉的硬度[23],所以这可能是B组配方中YE作用的原因。使用低钠咸味剂B腌制的大黄鱼片,采用气调包装可在4 ℃贮藏期间好地保持产品的感官品质。
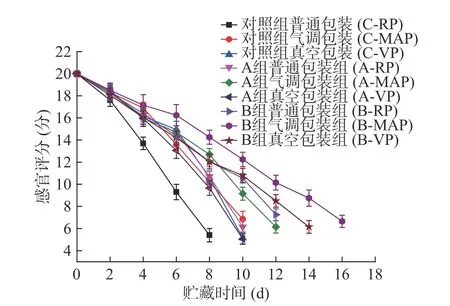
图4 腌制大黄鱼片在4 ℃贮藏过程中感官评分的变化Fig.4 Changes in sensory score of pickled yellow croaker fillets during storage at 4 ℃
2.1.5 TBARS值的变化 4 ℃贮藏期间所有腌制大黄鱼片的TBARS值均随贮藏时间的增加呈现上升趋势(图5)。采用低钠咸味剂腌制的大黄鱼片TBARS在贮藏期间均低于对照组。其中B组处理的样品无论哪种包装方式均是最低的,说明其能抑制贮藏期间鱼片氧化,这应该是跟配方中含有壳聚糖有关。据报道,壳聚糖的抗氧化作用取决于结构中含有的羟基和氨基两个基团与助氧化的金属离子进行络合后生成稳定物质,同时具有一定还原性能清除部分自由基,从而达到抗氧化的作用[24]。另有报道表明壳聚糖通过调控基因的表达提高机体清除自由基的能力达到抗氧化的目的[25],壳聚糖(3×104kDa)能够较好的防止脂肪氧化[26]。随着贮藏时间的增加,不同包装方式中TBARS值由高到低为普通包装>真空包装>气调包装。普通包装因含有少量氧气加速了脂肪氧化,其TBARS值增加相对较快。普通包装的B组鱼片TBARS值在贮藏前期偏低,贮藏后期快速升高,且贮藏后期中普通包装的B组TBARS值与真空包装的对照组相近。气调包装的B组鱼片TBARS值最低,说明气调包装的CO2和N2进一步延缓脂肪氧化[27],与瞿圣等[28]和Thais Cardoso Merlo等[29]得到的结论相似。综上,大黄鱼片用低钠咸味剂B腌制、采用气调包装、贮藏于4 ℃条件下品质最好。
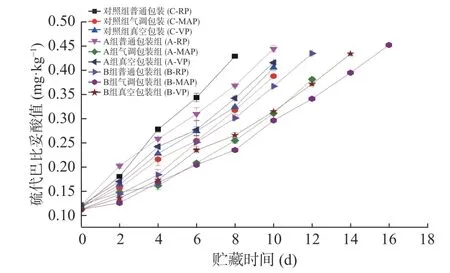
图5 腌制大黄鱼片在4 ℃贮藏过程中TBARS的变化Fig.5 Changes in TBARS of pickled yellow croaker fillets during storage at 4 ℃
2.1.6 TVB-N值的变化 在4 ℃贮藏期间所有鱼片的TVB-N值几乎随贮藏时间的增加呈现上升的趋势(见图6),其中对照组的各样品在第4 d之后均快速增加,而低钠咸味剂处理的各组样品则在贮藏期间呈现缓慢上升趋势,其中以B组优于A组。从包装方式来看,TVB-N值增加上升快慢依次是普通包装>真空包装>气调包装,说明气调包装的方式能降低蛋白质的分解速率,因而产生的碱性物质较少。以SC/T3101-2010《鲜大黄鱼、冻大黄鱼、鲜小黄鱼、冻小黄鱼》[17]中要求鲜大黄鱼中TVB-N值不得超过30 mg/100 g为临界值进行分析,低钠咸味剂A组、B组和对照组达到TVB-N临界值30 mg/100 g的时间是:普通包装分别是9、12和7 d,真空包装分别是9、12和8.5 d,气调包装分别是11、15和9 d。所以使用低钠咸味剂B腌制大黄鱼片,采用气调包装,可以有效延缓大黄鱼片在4 ℃贮藏期间TVBN值的增加,具有一定的保鲜作用。
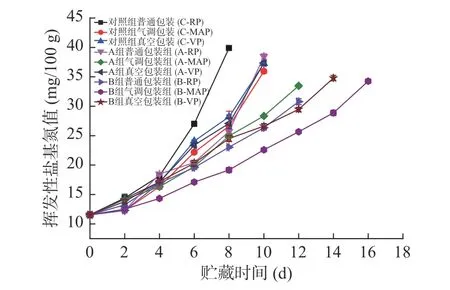
图6 腌制大黄鱼片在4 ℃贮藏过程中TVB-N值的变化Fig.6 Changes in TVB-N of pickled yellow croaker fillets during storage at 4 ℃
2.2 两组低钠咸味剂腌制大黄鱼片在-3 ℃贮藏过程中的品质变化分析
2.2.1 菌落总数的变化 从图7可以看出,在-3 ℃贮藏,各组鱼片的菌落总数随贮藏时间的增加呈上升趋势。其中B组各鱼片的菌落总数在整个贮藏过程中基本保持最低水平。从包装方式来看,菌落总数增长快慢依次是普通包装>真空包装>气调包装,低钠咸味剂A组、B组和对照组达到菌落总数临界不可食用值5 lg CFU/g的时间:普通包装分别是10、16和9 d,真空包装分别是15、18和16 d,气调包装分别是28、38和18 d。可见气调包装的鱼片贮藏天数更长,这与4 ℃的情况一致,也与吴燕燕等[14]低盐腌制罗非鱼的结果一致。使用低钠咸味剂B腌制的大黄鱼片,气调包装后在-3 ℃贮藏可更好的延长产品货架期。-3 ℃贮藏情况与4 ℃结果基本一致,不同之处在于-3 ℃贮藏的各组鱼片的贮藏时间基本比4 ℃条件下的更长,说明在微冻(-3 ℃)条件下微生物的活性受到一定程度的抑制,具有更好的抑菌保鲜效果。
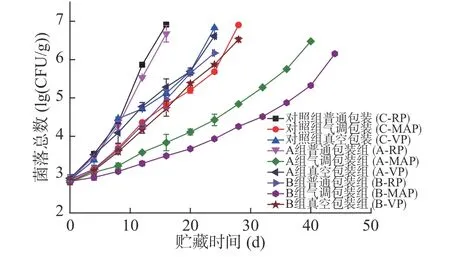
图7 腌制大黄鱼片在-3 ℃贮藏过程中菌落总数的变化Fig.7 Changes in total bacteria count of pickled yellow croaker fillets during storage at -3 ℃
2.2.2 汁液流失率的变化 从图8中可见-3 ℃贮藏期间,各组鱼片的汁液流失率趋势与图2相似也是呈上升趋势,也是普通包装的样品汁液流失率较低,其次是真空包装,最后是气调包装。采用低钠咸味剂腌制的鱼片无论哪种包装方式均优于对照组,说明低钠咸味剂能保水防止汁液流失,其中以低钠咸味剂B效果最好。-3 ℃贮藏过程各组鱼片结果与4 ℃时的基本一致,不同之处在于-3 ℃贮藏各组鱼片的汁液流失速度更慢。经过腌制后的鱼肉其细胞结构遭到破坏,且在微冻条件下组织中的部分水分被结冰使得细胞膜结构进一步被破坏,因此鱼肉的持水性减弱,鱼片的汁液流失率更高[30-31]。
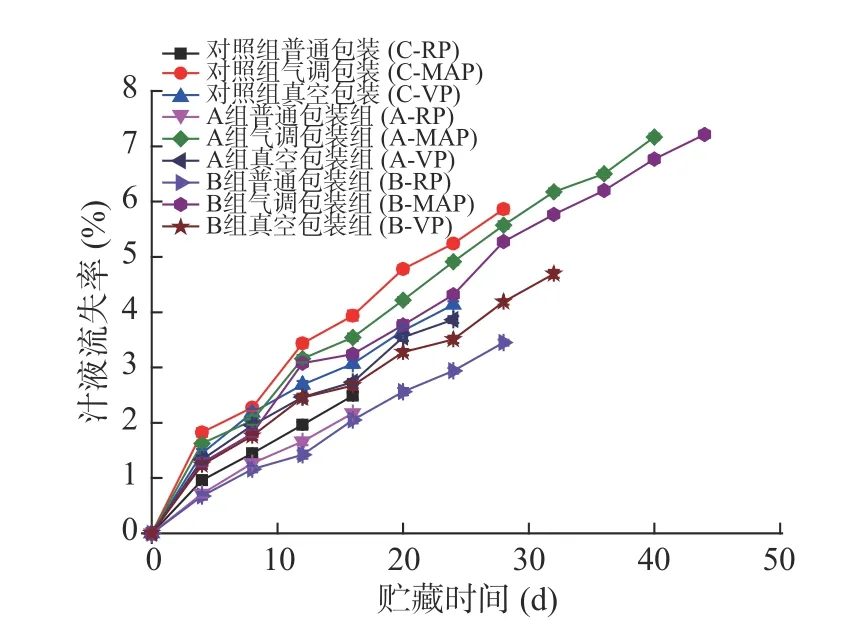
图8 腌制大黄鱼片在-3 ℃贮藏过程中汁液流失率的变化Fig.8 Changes in drip loss rate of pickled yellow croaker fillets during storage at -3 ℃
2.2.3 pH的变化 从图9中可以看出,各组鱼片的初始pH在6.6~6.8范围内,-3 ℃贮藏期间所有鱼片的pH在前面12 d都呈下降趋势,除了对照组普通包装时在第8 d达到pH最低之后开始呈快速上升。而低钠咸味剂气调包装各组则在第16 d达到pH最低,之后才开始缓慢上升。
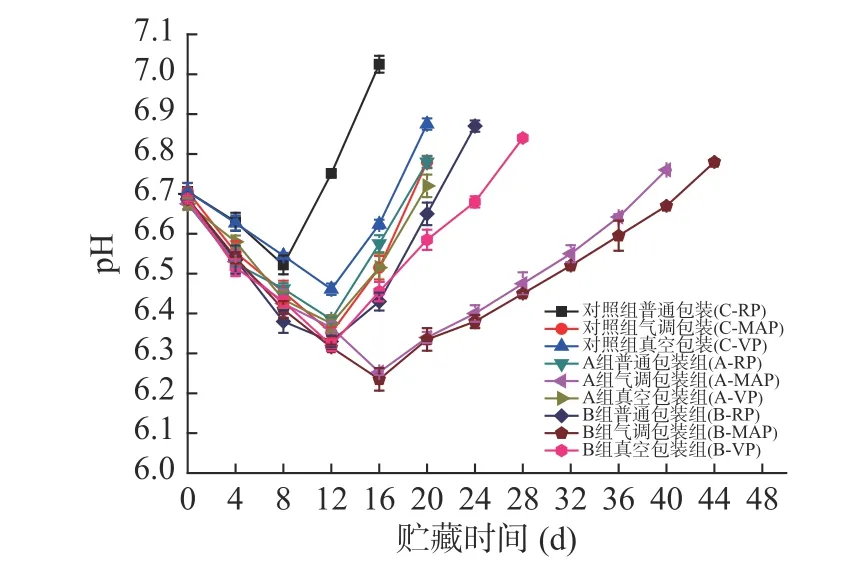
图9 腌制大黄鱼片在-3 ℃贮藏过程中pH的变化Fig.9 Changes in pH of pickled yellow croaker fillets during storage at -3 ℃
从包装方式看,不管哪种盐处理,均以气调包装大黄鱼片pH最低,其次是真空包装,普通包装的pH均较高。相同包装方式下,B组腌制的大黄鱼片pH较A组低,结果与4 ℃时的一致。图3与图9相比可以看出,二者均呈现先下降后上升趋势,而-3 ℃各组鱼片的pH变化速度更加缓慢,且达到最低值的的时间均更长。说明与4 ℃的贮藏温度相比,-3 ℃条件下相关内源酶类以及微生物的活性受到一定程度的抑制,因而延缓了pH的变化。在-3 ℃条件下,贮藏初期由于鱼肉中的酶活性受到抑制,影响了糖酵解及ATP的分解,使得pH的下降速度减缓;另外在微冻条件下进行贮藏的中后期,由于微生物受到抑制,影响分解蛋白质生成碱性物质,延缓了pH的上升[32]。随着贮藏时间的不断增加,A组和B组中气调包装鱼片的pH基本处于最低的水平,这是由于气调包装含有较高浓度的CO2,CO2溶解于鱼肉表面导致pH降低。同种包装方式的鱼片中,对照组的pH均较高,说明低钠咸味剂制能够使产品维持较低的pH,并较好地减缓产品pH的上升速度。
2.2.4 感官评分的变化 -3 ℃贮藏期间所有鱼片的感官评分值均随贮藏时间的增加呈现下降趋势(图10)。从包装方式来看,感官评分下降速率快慢分别是普通包装>真空包装>气调包装。在相同包装方式下,低钠咸味剂处理的各组鱼片在贮藏期间的感官评分下降速率低于对照组,且B组腌制的鱼片感官评分下降速率最慢。因此,使用低钠咸味剂B腌制能更有效的保持产品的感官品质,结果与4 ℃时的一致。图4与图10相比可见,-3 ℃各组鱼片的感官评分下降速度更加缓慢,并且鱼片在贮藏过程中出现异味或氨臭味的时间明显延长。说明该贮藏条件能较好保持产品品质,大大延长货架期。
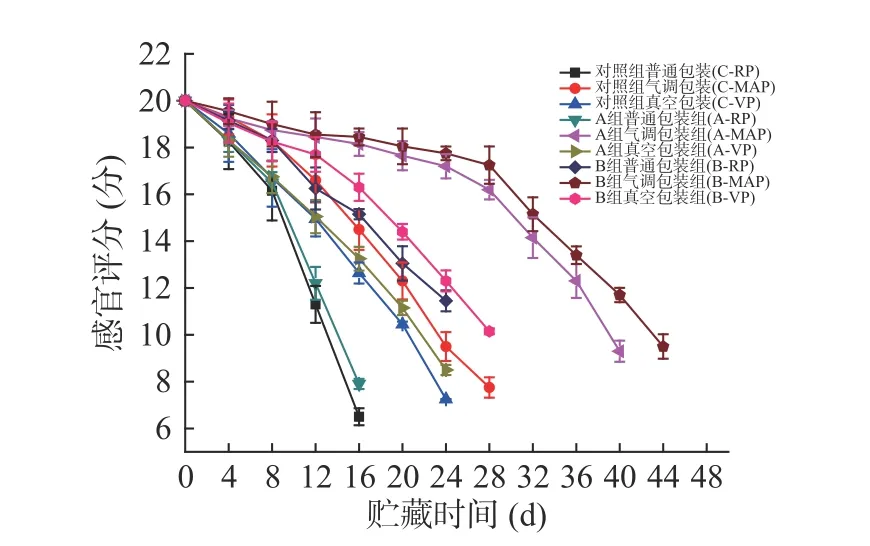
图10 腌制大黄鱼片在-3 ℃贮藏过程中感官评分的变化Fig.10 Changes in sensory score of pickled yellow croaker fillets during storage at -3 ℃
2.2.5 TBARS值的变化 贮藏期间大黄鱼肌肉内部发生化学反应,脂质别氧化成游离的脂肪酸和过氧化物等,导致鱼肉品质下降[33]。所有鱼片的TBARS值均随贮藏时间的增加呈上升趋势(图11),而低钠咸味剂处理的样品TBARS值较对照组低,且B组的TBARS无论哪种包装方式均较A组和对照组低。从包装方式来看,贮藏期间鱼片的TBARS值增加快慢次序是普通包装>真空包装>气调包装。因此,B组结合气调包装在-3 ℃贮藏能更有效延缓产品脂肪氧化的速率,结果与4 ℃时一致。图5与图11相比可以看出,-3 ℃各组鱼片的TBARS值上升速度更加缓慢,这可能是-3 ℃的微冻条件下延缓了在贮藏前期脂肪酸发生氧化的诱导期[8]。
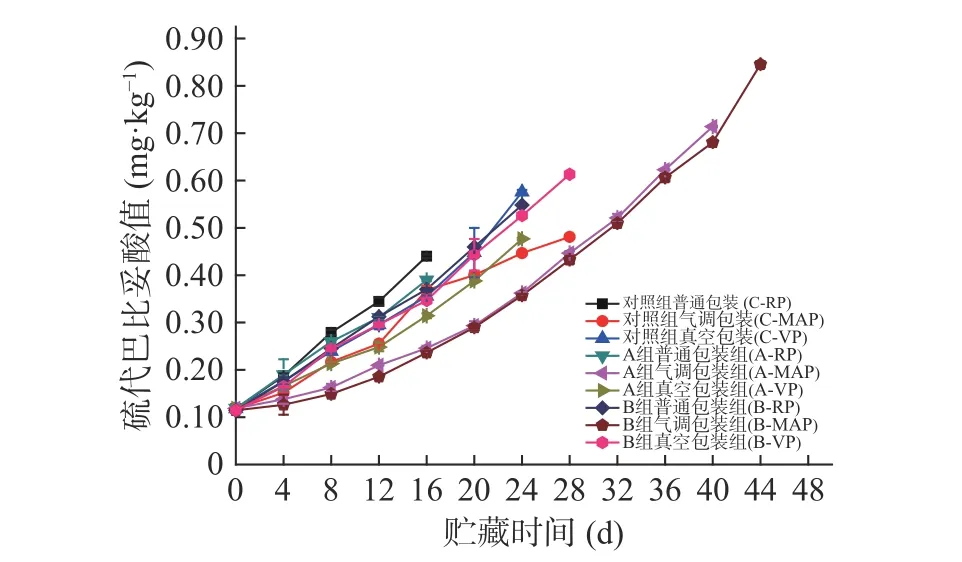
图11 腌制大黄鱼片在-3 ℃贮藏过程中TBARS的变化Fig.11 Changes in TBARS of pickled yellow croaker fillets during storage at -3 ℃
2.2.6 TVB-N值的变化 从图12中可以看出,-3 ℃贮藏期间所有鱼片的TVB-N值均随贮藏时间的增加呈现上升的趋势。从包装方式来看,普通包装的鱼片TVB-N值首先达到临界值,其次是真空包装的鱼片,最后是气调包装。使用低钠咸味剂A、B腌制的鱼片在相同包装方式下,TVB-N值上升速率均低于对照组,并且B组腌制的鱼片其TVB-N值上升速率最慢,达到临界值的时间最长。因此,使用低钠咸味剂B结合气调包装方式能更有效延缓产品脂肪氧化速率,结果与4 ℃时一致。图6与图12相比可以看出,-3 ℃各组鱼片的TVB-N值上升速度更加缓慢,说明与4 ℃的贮藏温度相比,-3 ℃的微冻条件下相关蛋白质内源酶类以及微生物的活性受到一定程度的抑制,因而生成的具有挥发性的碱性物质更少。低钠咸味剂A组、B组和对照组腌制大黄鱼片在-3℃贮藏期间达到TVB-N临界值30 mg/100 g的时间是:普通包装分别是15、22和13 d,真空包装分别是18、25和20 d,气调包装分别是38、42和25 d。
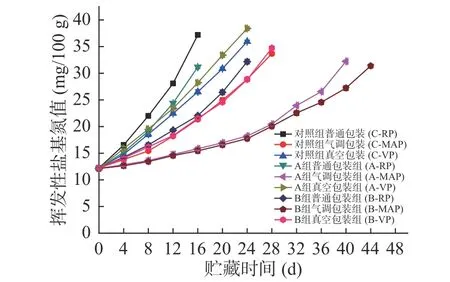
图12 腌制大黄鱼片在-3 ℃贮藏过程中TVB-N值的变化Fig.12 Changes in TVB-N of pickled yellow croaker fillets during storage at -3 ℃
综上所述,选用低钠咸味剂B腌制的大黄鱼片,采用气调包装后于-3 ℃贮藏,不仅能大延长鱼片货架期,并且能延缓鱼片的品质变化。
3 结论
以传统食盐作为对照组、用两种低钠咸味剂A和B分别腌制大黄鱼,经普通包装、真空包装、气调包装不同处理后,观察鱼肉在4和-3 ℃的贮藏过程中品质的变化。综合菌落总数值、TBARS值、TVB-N值、感官评分值、汁液流失率、pH各项指标分析可知:无论哪种包装方式或贮藏条件,相比传统食盐和低钠咸味剂A腌制的大黄鱼片,低钠咸味剂B腌制的大黄鱼片品质更高、货架期更长。另外,就不同包装方式而言,气调包装的效果优于真空包装和普通包装;就不同贮藏方式而言,-3 ℃贮藏条件效果优于4 ℃条件下的贮藏。
该研究为低钠咸味剂代替食盐用于轻度腌制大黄鱼及包装贮藏条件提供技术支撑,也为其他鱼类的腌制提供技术参考和依据,也为本课题组开发的低钠咸味剂B在其他鱼类加工中应用提供技术支撑,从而为鱼类加工食品工业减盐减钠生产提供技术支持和理论依据。
