响应面法优化银杏果酶菌协同发酵工艺
2021-06-16徐海祥王海蓝
姚 芳,张 伟,徐海祥,王海蓝,管 澎
(江苏农牧科技职业学院食品科技学院,江苏泰州 225300)
银杏果药食兼用,营养丰富,除含淀粉(60%)、蛋白质类(13%)、糖类(7%)、脂肪类(4%)外,还含有银杏黄酮、银杏酚、银杏内酯、银杏酸等特有的活性成分[1],在抗氧化、益智健脑、提高免疫力、抗衰老、抗菌[2-5]等方面具有一定的疗效,在功能食品领域具有巨大的发展潜力。
银杏蛋白是银杏果中重要的功能成分,据研究银杏果的抗氧化性与其水溶性蛋白含量有着密切关系[6-7],利用微生物与银杏果共发酵,提高活性成分含量是近年来研究的热点。研究表明[8-11]微生物可利用和代谢银杏中的成分,增加可溶蛋白、黄酮和内酯的含量。植物乳杆菌和酿酒酵母是发酵食品中常用的微生物,二者之间存在共生与互补关系[12-13]。已有采用发酵技术改变银杏叶中银杏酸含量[10-11]、蛋白含量[14]、提高免疫活性[15]和抗氧化活性[9]等的研究,但有关银杏果发酵技术的研究较少。
本研究以泰州大佛指银杏果为原料,采用响应面优化银杏果酶菌协同发酵工艺,以期得到一种高抗氧化活性的银杏发酵粉,为银杏果的精深加工奠定基础。
1 材料与方法
1.1 材料与仪器
银杏果 大佛指,江苏中药科技园;中温α淀粉酶 4000 U/g、糖化酶 100 U/mg、芦丁标准品纯度≥98%,北京索莱宝科技有限公司;植物乳杆菌 Dy-1,江苏大学食品与生物工程学院实验室提供;酿酒酵母 冻干粉,江南大学生物发酵与分离研究室提供;DPPH 纯度≥98%,sigma公司;牛血清白蛋白 分析纯,生工生物工程(上海)股份有限公司;Tris 分析纯,美国amresco;MRS肉汤培养基 优级纯,北京陆桥技术股份有限公司;银杏酸标准品 纯度≥99%,北京中科质检生物技术有限公司;考马斯亮蓝G250、盐酸、甲醇、正己烷、乙腈、ABTS等试剂 分析纯,国药集团。
T6-紫外可见分光光度计 北京普析通用仪器有限责任公司;高速万能粉碎机 天津市华鑫仪器厂;HH-6数显恒温水浴锅 江苏金坛市金城国胜实验仪器厂;Labconco FreeZone 6 L台式冷冻干燥机 美国LABCONCO公司;Thermo 702超低温冰箱 美国赛默飞世尔科技公司;DHG-9101-2S电热恒温鼓风干燥箱 上海三发科学仪器有限公司;JM-L80实验室胶体磨 温州昊星机械设备制造有限公司;SW-CJ-2FD型双人单面垂直净化工作台 吴江市亚泰净化设备有限公司;MaxQ 4000恒温培养摇床 赛默飞世尔科技公司;RE-52D旋转蒸发仪 上海青浦沪西仪器厂;回流提取装置 上海申玻仪器公司;SPX-250S·Ⅱ生化培养箱 上海三发科学仪器有限公司;PRIMOR型高速冷冻离心机 美国Thermo Fisher公司;AL204型电子天平 梅特勒-托利多集团;安捷伦1260高效液相色谱仪(配紫外检测器) 安捷伦科技有限公司。
1.2 实验方法
1.2.1 银杏果的加工工艺
1.2.1.1 干燥粉碎(G) 鲜银杏果预煮1 h后去壳、去芯,捣碎,60 ℃干燥4 h,80 ℃干燥1 h、100 ℃干燥1 h、120 ℃干燥0.5 h,粉碎制成小于200目的银杏粉(G)。
1.2.1.2 单酶解(M) 在干燥粉碎样的基础上,取100 g样加质量比为1∶6的水,用胶体磨研磨3 min。置于沸水浴中加热搅拌20 min,取出冷却至60 ℃。添加银杏果重量0.3 g/100 g的糖化酶和α淀粉酶复合酶制剂,在60 ℃下搅拌酶解2 h,100 ℃下灭酶15 min,取出冷却至35 ℃,冷冻干燥。
1.2.1.3 单乳酸菌发酵(R) 在干燥粉碎样的基础上,取100 g样加质量比为1∶6的水,用胶体磨研磨3 min。置于沸水浴中加热搅拌20 min,取出冷却至35 ℃。加入3 g/100 g植物乳杆菌,32 ℃的恒温摇床发酵12 h,取出将全部料液倒入多个平皿中,先在-78 ℃冰箱中预冻2 h,然后放到冻干机中冷冻干燥。
1.2.1.4 乳酸菌+酵母菌联合发酵(R+J) 在干燥粉碎样的基础上,取100 g样加质量比为1∶6的水,用胶体磨研磨3 min。置于沸水浴中加热搅拌20 min,取出冷却至35 ℃。分别加入1.5 g/100 g植物乳杆菌和酿酒酵母,32 ℃的恒温摇床发酵12 h,冷冻干燥。
1.2.1.5 酶解+乳酸菌联合处理(M+R) 在单酶解的基础上,加入3 g/100 g植物乳杆菌,32 ℃的恒温摇床发酵12 h,冷冻干燥。
1.2.1.6 酶解+乳酸菌+酵母菌联合处理(M+R+J) 即为菌酶协同发酵工艺,在单酶解的基础上,分别加入1.5 g/100 g植物乳杆菌和酿酒酵母,32 ℃的恒温摇床发酵12 h,冷冻干燥,从而获得银杏果发酵粉(GFP)。
1.2.2 单因素实验 设定1∶6 g/mL的料液比,复合酶制剂添加总量0.3 g/100 g,糖化酶和α淀粉酶添加质量比2∶1,酶解时间2 h,混合发酵剂添加总量3 g/100 g,植物乳杆菌和酿酒酵母添加质量比1∶1,发酵时间12 h,为固定水平。以可溶性蛋白含量和DPPH自由基清除率为指标,分别考察料液比(1∶5、1∶6、1∶7、1∶8、1∶9 g/mL)、复合酶制剂添加总量(0.2、0.3、0.4、0.5、0.6 g/100 g)、糖化酶和α淀粉酶添加质量比(1∶3、1∶2、1∶1、2∶1、3∶1)、酶解时间(1、1.5、2、2.5、3 h)、混合发酵剂添加总量(1.5、2.25、3、3.75、4.5 g/100 g)、植物乳杆菌和酿酒酵母添加质量比(1∶3、1∶2、1∶1、2∶1、3∶1)、发酵时间(6、12、18、24、30 h)对银杏果发酵粉可溶性蛋白含量和DPPH自由基清除率的影响。

表1 响应面试验因素及水平Table 1 Analytical factors and levels for response surface method
1.2.3 响应面试验 根据单因素试验结果,以银杏果发酵液对DPPH自由基清除率为响应值,选取料液比、糖化酶和α淀粉酶添加质量比、混合发酵剂添加总量、植物乳杆菌和酿酒酵母添加质量比4个因素设计四因素三水平试验,进而优化银杏果酶菌协同发酵的最适条件,因素水平见表1。
1.2.4 银杏果发酵粉可溶性蛋白质的测定 采用考马斯亮蓝法[16]测定:取0.2 g银杏果发酵粉,加入25 mL的0.15 mol/L Tris-HCL缓冲液(pH8.5),磁力搅拌提取0.5 h,后于4 ℃、7000 r/min离心15 min,取适量上清液和5 mL考马斯亮蓝染液,混匀,室温静置5 min后在595 nm处测定其吸光度。以牛血清白蛋白为标样,制得标准曲线方程为:y=0.006x+0.0194(R2=0.995)。

1.2.5 银杏果发酵粉抗氧化活性的测定 以DPPH自由基清除能力作为衡量银杏果发酵粉抗氧化能力的指标,参照王希[17]的方法进行测定。将2 mL银杏果发酵液和2 mL 0.2 mmol/L DPPH溶液混匀,暗处静置30 min,于517 nm处测得样品的吸光度A1;用2 mL甲醇代替DPPH测得本底吸光度A2;用2 mL甲醇加2 mL DPPH溶液测得空白对照吸光度A0,试验设置2个重复。清除率S(%)=[1-(A1-A2)/A0]×100。
1.2.6 银杏果银杏酸含量的测定
1.2.6.1 样品预处理 称取银杏果发酵粉10 g溶于200 mL无水甲醇,70 ℃水浴回流3 h,摇匀后过滤,将滤液浓缩,用正己烷萃取3次,每次20 mL,合并萃取液于40 ℃旋转蒸发至干,用甲醇定容至10 mL,0.45 μm滤膜过滤,得样品分析液。
1.2.6.2 HPLC法色谱条件 参照王荞薇等[18]的方法采用HPLC法测定银杏酸含量,用无水甲醇配制0.5 mg/mL的银杏酸标准品溶液。色谱柱:安捷伦XDB-C18毛细管柱(250 mm×4.6 mm,5 μm);流动相:乙腈-0.1%磷酸水溶液(94+6);时间40 min;流速1.0 mL/min;柱温30 ℃;检测波长310 nm;进样量20 μL。
1.2.7 银杏果发酵粉主要成分含量的测定
1.2.7.1 粗蛋白的测定 凯氏定氮法,参照GB 5009.5-2016。
1.2.7.2 脂肪的测定 索氏抽提法,参照GB 5009.6-2016。
1.2.7.3 淀粉的测定 酸水解法,参照GB 5009.9-2016。
1.2.7.4 还原糖的测定 直接滴定法,参照GB 5009.7-2016。
1.2.7.5 总酸的测定 酸碱滴定法,参照GB/T 12456-2008。
1.2.7.6 黄酮的测定 将样品用料液比1∶10的70%乙醇70 ℃回流提取2 h,离心取上清液,低温浓缩,用硝酸铝比色法[19]测定。以芦丁为标样,制得标准曲线方程为:y=10.677x-0.0034(R2=0.9996)。
1.2.7.7 多酚的测定 将样品用料液比1∶50的60%乙醇60 ℃回流浸提2 h,离心取上清液,低温浓缩,用福林酚法[20]测定。以没食子酸为标样,制得标准曲线方程为:y=9.7809x+0.0135(R2=0.9995)。
1.3 数据处理
每个数据重复测定3次,采用Design-Expert 8.05b软件对响应面数据进行分析,利用F检验进行方差分析以评价模型的统计意义。
2 结果与分析
2.1 单因素实验结果
2.1.1 银杏果不同加工方式的选择 采用单酶解(M)、单乳酸菌(R)、乳酸菌+酵母菌(R+J)、酶解+乳酸菌(M+R)、酶解+乳酸菌+酵母菌(M+R+J)5种不同加工方式,研究其对银杏果样品可溶性蛋白含量和DPPH自由基清除率的影响,以银杏粉样(G)为对比,确定银杏果的最适加工方式,见图1。
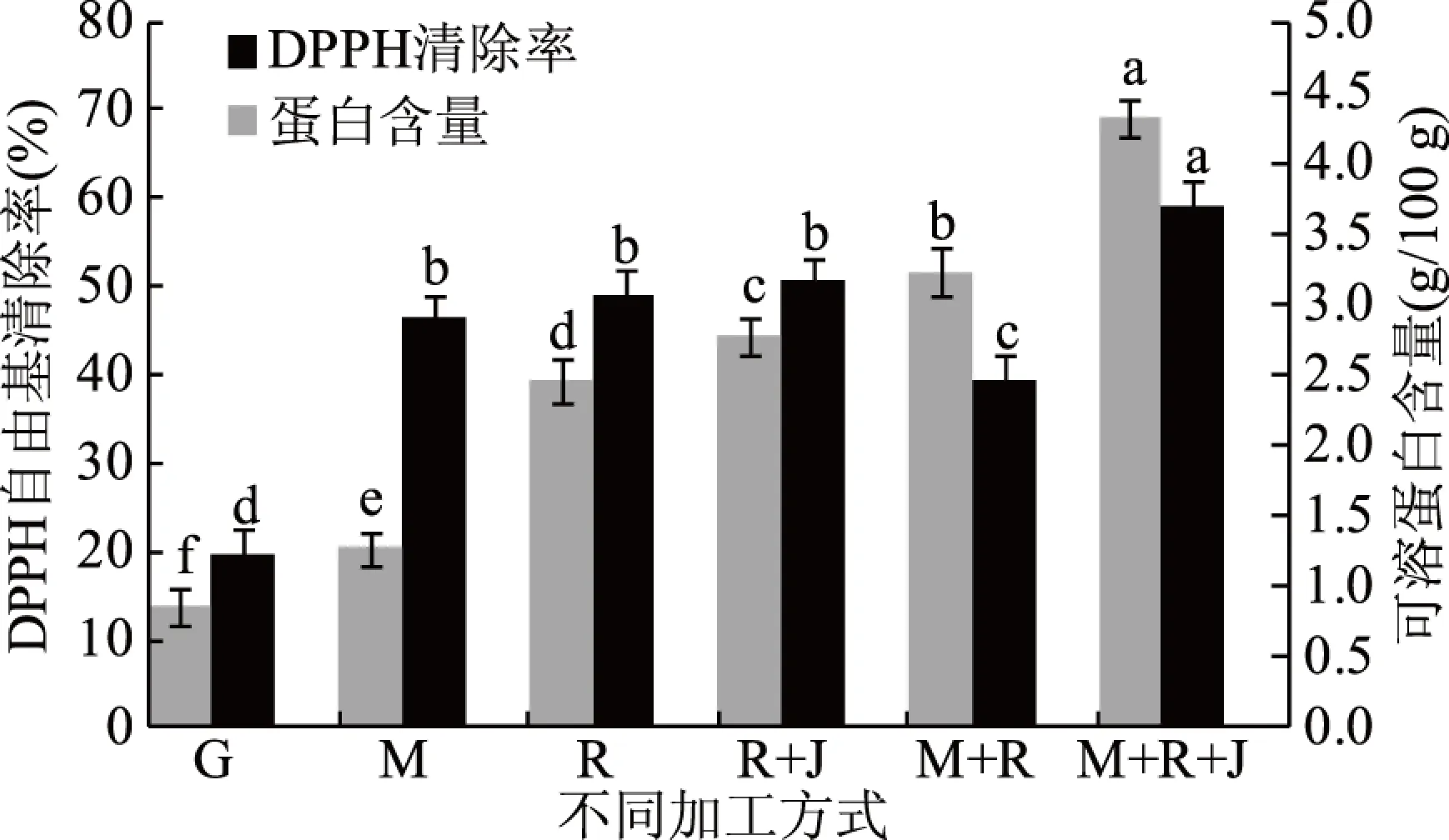
图1 不同加工方式对银杏果样品可溶性蛋白含量 和DPPH自由基清除率的影响Fig.1 Effects of different processing methods on soluble protein content and DPPH radical scavenging capacity of ginkgo seeds注:不同小写字母表示差异显著(P<0.05),下同。
由图1可知,与未经加工处理的银杏粉样(G)相比,采用5种不同加工方式处理后的银杏果样品,其可溶性蛋白含量均增加,对DPPH自由基的清除率均增加,但增加的程度不一致,其中采用酶解+乳酸菌+酵母菌(M+R+J)处理后的银杏果样品,其可溶性蛋白含量最高,对DPPH自由基的清除率最大,且与其他加工方式处理后的银杏果样品相比有显著差异。说明先采用复合酶制剂(糖化酶和淀粉酶)酶解后,再通过发酵剂(植物乳杆菌和酿酒酵母)进行发酵的方式处理银杏果,制备的发酵银杏粉中可溶性蛋白含量最多,抗氧化活性最强,与未处理的银杏粉(G)相比,可溶性蛋白含量增加了400.1%,DPPH自由基清除率增加了203.6%。马琦媛[21]亦发现采用乳酸杆菌和酿酒酵母发酵小米,有效改善了小米中植酸含量、氨基酸组成。因此后续试验采用酶解+乳酸菌+酵母菌(M+R+J)即菌酶协同发酵法处理银杏果样品。
2.1.2 料液比对银杏发酵粉可溶蛋白含量和DPPH自由基清除率的影响 研究不同料液比对银杏发酵粉的影响,见图2。随料液比增加,银杏发酵粉中可溶蛋白含量和DPPH自由基清除率均呈先增大后缓慢减小的趋势,料液比为1∶6 g/mL时,银杏发酵粉中可溶蛋白的含量最多,DPPH自由基清除率最大,且与其他处理样品相比有显著差异。这可能是因为生化反应时含水量少不利于银杏果的充分发酵,含水量太多会导致银杏发酵粉中的可溶性蛋白等抗氧化物质的相对含量减少,从而减弱了抗氧化效果。故较佳的料液比为1∶6 g/mL。

图2 料液比对银杏发酵粉的影响Fig.2 Effects of solid-liquid ratio on GFP
2.1.3 复合酶制剂添加总量对银杏发酵粉可溶蛋白含量和DPPH自由基清除率的影响 研究不同复合酶制剂添加量对银杏发酵粉的影响,见图3。随复合酶制剂添加量的增加,银杏发酵粉中可溶蛋白含量和DPPH自由基清除率均呈先增大后缓慢减小的趋势,复合酶制剂添加总量为0.3 g/100 g时,银杏发酵粉中可溶蛋白的含量最多,DPPH自由基清除率最大,且与其他处理样品相比有显著差异。这可能是因为复合酶制剂添加总量低时,酶解出的可溶性糖类物质较少,植物乳杆菌和酿酒酵母的生长较缓慢,水解出的可溶性蛋白、黄酮、多酚[22]等抗氧化物质较少,抗氧化活性较低。添加总量高时,酶解出的可溶性糖类物质较多,植物乳杆菌和酿酒酵母的生长较快,消耗的蛋白增多,可溶性蛋白含量减少,虽然银杏黄酮、多酚含量增加,但总抗氧化活性缓慢下降。故较佳的复合酶制剂添加量为0.3 g/100 g。

图3 复合酶制剂添加总量对银杏发酵粉的影响Fig.3 Effects of total amount of compound enzyme on GFP
2.1.4 糖化酶和α淀粉酶添加质量比对银杏发酵粉可溶蛋白含量和DPPH自由基清除率的影响 研究不同糖化酶和α淀粉酶添加质量比对银杏发酵粉的影响,见图4。糖化酶和α淀粉酶添加质量比对银杏发酵粉中可溶蛋白含量和DPPH自由基清除率影响较大,酶添加量和酶解时间一定时,糖化酶比例低,酶解出的可溶性糖类物质较少,植物乳杆菌和酿酒酵母的生长较缓慢,水解出的可溶性蛋白、多酚等抗氧化物质较少,抗氧化活性较低。糖化酶比例高,酶解出的可溶性糖类物质较多,植物乳杆菌和酿酒酵母的生长较快,消耗的蛋白增多,可溶性蛋白含量减少,虽然多酚含量增加,但总抗氧化活性下降。故较佳的糖化酶和α淀粉酶添加质量比为2∶1。
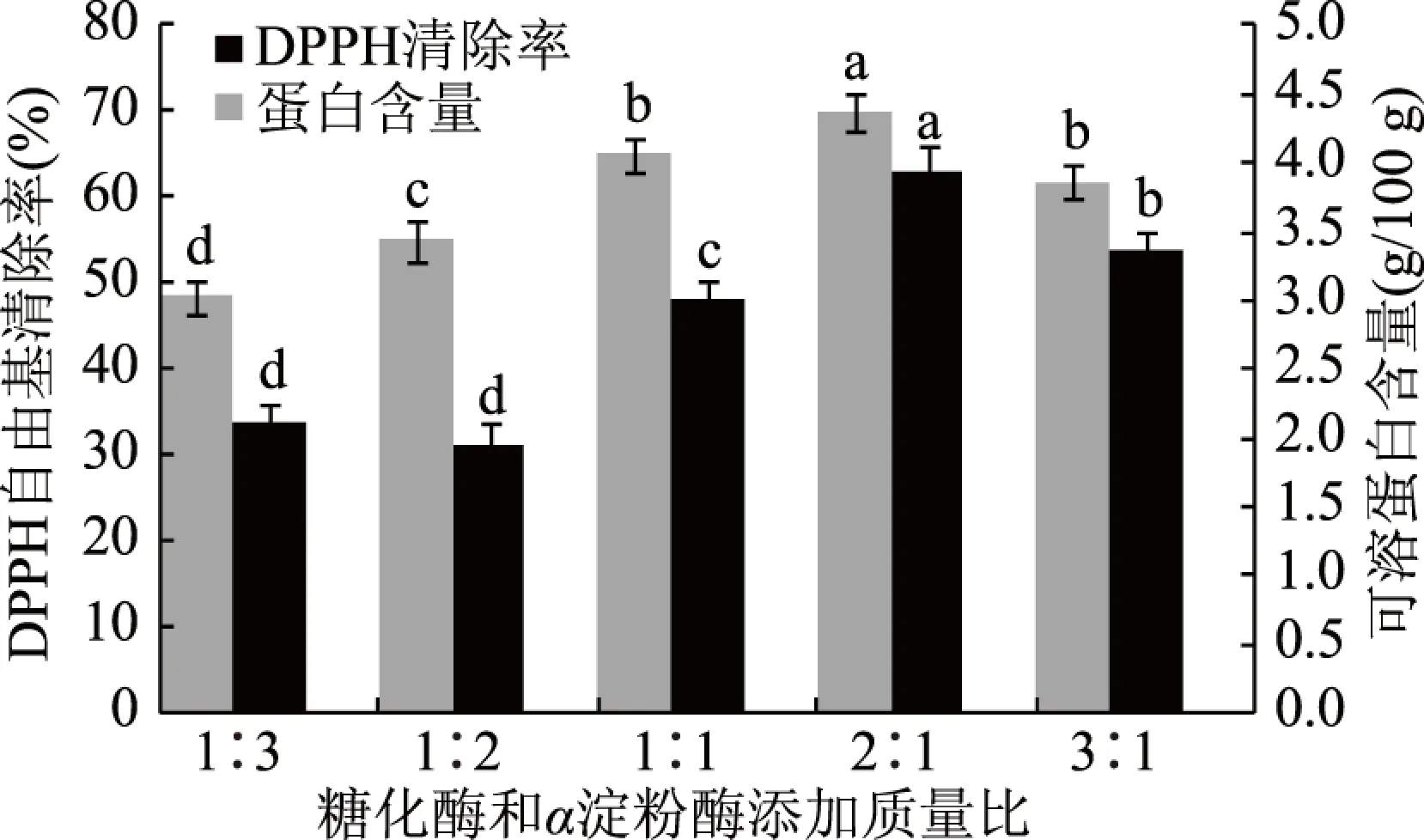
图4 糖化酶和α淀粉酶添加质量比对银杏发酵粉的影响Fig.4 Effects of mass ratio of glucoamylase and α-amylase on GFP
2.1.5 酶解时间对银杏发酵粉可溶蛋白含量和DPPH自由基清除率的影响 研究不同酶解时间对银杏发酵粉的影响,见图5。随着酶解的延长,银杏发酵粉中可溶蛋白含量先增加后基本不变,酶解3 h后减少,可能是因为酶解时间长,得到的可溶性糖类多,植物乳杆菌和酿酒酵母的生长较快,可溶性蛋白含量减少。随着酶解的延长,银杏发酵粉对DPPH自由基的清除率先增加,2 h后基本保持不变,可能是因为糖化酶和α淀粉酶能打断糖苷键,增加多酚类物质的释放[23],但可溶性蛋白含量减少,故抗氧化活性基本不变。较佳的酶解时间为2 h。
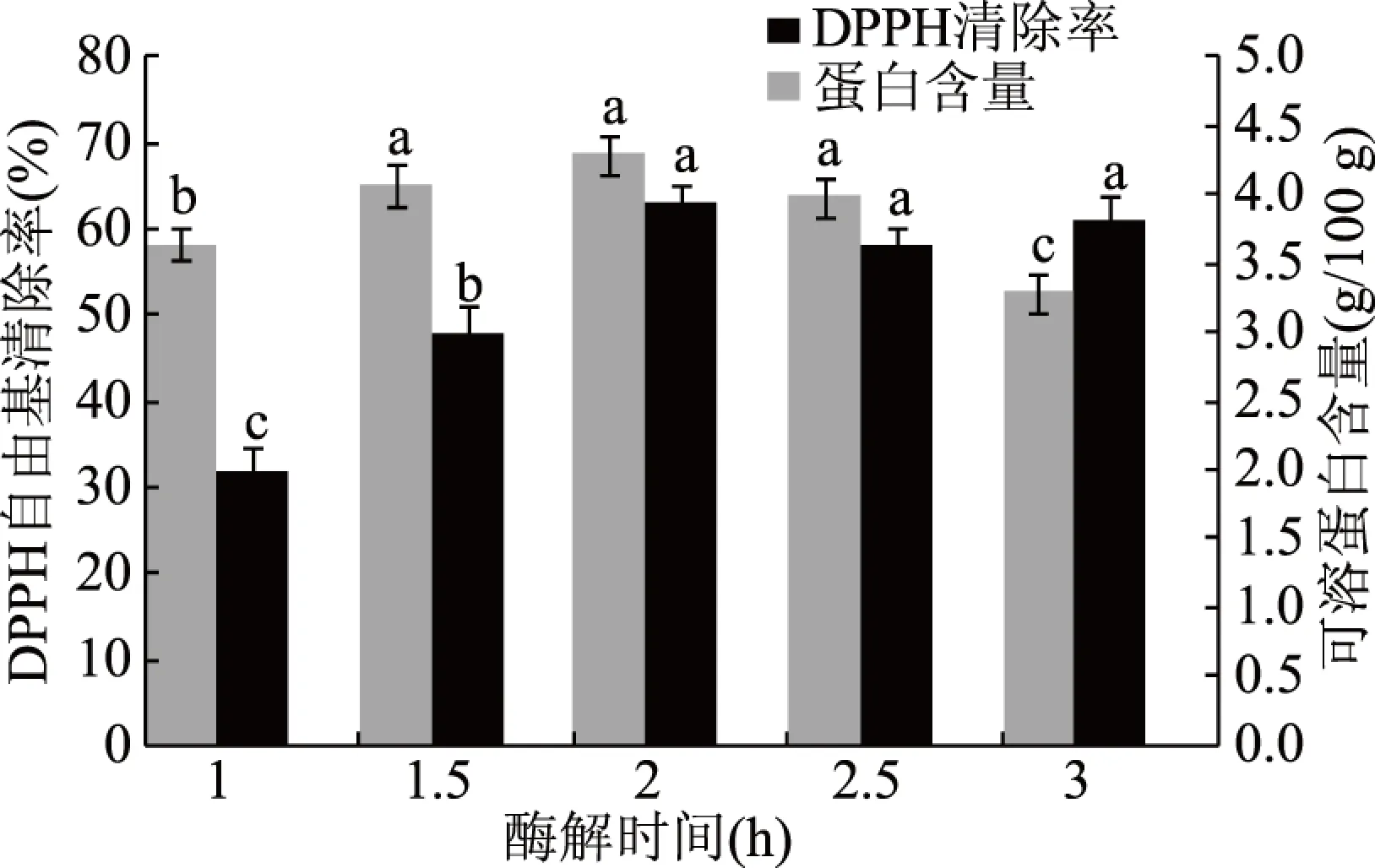
图5 酶解时间对银杏发酵粉的影响Fig.5 Effects of enzymolysis time on GFP
2.1.6 混合发酵剂添加总量对银杏发酵粉可溶蛋白含量和DPPH自由基清除率的影响 研究不同混合发酵剂添加总量对银杏发酵粉的影响,见图6。

图6 混合发酵剂添加总量对银杏发酵粉的影响Fig.6 Effects of total amount of mixed fermentation agent on GFP
由图6可知,随混合发酵剂添加总量的增加,银杏发酵粉中可溶蛋白含量和DPPH自由基清除率均呈先增大后减小的趋势,混合发酵剂添加总量为3 g/100 g时,银杏发酵粉中可溶蛋白的含量最多,DPPH自由基清除率最大,且与其他处理样品相比有显著差异。发酵剂添加量的多少与活性成分的含量密切相关,熊涛等[24]研究发现植物乳杆菌主要利用菌体分泌的酶水解基质中的蛋白为多肽和氨基酸来提供氮源。酵母菌生长繁殖所需的能量主要来自糖类的分解代谢。发酵剂添加量在1.5~3.0 g/100 g时,发酵剂水解银杏果中大分子蛋白为可溶性蛋白的量持续增加,银杏果结合态多酚在植物乳杆菌的作用下被释放出来或转化成了新的多酚,银杏果的抗氧化活性持续增加。当发酵剂添加量超过3.0 g/100 g时,银杏果中的营养物质不能满足大量发酵剂的生长,消耗的蛋白增多,同时也消耗酚类物质[25],抗氧化活性下降。故较佳的发酵剂添加量为3.0 g/100 g。
2.1.7 植物乳杆菌和酿酒酵母添加质量比对银杏发酵粉可溶蛋白含量和DPPH自由基清除率的影响 研究不同植物乳杆菌和酿酒酵母添加质量比对银杏发酵粉的影响,见图7。植物乳杆菌和酿酒酵母添加质量比对银杏发酵粉中可溶蛋白含量和DPPH自由基清除率的影响较大,植物乳杆菌在生长时,会分泌淀粉酶、蛋白酶、纤维素酶、脂肪酶等水解酶和有机酸[26],这些酶将淀粉、蛋白质、纤维素、脂肪等大分子物质转化成小分子物质,同时酸性环境激活了银杏果中各种内源酶。酿酒酵母含丰富的蛋白质和酶,主要分解代谢糖类,在酸性环境中生长较慢。发酵剂添加量和发酵时间一定时,植物乳杆菌比例低,水解出的可溶性蛋白、多酚等抗氧化物质较少,抗氧化活性较低。植物乳杆菌比例高,自身代谢所需要的蛋白增多,可溶性蛋白含量减少,抗氧化活性下降。故较佳的植物乳杆菌和酿酒酵母添加质量比为1∶1。

图7 植物乳杆菌和酿酒酵母 添加质量比对银杏发酵粉的影响Fig.7 Effects of mass ratio of lactobacillus plantarum and saccharomyces cerevisiae on GFP
2.1.8 发酵时间对银杏发酵粉可溶蛋白含量和DPPH自由基清除率的影响 研究不同发酵时间对银杏发酵粉的影响,见图8。随着发酵时间延长,银杏发酵粉中可溶蛋白含量先增加后缓慢下降,可能是因为植物乳杆菌和酿酒酵母生长过程中能分泌很多胞外酶,发酵时间短,酶量不充足,生成的活性物质少,可溶性蛋白含量低,抗氧化活性也低;而发酵时间太长,蛋白进一步水解为氨基酸或被代谢利用,可溶性蛋白含量减少。随着发酵时间延长,DPPH自由基清除率先增加,12 h后基本保持不变,可能是酚酸类物质经发酵后,由结合态转化为游离态,多酚含量增加,但可溶性蛋白含量减少,故抗氧化活性基本不变。较佳的发酵时间为12 h。
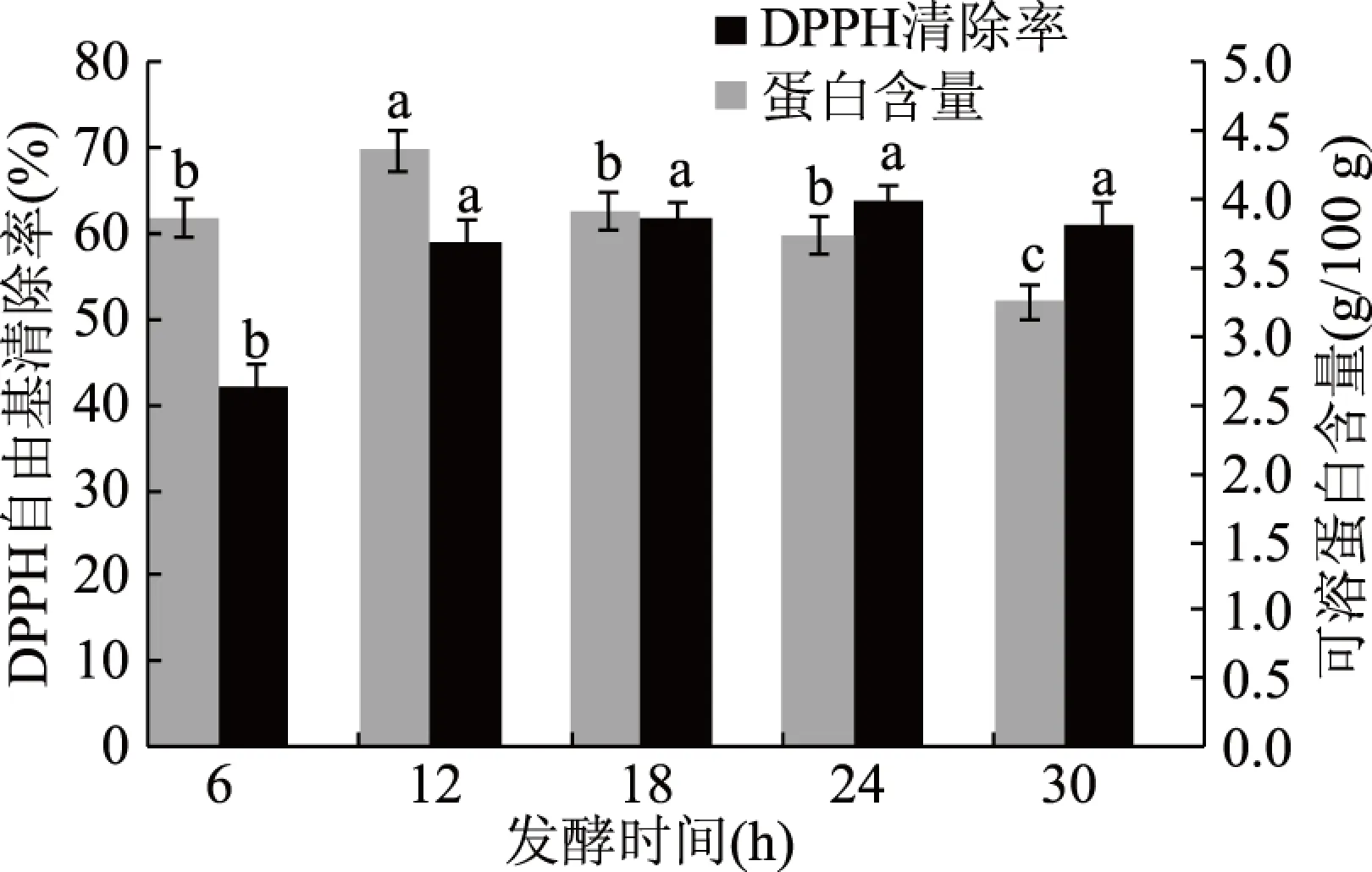
图8 发酵时间对银杏发酵粉的影响Fig.8 Effects of fermentation time on GFP

表2 响应面试验设计及结果Table 2 Design and results of response surface method

表3 回归模型方差分析Table 3 Variance analysis of regression equation
2.2 银杏果酶菌协同发酵工艺的响应面试验分析
2.2.1 响应面分析方案及结果 银杏果酶菌协同发酵工艺条件的响应面分析试验根据Box-Behnken设计进行了29组试验,结果见表2,回归模型的方差分析见表3。

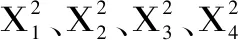
2.2.2 响应面因素间的交互作用分析 料液比、糖化酶和α淀粉酶添加质量比、混合发酵剂添加总量、植物乳杆菌和酿酒酵母添加质量比4个因素在银杏果酶菌协同发酵过程中的两两交互作用见图9。
曲面图的形状是各因素影响DPPH自由基清除率大小最直观的展示,曲面越陡峭,说明影响越显著[27]。由图9可看出c、e、f三图中曲面较为陡峭,且等高线密度分布不均匀,呈椭圆形,说明植物乳杆菌和酿酒酵母添加质量比与混合发酵剂添加总量、糖化酶和α淀粉酶添加质量比、料液比的交互作用较强,对DPPH自由基清除率的影响较显著,各因素对银杏发酵粉DPPH自由基清除率的影响顺序为植物乳杆菌和酿酒酵母添加质量比>混合发酵剂添加总量>糖化酶和α淀粉酶添加质量比>料液比,与表3中方差分析结果一致。
2.3 验证试验
根据响应面试验所得的银杏果酶菌协同发酵工艺参数结果和二次多项回归方程,利用Design Expert 8.05b软件中的“Optimization”模块分析得出优化结果,即获得较好DPPH自由基清除效果的工艺参数为料液比1∶63 g/mL,糖化酶和α淀粉酶添加质量比2.1∶1,混合发酵剂添加总量3.12 g/100 g,植物乳杆菌和酿酒酵母添加质量比1.06∶1,银杏发酵粉对DPPH自由基清除率预测可达到69.72%。考虑实际操作便利,将银杏果酶菌协同发酵工艺参数修正为料液比1∶6,糖化酶和α淀粉酶添加质量比2∶1,混合发酵剂添加总量3.12 g/100 g,植物乳杆菌和酿酒酵母添加质量比1∶1,采用修正后的工艺参数进行3次平行验证试验,结果测得DPPH自由基清除率为69.7±1.1%,可见该模型能较好地预测具有抗氧化活性的银杏果酶菌协同发酵工艺参数。由最佳工艺制得的银杏发酵粉(GFP)与未处理的银杏粉(G)相比,DPPH自由基清除率增加了257.4%。
2.4 银杏发酵粉品质的检测
2.4.1 银杏发酵粉银杏酸含量的检测 银杏酸标准品、银杏粉(G)、银杏发酵粉(GFP)中银杏酸的高效液相色谱图分别如图10所示。
由图10可知,通过与图10A各标准品的色谱峰保留时间相对比,银杏果经酶菌协同发酵后,银杏酸的的含量发生了显著的变化,其中银杏新酸(C13∶0)的含量略微下降,银杏酸(C15∶1)和十七烷一烯银杏酸(C17∶1)含量显著下降(P<0.05),十七烷二烯银杏酸(C17∶2)含量几乎下降为零。银杏发酵粉中银杏酸含量2.96 μg/g,低于2015版《中国药典》规定的限量标准10 μg/g,与干燥粉碎的银杏粉(G)相比,银杏酸脱除率达85.4%,说明银杏果经酶菌协同发酵后,对银杏酸的脱毒效果非常显著,达到了减毒的目的,提高了银杏果的食用安全性。可能是因为在优势植物乳杆菌和酿酒酵母菌的发酵作用下,银杏酸发生了转化,降低了含量[10,28]。

表4 银杏发酵粉的主要活性成分Table 4 The main active components of ginkgo fermentation powder

图10 各试样HPLC图谱Fig.10 HPLC chromatogram of different samples注:A. 银杏酸标准品的的HPLC图谱; B. 银杏粉中银杏酸的HPLC图谱; C. 银杏发酵粉中银杏酸的HPLC图谱。
2.4.2 银杏发酵粉主要活性成分分析 银杏发酵粉的主要活性成分含量见表4。
由表4可知,银杏果经酶菌协同发酵后,与普通的银杏粉相比,银杏发酵粉的粗蛋白、脂肪、总酸、可溶性蛋白、还原糖、黄酮和多酚含量显著增加(P<0.05),淀粉和银杏酸含量显著降低(P<0.05)。说明经酶菌协同发酵后,银杏果中大分子物质生化转化为可溶性小分子物质,同时消耗了糖,可溶性蛋白、黄酮、多酚等活性成分含量显著增加,银杏酸毒性成分含量显著降低。
在发酵的过程中,糖化酶、淀粉酶将银杏果中的淀粉酶解成葡萄糖等小分子糖类,为植物乳杆菌和酿酒酵母的生长代谢提供碳源,并减弱了其与蛋白的相互作用力,使得蛋白的溶解性增大[29]。植物乳杆菌将银杏果蛋白水解成小分子的可溶性蛋白、多肽和氨基酸[30],同时发酵后基质的pH下降,启动了银杏果内源性蛋白酶,将大分子蛋白降解,提高了银杏发酵粉中可溶性蛋白含量。黄酮类物质是银杏果中的主要活性成分,常与糖结合,以黄酮苷的形式存在[31]。糖化酶和淀粉酶可水解银杏果中的淀粉,打断糖苷键,释放出黄酮物质,黄酮的含量增加。酚酸类物质经发酵后,由结合态转化为游离态,多酚含量增加。
3 结论
在单因素试验基础上,以DPPH自由基清除率为响应值,通过响应面分析对银杏果酶菌协同发酵工艺进行了优化,经方差分析和响应面图得知,各因素对银杏发酵粉DPPH自由基清除率的影响顺序为植物乳杆菌和酿酒酵母添加质量比>混合发酵剂添加总量>糖化酶和α淀粉酶添加质量比>料液比。在复合酶制剂添加总量0.3 g/100 g,酶解2 h,发酵12 h的基础上,确定银杏果酶菌协同发酵最佳工艺为:料液比1∶6,糖化酶和α淀粉酶添加质量比2∶1,混合发酵剂添加总量3.12 g/100 g,植物乳杆菌和酿酒酵母添加质量比1∶1,测得DPPH自由基清除率为69.7±1.1%,与模型预测值基本一致。银杏果经酶菌协同发酵后,与未处理的银杏粉(G)相比,银杏发酵粉(GFP)中DPPH自由基清除率增加了257.4%;可溶蛋白含量4.47±0.13 g/100 g,增加了330%;黄酮含量0.15±0.01 mg/g,增加了50%;多酚含量2.49±0.04 mg/g,增加了118%;银杏酸含量2.96±0.32 μg/g,脱除率达85.4%。说明酶菌协同发酵能显著提高银杏果的抗氧化活性,制得的银杏发酵粉中可溶蛋白、黄酮、多酚等抗氧化成分含量显著增加、有毒成分银杏酸含量显著降低,为银杏果的精深加工提供物质基础,为银杏果的高效利用开创了新的途径。
