阿尔茨海默病、轻度认知功能障碍及主观认知下降患者血液DNA中多个基因的甲基化分析
2021-06-16郝淑文赵春松薛金花蔡彦宁
郝淑文 陈 瑛 丁 晖 赵春松,6 梁 阔,6 薛金花,6 蔡彦宁,6*
(1.首都医科大学宣武医院神经生物学研究室,北京 100053;2.教育部神经变性病重点实验室,北京 100053; 3.国家老年疾病临床医学研究中心, 北京 100053; 4.首都医科大学宣武医院神经内科,北京 100053;5.浙江省台州市立医院神经内科, 浙江台州 318000;6.首都医科大学宣武医院生物样本库,北京 100053)
阿尔茨海默病(Alzheimer’s disease, AD),以记忆和认知功能进行性下降为特征,是最常见的进行性神经退行性疾病[1]。遗忘型轻度认知功能障碍(amnestic mild cognitive impairment, aMCI),以严重的情景记忆丧失为特征,通常认为是AD的前驱期(痴呆前期)[2-3]。主观认知下降(subjective cognitive decline, SCD),指个体主观感觉自身认知功能一方面或者多方面持续减退,在AD的持续发展过程中,出现在aMCI之前[4]。SCD的诊断主要基于个体主观感受的认知能力下降和一组神经心理学测试[1]。因此,需要客观的SCD生物标志物帮助医生更容易和可靠地鉴定SCD患者,以便为他们提供早期有效的治疗。
DNA甲基化是参与基因表达调控的最重要的表观遗传修饰之一。AD脑组织存在DNA甲基化变化,并与AD病理变化密切相关。针对AD和MCI患者外周血的研究[5-12]也表明DNA甲基化变化可以用于疾病的早期预警、诊断及鉴别诊断。D’Addario等[7]的研究显示,AD患者外周血脂肪酸酰胺水解酶(fatty acid amide hydrolase,FAAH)基因甲基化水平降低;Di Francesco等[8]的研究显示AD患者外周血花生四烯酸 5-脂氧合酶(arachidonate 5-lipoxygenase,ALOX5)基因甲基化水平降低;Lunnon等[9]在出现痴呆症状前的老年2型糖尿病患者中鉴定了大量CpG位点,包括CBFA2/RUNX1伴侣转录共抑制因子3(CBFA2/RUNX1 partner transcriptional co-repressor 3,CBFA2T3)和碱性螺旋-环-螺旋转录因子家族成员E23 (basic helix-loop-helix family member e23,BHLHE23)的上游两个位点。但是,上述甲基化研究都是在白种人中进行,并未在中国人群进行验证,并且很少研究SCD患者。因此,笔者设计了该病例对照研究,探索中国人群中可用于SCD客观诊断的外周血生物标志物。
本研究针对既往报道[7-9]的4种AD和/或aMCI阶段DNA甲基化标志物,并且采用亚硫酸氢盐焦磷酸测序的方法评估其在AD、aMCI、SCD和对照受试者中的甲基化水平。
1 对象与方法
1.1 研究对象
2015年12月到2017年9月从首都医科大学宣武医院神经内科记忆门诊招募AD患者31例、aMCI患者41例、SCD患者57例和当地社区健康对照57人为研究对象。本研究得到宣武医院伦理委员会的批准[临研审(2014)011号],符合世界医学协会道德守则(赫尔辛基宣言)的规定,每位研究对象获得知情同意。
AD患者满足美国国立神经病、语言功能紊乱和脑卒中研究所及AD和相关疾病协会 (National Institute of Neurological and Communicative Disorders and Stroke and the Alzheimer’s Disease and Related Disorders Association, NINCDS-ADRDA)可能痴呆的临床诊断标准[13]。aMCI患者根据Petersen标准[14]进行诊断。SCD患者满足最近提出的SCD诊断标准[4]。健康对照无记忆和智能障碍,并且其临床痴呆评估量表(Clinical Dementia Rating, CDR)评分为0。如果受试者有以下一个或多个临床特征将排除:①明确的卒中史;②严重抑郁[汉密尔顿抑郁量表评分(Hamilton Depression Rating Scale, HAMD)>24分];③由创伤性脑外伤导致认知受损;④其他和认知受损相关的神经系统疾病,例如脑肿瘤、帕金森病、脑炎和癫痫;⑤其他可以导致认知受损的系统疾病,例如甲状腺功能障碍、严重贫血、梅毒和艾滋病(acquired immune deficiency syndrome,AIDS);⑥精神病史或者先天性智力发育迟缓。所有参与者都进行了简易精神状态量表(Mini-Mental State Examination,MMSE)评估。
1.2 研究方法
1.2.1 甲基化候选基因的挑选
ALOX5和FAAH基因甲基化水平的失调,其转录和翻译水平也失调[7-8],此外,在出现痴呆症状前的老年2型糖尿病患者中鉴定了大量CpG位点,包括CBFA2T3和BHLHE23基因上游两个位点[9]。因此本研究中共检验了4个候选基因:FAAH、ALOX5、CBFA2T3和BHLHE23。
1.2.2 焦磷酸测序分析
早晨6:00到8:00收集静脉血样。QIAamp DNA mini 试剂盒(德国Qiagen公司)抽提白细胞基因组DNA,并进行亚硫酸氢钠处理[15]。对于亚硫酸氢盐反应(其中胞嘧啶被转化为尿嘧啶,5-甲基胞嘧啶保持不变),基因组DNA的最初变性使用0.3 mol/L NaOH,再加入偏亚硫酸氢钠(pH 5.0)和对苯二酚使终浓度分别为3.0 mol/L和0.5 mmol/L。反应混合物上加矿物油,避光,于50 ℃孵育16 h。变性的DNA用Wizard DNA纯化试剂盒纯化(美国Promega公司),后用0.3 mol/L NaOH 在37 ℃处理15 min终止反应,乙醇沉淀。对于亚硫酸氢盐焦磷酸测序分析,50 ng亚硫酸氢盐处理的基因组DNA应用HS Taq(日本Takara公司)进行扩增。4个靶基因的聚合酶链反应(polymerase chain reaction,PCR)扩增引物及测序引物的序列如表1所示。CBFA2T3的上游引物在5′端包含生物素,而其他三个基因的下游引物在5′端包含生物素。ALOX5的扩增条件如下:94 ℃预变性 2 min;94 ℃变性20 s,61 ℃退火20 s,72 ℃延伸20 s,共50个循环,最后72 ℃延伸5 min。FAAH、CBFA2T3和BHLHE23的扩增条件如下: 94 ℃预变性2 min;94 ℃ 变性20 s,64 ℃退火20 s,72 ℃延伸20 s,共50循环,最后72 ℃延伸5 min。对于焦磷酸测序反应,使用PSQ真空预处理装置(德国Qiagen公司)将单链DNA模板固定在链霉亲和素标记的Sepharose高性能微珠(瑞典GE Healthcare公司) 上。反应物在80 ℃孵育2 min,冷却至室温,使用0.4 mmol/L测序引物,使用Pyromark Q96 焦磷酸测序仪和测序试剂盒(德国Qiagen公司),按照仪器和试剂盒说明书进行焦磷酸测序。
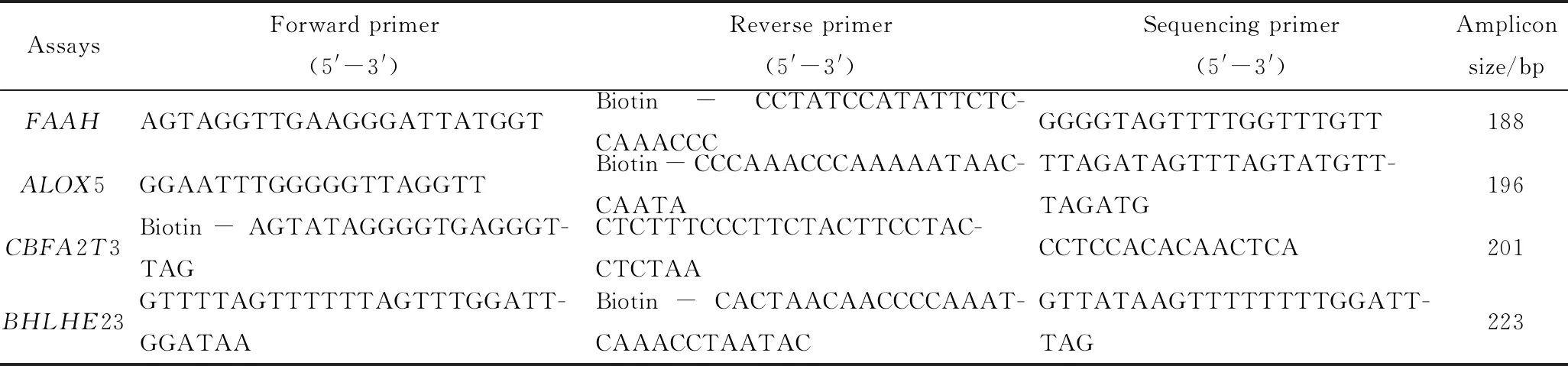
表1 用于定量4个不同基因甲基化水平的焦磷酸测序分析的引物
1.2.3 基因分型
载脂蛋白E(apolipoprotein E,APOE)ε2/ε3/ε4单倍型的单核苷酸多态性(single nucleotide polymorphism,SNPs) rs7412 和 rs429358。使用标准Sanger测序方法对APOE进行基因分型,使用引物如下:5′-ACGCGGGCACGGCTGTCCAAGG-3′(上游)和5′-GGCGCTCGCGGATGGCGCTGA-3′(下游)。APOE扩增条件如下:98 ℃ 10 s;72 ℃ 5 s,共35循环,72 ℃ 5 min。PCR在终体积30 μL的溶液中进行,包含10 pmol上游和下游引物,50 ng基因组DNA模板,并使用有GC缓冲液的PrimeSTAR HS DNA 聚合酶 (日本Takara公司)。
1.3 统计学方法
2 结果
2.1 各组研究对象的基本特征
4组间性别构成差异无统计学意义(P>0.05)。 AD组患者年龄大于aMCI、SCD、对照组,MMSE评分低于其他组,组间比较差异有统计学意义(P<0.05)。APOEε4等位基因的携带者频率AD组最高,其次是aMCI组,健康对照组最低,组间比较差异有统计学意义(P<0.05),详见表2。
表2 研究对象的基本特征
2.2 各组FAAH, ALOX5, CBFA2T3和BHLHE23基因甲基化水平比较
4个基因的甲基化水平在各组间差异均无统计学意义(P>0.05),详见表3。根据性别的分层分析,男性中FAAH:P=0.234,ALOX5:P=0.865,CBFA2T3:P=0.109,BHLHE23:P=0.502;女性中FAAH:P=0.337,ALOX5:P=0.250,CBFA2T3:P=0.624,BHLHE23:P=0.355,分层后各组间4个基因的甲基化水平差异均无统计学意义。根据APOE基因型分层分析,APOEε4非携带者中FAAH:P=0.293,ALOX5:P=0.335,CBFA2T3:P=0.364,BHLHE23:P=0.395;APOEε4携带者中FAAH:P=0.347,ALOX5:P=0.908,CBFA2T3:P=0.898,BHLHE23:P=0.704,分层后各组间4个基因的甲基化水平差异均无统计学意义。
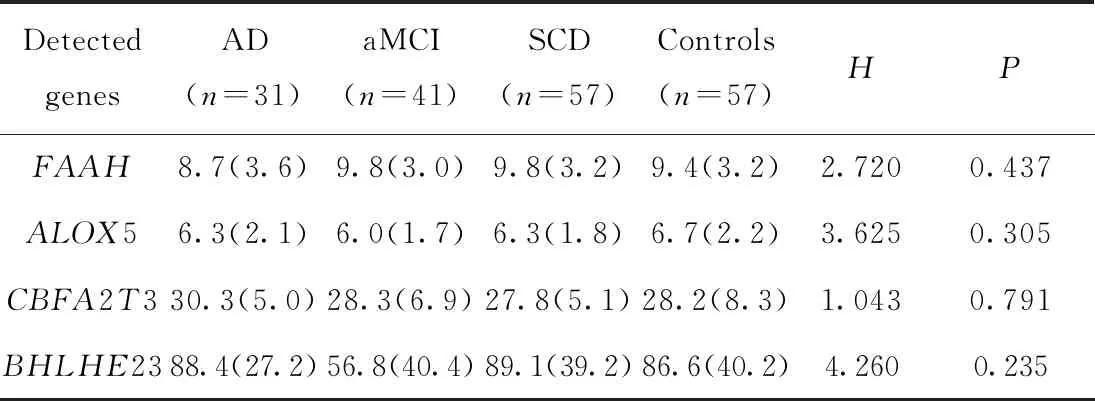
表3 AD, aMCI, SCD和对照组血液DNA中4个靶基因的甲基化水平
3 讨论
由于SCD的诊断主要依靠患者主观感觉认知能力下降和神经心理学测试,缺乏客观的诊断生物标志物,早期诊断对于患者治疗具有重要意义。因此,在本研究中笔者假设AD和/或aMCI的诊断生物标志物可能也有潜力作为SCD的生物标志物。为了检测这一假设,挑选了4个之前报道[7-9]的AD和/或aMCI差异甲基化的基因,并评估了它们在AD、aMCI、SCD和对照受试者中的甲基化水平。发现4个候选基因中没有一个在SCD患者中是差异甲基化的。这表明在AD的晚期或中期鉴定的DNA甲基化变化不总是适用于SCD的生物标志物。
FAAH是终止内源性大麻素信号转导的酶之一,它能够水解花生四烯酸乙醇胺(arachidonic acid ethanolamine, AEA)和其他脂肪酸酰胺。FAAH参与AD的炎性反应过程及花生四烯酸等促炎分子的释放[16]。5-脂氧合酶(5-lipoxygenase, 5-LOX)是花生四烯酸生成白三烯类介质(leukotrienes, LTs)的限速酶,由5-LOX合成的白三烯参与和年龄相关痴呆及神经退行性疾病的大脑炎性反应[17-18]。尽管CBFA2T3和BHLHE23与痴呆相关联的可能机制尚无报道,但是Lunnon等[9]的研究显示其甲基化在AD中发生改变,其差异甲基化可能成为早期认知改变的潜在生物标志物。
本研究选取的4个基因分析甲基化水平,其甲基化值分布在较低(FAAH、ALOX5:<10%)、中等(CBFA2T3: 20%~30%)和较高(BHLHE23: 80%~90%),这种设计可对AD、MCI及SCD人群的甲基化研究有比较全面的了解,从不同的基因、不同的甲基化水平探讨可能的疾病生物标志物。
本研究未在AD和/或aMCI患者与正常对照之间检验出有统计学意义的甲基化,可能有以下原因。首先,应该注意到FAAH、ALOX5、CBFA2T3和BHLHE23的差异甲基化在白种人中鉴定,而本研究中招募的受试者是中国人。种族的差异可能会导致不一致的研究结果。实际上,已经有研究[19]显示伴神经母细胞瘤的德国和日本患者之间同源盒A9(homeobox A9,HOXA9)基因启动子甲基化水平的差异。此外,在印度亚洲人之间代表4个位点甲基化状态的甲基化评分显著高于欧洲人[20]。这些研究结果表明当选择潜在的甲基化生物标志物用于验证时,应该考虑种族的差异。其次,之前FAAH及ALOX5基因的研究[7-9]中采用外周血单核细胞,本研究中采用外周血白细胞。从全血中提取的DNA甲基化由不同类型血液有核细胞混合的DNA甲基化构成[21]。全血DNA甲基化研究[22]中不同血细胞类型分布可能作为混杂因素。本研究使用全血DNA,血细胞类型不确定的构成可能潜在影响结果。另外,之前的CBFA2T3和BHLHE23研究受试者是出现痴呆症状前的老年2型糖尿病患者。2型糖尿病本身和AD密切相关[23],其差异甲基化位点可能在一定程度上受到基础疾病的影响。最后,还有甲基化检测方法不一致,本研究中采用亚硫酸氢盐焦磷酸测序,而焦磷酸测序是甲基化定量研究的金标准。之前FAAH的研究[7]采用甲基化特异性引物实时PCR,ALOX5研究[8]采用基于荧光的实时PCR、CBFA2T3和BHLHE23的研究采用Illumina人甲基化450 K基因芯片技术。这些条件的不一致可能是本研究和既往研究结果不同的原因。
虽然本研究并未发现4个基因甲基化水平的差异,但是,这些结果并不能排除一些人群中的AD关键特异性基因的甲基化改变,当前的结果应谨慎解释,有必要在更大的病例对照人群中进行该领域的研究,进一步确定DNA甲基化在神经退行性疾病中的程度和作用。本研究使用焦磷酸测序技术在中国AD患者中进行FAAH、ALOX5、CBFA2T3、BHLHE23基因甲基化的研究,为神经退行性疾病的早期诊断和治疗提供了一定的理论依据。
总之,本研究表明与健康对照相比,FAAH、ALOX5、CBFA2T3和BHLHE23四个基因在AD、aMCI或者SCD患者中未发现差异甲基化。在AD的晚期或中期鉴定的DNA甲基化变化不总是适用于SCD诊断的生物标志物。
