不同转染试剂包装慢病毒效果研究
2021-06-16孙雪娟
唐 俊 孙雪娟 谭 翠
(1.重庆医科大学附属第一医院分子肿瘤及表观遗传学重庆市重点实验室 重庆 400016;2.重庆医科大学附属第一医院研究生管理处 重庆 400016)
细胞转染技术,是指人为地将外源性基因分子如DNA、RNA等导入真核细胞内的一种技术。随着细胞生物学和分子生物学的飞速发展及基因与蛋白功能的研究深入,转染已经成为实验室工作中经常涉及的基本实验方法。目前,细胞转染技术主要分为三类途径:物理介导、化学介导和生物介导。物理方法包括电穿孔法、显微注射和基因枪等;化学介导方法种类较多,如经典的磷酸钙共沉淀法、脂质体转染方法、和多种阳离子物质介导的技术等;生物介导方法,有较为原始的原生质体转染以及现在比较多见的各种病毒介导的转染技术。与其他途径相比,慢病毒体系作为生物介导的方法之一,因其安全性高、免疫赦免小、可重复性强、能够携带大基因片段且可长期稳定表达等优点,被广泛应用[1]。慢病毒包装中常用的转染试剂有PEI、脂质体等。聚乙烯亚胺(Polyethylenimine,PEI)是一种具有较高的阳离子电荷密度的有机大分子,因其可以缩聚DNA分子形成颗粒,常被用于真核细胞的转染。脂质体是磷脂分散在水中形成的脂质双分子层,又称为人工生物膜,可将DNA分子包裹在内形成DNA-脂复合物,适用于各种悬浮或贴壁细胞,转染效率较高。
本实验采用两种转染试剂PEI和LipoD293作为研究对象,将携带CMV启动子和绿色荧光蛋白GFP(green fluorescent protein)标记的慢病毒质粒包装成慢病毒液,通过对比观察包装及病毒液感染后,293T细胞中荧光蛋白表达强弱来比较两种脂质体的慢病毒包装效果,为慢病毒包装过程中转染试剂的选择提供实验依据。
一、材料与方法
(一)主要仪器及试剂
细胞培养基Dulbecco’s modification of Eagle medium(DMEM)、减血清培养基Opti-MEM、Fetal Bovine Serum (FBS)、胰蛋白酶、高速离心机Micro17均购自美国Thermo Fisher公司,脂质体LipoD293购自SignaGen公司,激光共聚焦显微镜TCSSP8购自德国Lei Ka公司,PEI购自polysciences公司,将PEI终浓度配置成1mg/ml,置于-20℃保存。
(二)质粒
慢病毒质粒pLenti-C-mGFP由OriGene公司构建,包装质粒psPAX2、pMD2G由南开大学馈赠。
(三)细胞株及培养条件
293T细胞购自ATCC,由实验室细胞库冻存。培养基为含10%FBS的DMEM,置于37℃、CO2含量为5%的细胞培养箱中。
(四)慢病毒包装
1.细胞传代及种板
对数生长期293T细胞汇合90%时,去除上清,加入2ml PBS,轻轻晃动后去除,加入1ml0.1%胰酶,置于生物安全柜中室温消化30s,待大部分细胞变圆后,轻拍瓶底,使细胞漂浮,加入1ml培养基终止消化。将细胞悬液倒入离心管中,1000r离心5分钟,弃上清,加入培养基,以1.5*106接种于六孔板,共6孔,每3个孔为一组,分别标记A、B两组,当细胞汇合达80%左右,进行转染。
2.用PEI和LipoD293包装慢病毒
A组用PEI转染:①250ul Opti-MEM+PEI 7ul混匀后室温静置5min;②250ul Opti-MEM+质粒4.8ug(psPAX2 1.8ug、pMD2G 0.6ug、pLenti-C-mGFP 2.4ug)混匀后室温静置5min;③将②中质粒混合液缓慢加入①中,混匀后室温静置20min。
B组用LipoD293转染:①250ul Opti-MEM+LipoD293 7.2ul混匀后室温静置5min;②250ul Opti-MEM+质粒4.8ug(psPAX2 1.8ug、pMD2G 0.6ug、pLenti-C-mGFP 2.4ug)混匀后室温静置5min;③将②中质粒混合液缓慢加入①中,混匀后室温静置20min。
六孔板中细胞去除原培养基,加入1ml PBS润洗后去除,沿孔壁缓慢加入500ul Opti-MEM,再加入PEI/LipoD293与质粒的混合液,轻柔摇晃混匀后置于细胞培养箱中。A组4小时、B组6h后每孔更换为2ml完全培养基。48小时后,用激光共聚焦显微镜观察每孔中细胞GFP阳性率并收集病毒液于离心管中,20000r离心20min[2],A组病毒液标记为病毒液A,B组病毒液标记为病毒液B,每EP管分装500ul,测定病毒滴度后,储存于-80℃
(五)慢病毒液感染293T细胞
对数生长期293T细胞,提前一天按照1.4.1种板及分组。当细胞汇合达60%左右,进行感染。
病毒液A、B在4℃冰箱中融化后,A组加入含病毒液A的1/2体积培养基,B组加入含病毒液B的1/2体积培养基,感染16-18h后去除含病毒液上清,加入2ml完全培养基。48小时后用激光共聚焦显微镜观察每孔中细胞GFP阳性率。
(六)差异及统计分析
统计分析采用SPSS 22.0软件,进行Student t-test检验。P<0.05差异有统计学意义。
二、结果与分析
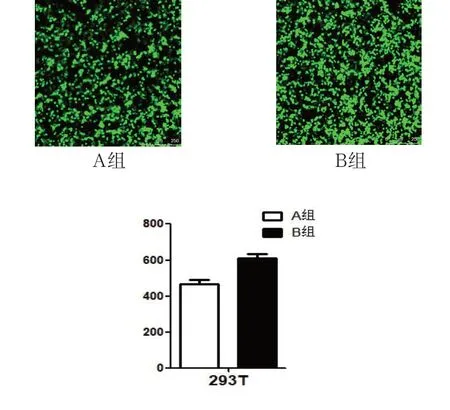
在慢病毒包装过程中,用PEI(A组)和LipoD293(B组)分别转染293T细胞48h后,用激光共聚焦显微镜观察两组中细胞GFP表达如图A所示。A组细胞GFP表达少于B组。
图A
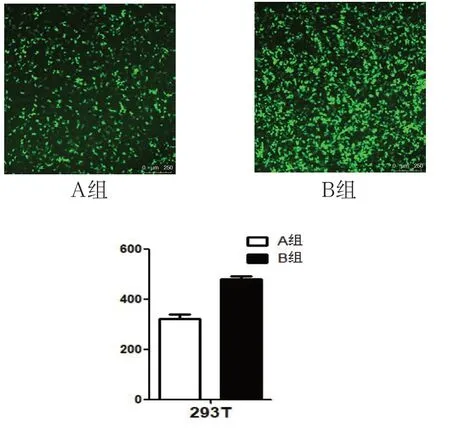
用A、B病毒液分别感染293T细胞48h后,用激光共聚焦显微镜观察两组细胞GFP表达如图B显示。A组细胞GFP表达明显少于B组,即用在质粒配比相同的情况下,LipoD293包装的慢病毒液的具有较强的感染力。
图B
三、讨论
慢病毒体系之所以作为生物介导的方式之一,主要是因为其载体可以将外源基因有效的整合到宿主细胞中,在具有更高转染效率的同时,避免宿主细胞对外源基因的切割修饰[3],从而达到持久稳定的表达。慢病毒病毒载体来源于人类免疫缺陷病毒,为真核细胞的修饰提供了一种有效的手段,在被广泛研究和优化的同时,也被用于科研和临床基因治疗应用的学术实验室[4]。然而在慢病毒的包装过程中,无论选择三质粒系统还是四质粒系统,都需要将几个质粒同时转染入细胞,因此选择高效、经济、安全的转染试剂和方法以获得高的转染效率尤其重要。
脂质体表面带正电荷,主要由亲水性头部、链接键和疏水性尾部三部分构成。作为一种高效的转染试剂,首先通过静电作用与核酸的磷酸根将DNA分子包裹在内形成DNA-脂复合物,再被表面带负电荷的细胞吸附,通过内吞、膜的融合等方式将复合物传递入细胞[5],是目前实验室最常用的转染试剂之一。脂质体转染效率、生物毒性主要取决于其结构及表面的修饰[6]。本实验选取LipoD293是脂质体中转染试剂之一,特有的脂质体共轭结合技术,目前常用于难转染细胞、单DNA和多DNA片段的共转染。PEI是一种人工合成的多聚阳离子,将DNA压缩成50-200nm大小的纳米球[7]并与其形成稳定的复合物,通过无明显障碍的粘附内吞进入细胞[8],实现携带质粒的表达。从工业的原材料到转染试剂,PEI因其价格优势、使用方法简单、转染效率较高越来越多的被应用于细胞转染技术中。但由于PEI的内吞可在细胞膜上形成团片状物,研究表明其细胞毒性受浓度影响,大于7ug/ml加入细胞中即可引起细胞明显死亡[9]。本实验选取7ug/ml浓度用作GFP质粒转染,转染复合物与细胞作用时间为4h,并于4h、24h及48h观察293T细胞状态,并未见明显细胞毒性作用。由此可见,除了PEI浓度,质粒大小、转染复合物与细胞作用时间、被转染细胞的状态也是影响其毒性的重要作用。周鹏[10]等人也证实了PEI-DNA转染复合物与细胞作用时间在4h转染效率较6h高。
本实验采用病毒三质粒系统,在质粒配比相同的情况下,用PEI和LipoD293包装的慢病毒液,对比观察包装及病毒液感染后293T细胞中荧光蛋白表达强弱,发现转染和病毒感染48h后,LipoD293组293T细胞的荧光蛋白表达均高于PEI组,证实在其他条件相同情况下,LipoD293包装慢病毒效果优于PEI,可作为一种高效、经济的转染试剂用于慢病液的制备。
