热打击可通过调控内质网应激通路促进神经细胞凋亡
2021-06-16高经华刘亚伟吉晶晶刘志锋
高经华,刘亚伟,吉晶晶,刘志锋
1南方医科大学第一临床医学院,广东 广州 510515;2中国人民解放军南部战区总医院重症医学科,广东 广州 510010;3南方医科大学南方医院神经外科,广东 广州510515
中暑是一种严重威胁人民群众生命健康的急危重病。国际上根据中暑的临床特征将其定义为:中心体温升高超过40 ℃、无汗以及中枢神经系统功能障碍(中暑三联症)[1]。其中脑损害是重症中暑中发生率最高,且为最严重的并发症。有报道约至少有80.3%的患者合并有中枢神经系统损害,并且许多患者以神经系统症状为首发症状,如意识状态改变、癫痫、昏迷等,具有极高死亡率,即使存活患者,也有20%~30%遗留神经系统功能障碍。但目前对脑损伤的分子机制仍认识较少,也缺乏有效的治疗措施。现有研究发现热打击可导致脑出现神经细胞坏死,凋亡[1-3]和自噬[4]。由于内质网是真核细胞内蛋白质合成、脂质生成和钙离子贮存的主要场所,在协助蛋白折叠中具有重要作用[5-6]。细胞受到内外因素的刺激时,内质网内累积大量未折叠或错误折叠的蛋白质,即未折叠蛋白反应,细胞针对此采取的应答反应称为内质网应激[6-7]。细胞发生重度内质网应激,进而促凋亡蛋白表达增加和钙离子超载诱导细胞凋亡。本课题组在前期的研究中已发现,热打击可以促进SHSY5Y神经细胞凋亡[3]。然而关于热打击对神经细胞内质网应激和凋亡的影响以及相关机制研究还未见报道。因此,本研究以SH-SY5Y神经细胞为研究对象,探究热打击致神经细胞凋亡中对胞内钙离子稳态和内质网应激信号调节通路的调节作用,从分子机制角度出发深入认识中暑的发病机制,可为针对性诊治中暑脑损伤,进而降低重症中暑病死率和后遗症发生率提供实验科学证据。
1 材料和方法
1.1 材料、试剂及抗体
DMEM高糖培养基、胎牛血清、胰酶、不含EDTA胰酶(Gibco);BCA 蛋白定量/浓度测定试剂盒(meilunbio);PAGE凝胶快速制备试剂盒(雅酶,PG113,PG112);RIPA裂解液(Beyotime);Loading Buffer(弗德生物);ECL 显影液(Millipore);PrimeScriptTMRT Reagent Kit、TB Green Premix Ex TaqTMII(Takara);蛋白酶抑制剂混合液、磷酸酶抑制剂混合液(Beyotime),FITC Annexin V Apoptosis Detection Kit I(BD Biosciences);Cell Counting Kit-8(DOJIDO);Fluo-3,AM eater(Useverbright);Nonfat Dry Milk(Cell Signaling Technology),抗体:XBP-1(abcam);Caspase-3/p17/p19 Rabbit Polyclonal antibody(proteintech,19677-1-AP);Phospho-SAPK/JNK(Thr183/Tyr185);BIP Antibody、Bcl-2、Anti-mouse IgG HRP-linked Antibody、Anti-rabbit IgG HRP-linked Antibody、GAPDH、α-Tubulin(Cell Signaling Technology);4-PBA(Selleck)。。
1.2 细胞培养及传代
神经母细胞瘤SH-SY5Y购买于ATCC。细胞培养使用含有10%FBS的DMEM高糖培养基,在5%CO2,37 ℃的细胞培养箱常规培养,隔天换液,根据细胞生长情况进行传代。取对数生长期的细胞做实验研究。
1.3 热打击模型与分组
将SH-SY5Y细胞接种于10 cm培养皿进行培养。待细胞密度生长为80%~90%,调整细胞培养箱温度为43 ℃,热打击细胞2 h,热打击后放置37 ℃继续培养0、3、6 h后,进行各项检测。对照组始终在37 ℃培养,实验组按照不同复温时间点分为0、3、6 h组。
1.4 细胞活力检测
SH-SY5Y细胞接种于96孔细胞培养板,5000个细胞/孔,培养基100 μL/孔。在细胞培养箱中培养培养24 h。实验分为4组:对照组,0、3、6 h,每组设置3个复孔。第2天43 ℃热打击细胞2 h,分别复温0、3、6 h后,吸弃培养基,每孔加含有10%CCK8原液的培养基100 μL,继续在细胞培养箱中培养2 h,然后使用酶标仪450 nm波长检测各组吸光度值(A450值)。细胞存活率(%)=(实验组A450值-空白组A450值)/(对照组A450值-空白组A450值)。空白组不加细胞仅加入等量的培养液。
1.5 流式细胞术检测热打击后SH-SY5Y细胞凋亡
SH-SY5Y细胞接种于6 cm细胞培养皿进行培养,待细胞密度生长为80%~90%进行热打击造模。分组:双阴组(即不处理又不加染Annexin V和PI染料),双阳组(对照组+双染),0 h组(双染),3 h组(双染)和6 h组(双染)。造模结束后,分别对应标注流式管(5个),吸出并收集培养基到对应流式管中,用不含EDTA的胰酶消化并收集细胞于流式管,离心1000 r/min,3 min,弃上清,加使用预冷的PBS,温柔重悬细胞,再次离心。洗重复细胞两次后,将细胞重悬于100 μL含Annexin V和PI各5 μL 的缓冲液中并轻柔混匀,避光室温放置15 min,再加400 μL缓冲液,1 h内上机检测。左下象限为正常细胞,右下象限Annexin V为单标记的早期凋亡细胞,右上象限为Annexin V和PI双标记的晚期凋亡细胞和坏死细胞,左上象限为细胞收集过程中产生的损伤细胞碎片。细胞凋亡率(%)=右上象限(%)+右下象限(%)。
1.6 流式细胞术检测热打击后SH-SY5Y细胞钙离子变化
SH-SY5Y细胞接种于6 cm细胞培养皿进行培养,待细胞密度生长为80%~90%进行热打击造模。分组:阴性对照组(不染荧光探针),阳性对照组(染荧光探针),0 h组(染荧光探针),3 h组(染荧光探针)和6 h组(染荧光探针)。预冷的1×PBS 润洗细胞3 次,用不含EDTA的胰酶消化细胞,收集于对应已经标注好的流式管中,1000 r/min,离心3 min,弃上清,加预冷的PBS,温柔重悬细胞,再次离心。再用重复使用PBS洗3次,加浓度为4 μmol/L的Fluo-3 AM工作液500 μL,在细胞培养箱中避光培养20 min后,每管加入5倍体积含有1%FBS的Hanks液继续37 ℃培养25 min。然后用HEPES液润洗细胞3次,操作步骤同上,用HEPES液重悬细胞,37 ℃放置10 min,上机检测。激发光为506 nm,发射光为526 nm。
1.7 免疫荧光共聚焦显微镜观察热打击后SH-SY5Y细胞钙离子荧光强度
将SH-SY5Y细胞接种于4个共聚焦皿,待细胞密度生长为80%~90%进行热打击造模。造模后,吸弃培养基,使用预冷的PBS润洗细胞3次,每个共聚焦皿加浓度为4 μmol/L的Fluo-3 AM工作液500 μL,在细胞培养箱中避光培养20 min 后,加入5 倍体积1%FBS 的Hanks液继续37 ℃培养25 min。然后用HEPES液润洗细胞3次,37 ℃放置10 min,上机检测。激发光为506 nm,发射光为526 nm。
1.8 qRT-PCR 检测热打击后内质网应激蛋白mRNA水平
每个6 cm皿接种6×105个SH-SY5Y细胞,12 h后热打击造模。实验分组:对照组,0、3、6 h。使用常规Trizol法提取SH-SY5Y细胞RNA。然后使用分光光度计检测RNA 浓度,按照逆转录试剂盒(Takara,RR0047A)说明书进行操作。每20 μL逆转录体系添加1 μg RNA总量。逆转录条件,step1:37 ℃反应15 min,step2:85 ℃反应5 s,step3:4 ℃无限循环。qPCR按照逆转录试剂说明书进行操作,引物序列见表1。循环设置40个,内参照基因为GAPDH。所有试验重复3次以上。
1.9 Western blot检测热打击后内质网应激蛋白水平以及Cleaved-caspase-3蛋白水平
每个6 cm皿铺6×105细胞,12 h后热打击造模。实验分组:con,0、3、6 h。造模结束后,用预冷PBS清洗细胞3次,每个皿加含有1%的蛋白酶抑制剂和磷酸酶抑制剂混合物的RIPA裂解液50 μL,冰上裂解20 min。用细胞刮收集细胞裂解液于1.5 mL的离心管,12 000 r/min,4 ℃离心15 min,收集上清于与新EP管。用BCA蛋白定量/浓度测定试剂盒测蛋白浓度。每个泳道30 μg蛋白总量进行Western blot检测。用10%SDS-PAGE胶进行电泳。置于冰上湿转至PVDF膜上。室温下用5%脱脂牛奶封闭1 h,4 ℃孵育一抗过夜。第2天使用TBST洗膜3次/5 min,使用相应的二抗室温孵育40 min,继续TBST洗膜3 次/5 min,使用ECL 显影液显影,并用Image J软件进行灰度值分析,重复3 次以上,进行统计学分析。Western blot 检测4-PBA 预处理后,热打击后Cleaved-Caspase3蛋白水平
1.10 Western blot检测4-PBA预处理后,热打击导致的SH-SY5Y细胞内Cleaved-caspase-3蛋白水平
4-苯基丁酸(4-PBA)作为内质网的化学伴侣,被认为是内质网应激的抑制剂。4-PBA具有稳定肽链结构、增加内质网的折叠能力、清理错误折叠蛋白的作用。因此在本实验中,我们利用4-PBA预处理抑制内质网应激反应,从反向验证内质网应激在热打击致SH-SY5Y神经细胞凋亡的作用。
铺4个6 cm皿,每个皿铺6×105细胞,待细胞密度生长为80%~90%,进行造模。实验分组:对照组,4-PBA处理组,热打击组,热打击+4-PBA组。4-PBA预处理浓度为1 mmol/L,预处理时间为1 h。然后进行热打击2 h,复温6 h,提取4 个组的蛋白,进行Western blot 检测Cleaved-caspase-3蛋白水平,具体实验步骤同上。
1.11 统计学方法
所有数据均采用Prism 6.0 软件(GraphPad Software,Inc.,La Jolla,CA)进行统计学分析。数据用均数±标准差表示,各组均数比较采用One-way ANOVA,P<0.05为差异有统计学意义。
2 结果
2.1 热打击对SH-SY5Y细胞形态和活力的影响
分别采用光学显微镜和CCK8 法观察检测热打击对SH-SY5Y细胞的影响。与对照组相比,打击后,复温0 h,细胞收缩为圆形,细胞突触变细甚至观察不到,复温3 h~6 h,细胞逐渐伸展,突触可见(图1A)。热打击后细胞活力逐渐下降(P=0.02,P=0.03,P=0.001,(图1B))。

图1 热打击对SH-SY5Y细胞形态和活力的影响Fig.1 Effect of heat stress on SH-SY5Y cell viability.A:Changes of cell morphology after heat stress observed by optical microscope(Original magnification:×100).B:Cell viability determined using CCK-8 assay.*P<0.05,**P<0.01 vs control group(n=3).
2.2 热打击对SH-SY5Y细胞凋亡的影响
为进一步观察热打击对细胞的损伤作用,使用WB验证Cleaved-caspase3蛋白水平和AnnexinV-FITC/PI双染法检测热打击后细胞凋亡水平。与正常对照组相比,热打击后细胞Cleaved-caspase3蛋白水平显著增加(图2A)。热打击后,细胞凋亡率由对照组3%左右显著增加至9%左右,并具有时间依赖性(图2B)。
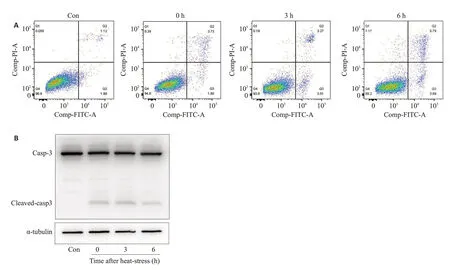
图2 热打击对SH-SY5Y细胞凋亡的影响Fig.2 Effect of heat stress on apoptosis of SH-SY5Y cells.A:Percentage of apoptotic SH-SY5Y cells detected by flow cytometry.B:Protein expression of cleaved caspase-3 in SH-SY5Y cells after heat stress.
2.3 热打击对SH-SY5Y细胞钙离子浓度的影响
利用流式细胞术和免疫荧光共聚焦显微镜分析细胞内钙离子水平变化。与对照组相比,43 ℃热打击2 h后复温0 h,细胞内钙离子水平增加10倍,复温3 h,钙离子水平为对照组的9倍左右,复温6 h,钙离子水平为对照组的4倍左右(图3A)。对照组钙离子荧光处于较低水平,热打击后0 h,细胞内钙离子荧光强度显著增强,在0 h和6 h,荧光强度逐渐减弱,而且6 h可见部分细胞胞体肿胀,变大(图3B)。
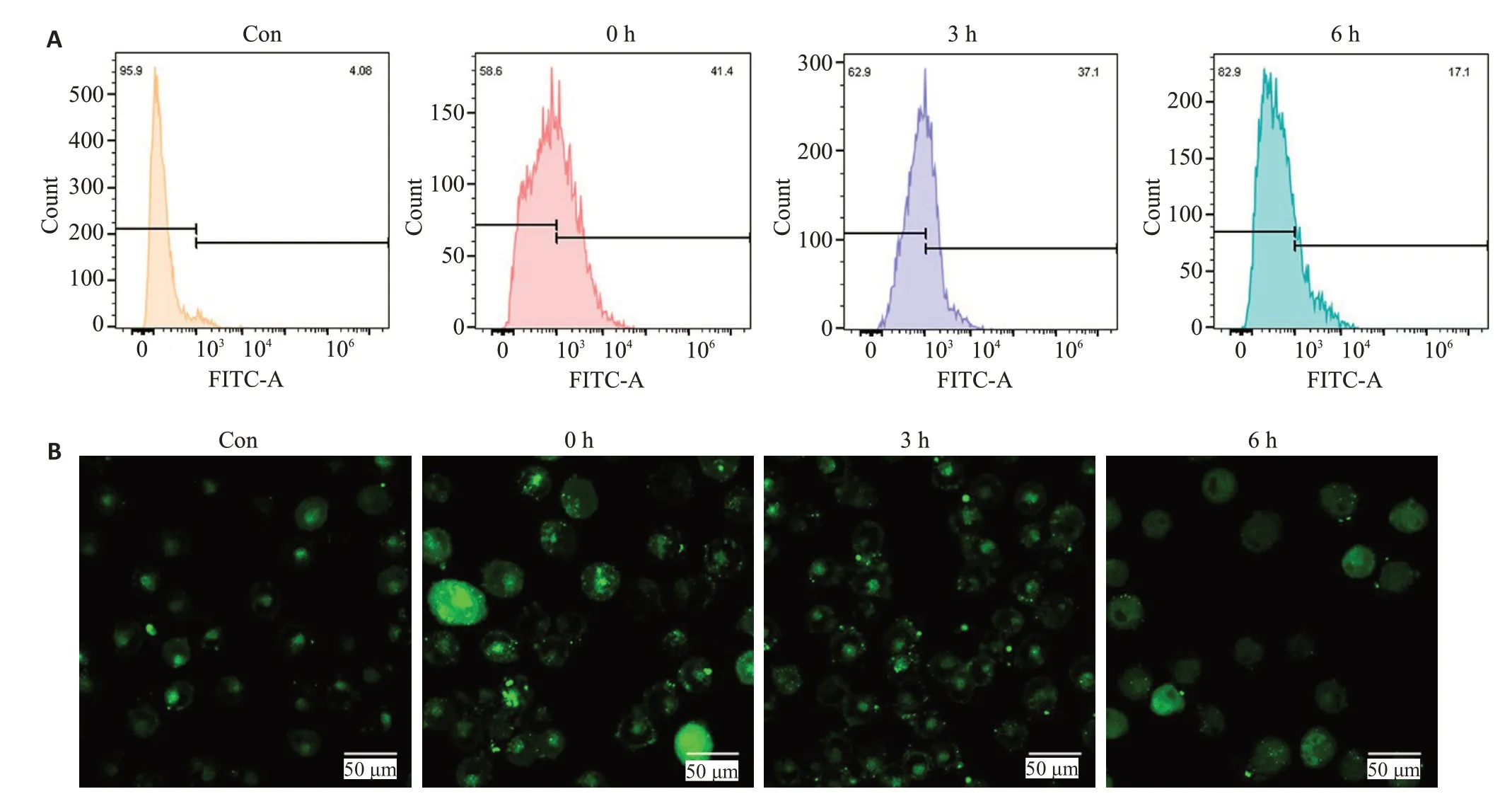
图3 热打击对SH-SY5Y细胞钙离子浓度的影响Fig.3 Effect of heat stress on intracellular Ca2+ of SH-SY5Y cells.A:Ca2+ levels in SH-SY5Y cells detected by flow cytometry.B:Fluorescence intensity of Ca2+(green)observed by immunofluorescence confocal microscope(×63).
2.4 热打击对内质网应激相关蛋白mRNA水平的影响
通过qRT-PCR 检测热打击后SH-SY5Y细胞内质网应激信号通路相关因子mRNA表达。如图4所示,结果发现:与对照组相比,43 ℃热打击细胞2 h 后复温0 h,Caspase-12mRNA 表达量有增加趋势但无统计学意义,复温3~6 h,Caspase-12 mRNA且呈复温时间依赖性增加(P=0.003,P=0.002)。43 ℃热打击细胞2 h 后从复温0~6 h,BIP的mRNA 表达量有增加且呈复温时间依赖性(P=0.02,P=0.01,P=0.03)。43 ℃热打击细胞2 h后复温0~6 h,XBP-1的mRNA 表达量有整体减少趋势,但是仅在复温3 h时XBP-1 mRNA 表达量有统计学差异(P=0.02)。
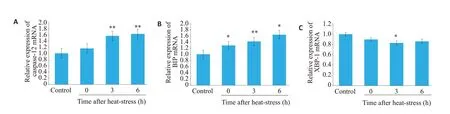
图4 热打击对内质网应激相关蛋白mRNA水平的影响Fig.4 mRNAexpressions of endoplasmic reticulum stress-related proteins detected by qRT-PCR in SH-SY5Y cells after heat stress.A:Caspase-12 mRNA level in SH-SY5Y cells at different time points after heat stress.B:BIP mRNA level in SH-SY5Y cells at different time points after heat stress.C:XBP-1 mRNA level in SH-SY5Y cells at different time points after heat stress;*P<0.05,**P<0.01 vs control group(n=3).
2.5 热打击对内质网应激蛋白水平的影响
使用Western blot 检测热打击后SH-SY5Y细胞内质网应激通路相关蛋白的表达(图5)。43 ℃热打击细胞2 h后从复温0 h~6 h,BIP蛋白表达量有明显增加趋势并随复温时间依赖性(P<0.001,P<0.001,P=0.008)。43 ℃热打击细胞2 h后Caspase-12蛋白表达量在复温6 h时表达量显著增加(P=0.02)。P-JNK/JNK蛋白水平在43 ℃热打击细胞2 h复温0 h增加最显著(P=0.003),复温3 h 开始减少(P=0.01),并随复温时间呈减少依赖性。XBP-1蛋白水平在复温0 h(P=0.02)至3 h(P=0.005)明显减少,然后在复温6 h(P=0.007)蛋白水平略有恢复,但是整体水平是下降趋势,并具有统计学差异。

图5 热打击对内质网应激蛋白水平的影响Fig.5 Expressions of endoplasmic reticulum stress-related proteins at different time points after heat stress.A:Western blots of caspase-12,BIP,P-JNK,JNK and XBP-1.B-E:Quantitative analysis of relative expression of BIP,caspase-12,XBP-1 and JNK in the cells after heat stress,respectively.*P<0.05,**P<0.01 vs control group(n=3).
2.6 内质网应激抑制剂可抑制热打击后细胞的凋亡
进一步反向验证内质网应激在热打击致SH-SY5Y细胞凋亡中的作用。利用内质网应激抑制剂4-PBA预处理SH-SY5Y细胞后,在进行热打击。如图6所示,热打击后细胞中Cleaved-caspase3 水平显著增加,而4-PBA预处理后,Cleaved-caspase3水平减少。
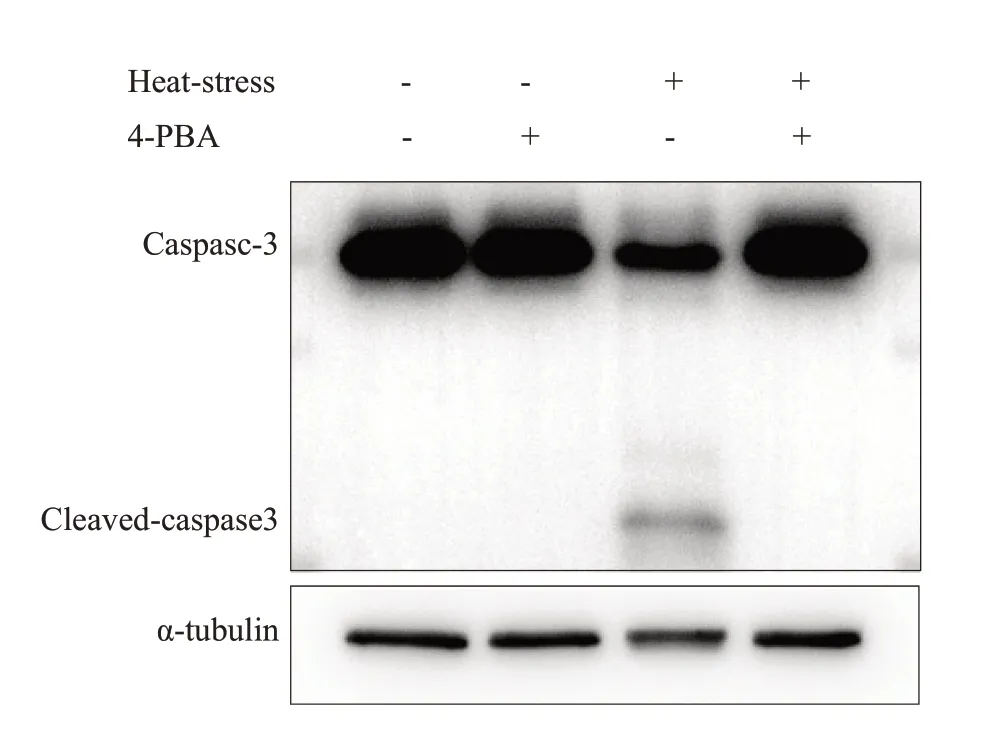
图6 内质网应激抑制剂4-PBA可以抑制热打击后细胞的凋亡水平Fig.6 Pretreatment with 4-PBA inhibits heat stressinduced apoptosis in SH-SY5Y cells shown by reduced protein expression of cleaved caspase-3 detected by Western blotting.
3 讨论
近年的研究倾向认为,中暑后神经细胞会发生广泛的水肿,变性,坏死和出血[8-9],分子机制表现为坏死,凋亡[3,10]和自噬[11]。但是中暑如何引起神经细胞凋亡还未报道。先前动物试验研究表明43 ℃热打击大鼠70 min后,下丘脑神经元凋亡率可达30%以上[12]。并且本课题组前期研究也发现热打击可致SH-SY5Y神经细胞发生凋亡[12],本研究再次利用体外细胞实验证明热打击后复温6 h 可致神经细胞Annexin V 比例显著增加。Bartoszewska等[13]利用急性热打击大鼠模型,发现海马区神经细胞出现损伤和凋亡,活化的Caspase3显著增加。我们前期将小鼠在39、40、41、42 ℃下进行热打击,并在直肠温度达41 ℃后降温处理,发现随着热打击程度加重,除了脑水肿加重外,还渐进性出现神经元细胞变性坏死[13]。本研究中43 ℃热打击SH-SY5Y细胞2 h,然后分别复温0、3和6 h,观察到热打击不仅可以改变细胞的形态,还能显著影响细胞活力,并且活化Caspase-3水平增加,说明热打击可导致神经细胞发生凋亡。
凋亡机制涉及的经典途径有内质网应激通路,线粒体损伤以及死亡受体模式。而内质网应激在细胞应激过程中扮演积极重要的角色。由于内质网对内外环境改变极为敏感,除未折叠或错误折叠蛋白以外,氧化-还原反应、低糖、缺氧[14]、酸中毒以及各种刺激等都可诱导内质网应激。热应激对于神经细胞来说,也是一种严重的打激。而且内质网应激还是多种疾病的共同特征,比如神经退行性疾病[15],癌症[16-18],炎症[19-21]和代谢性疾病[20,22],在肥胖,非酒精性脂肪肝疾病[20,22]和糖尿病模型的肝脏或脂肪组织中经常观察到慢性内质网应激激活。无论内质网是发生慢性激活还是快速激活,都可通过凋亡导致细胞的死亡[22]。内质网作为钙离子储存库,发生应激时释放大量钙离子,然后线粒体摄取钙离子增加释放细胞色素C的敏感性,加重细胞损伤和凋亡[6]。通过细胞内钙离子水平的检测,本研究首次结果发现,热打击也可以导致神经细胞内钙离子超载,并随着复温时间延长,钙离子水平有所下降,同时细胞凋亡率增加,这都表明热打击可能诱导内质网应激,进而释放钙离子,最终导致细胞凋亡。
在内质网非应激情况下,BiP也称葡萄糖调节蛋白78(GRP78),是一种钙离子结合分子伴侣,对保证蛋白进行正常的糖基化和折叠,膜蛋白和分泌蛋白的正确定位、以及阻截有错误的蛋白是必需的[24-26]。蛋白激酶R样内质网激酶(PERK)和肌醇酶1(IRE-1)位于内质网膜上,是感受外界刺激并启动内质网的重要分子[27-29]。Bip 能在内质网内端结合这两个分子,维持信号转导因子的非活化状态[30]。IRE-1与Bip分离后,剪切未成熟的X盒蛋白1(XBP-1)mRNA并使其成熟,最终生成的转录激活因子XBP-1,移位入核后,通过促进含内质网应激反应元件的未折叠蛋白反应靶分子(如Bip)以减轻或中止内质网应激反应,恢复细胞内环境稳态[31]。而持续的IRE-1活化,可导致其下游的JNK磷酸化[32],以及释放的钙离子活化caspase-12[33],诱导细胞凋亡。最近研究发现在肿瘤细胞[18],心肌细胞[18],激活JNK可以直接促进细胞凋亡[36]。有研究者利用大黄酸刺激人肝脏细胞,通过诱导内质网应激和钙离子超载导致细胞凋亡[37]。此外体内和体外实验发现,氧化应激可以诱发内质网应激,导致Caspase-12表达增加,JNK活化,促进细胞凋亡[38]。利用内质网应激抑制剂可以改善细胞凋亡[39]。但是关于热打击是否会引发神经细胞内质网应激从而导致凋亡还需要我们进一步的验证。因此,本研究采用43 ℃热打击SH-SY5Y细胞2 h,通过研究不同复温时间点来探讨热打击对内质网应激相关指标的影响。热打击后,内质网应激代表分子Caspase-12蛋白水平增加,JNK明显磷酸化明显,表明热打击可以激活内质网应激促凋亡蛋白的表达,为进一步验证假设提供可靠的依据。而且热打击导致内质网应激促存活蛋白XBP-1水平下降,进一步加剧的细胞的凋亡。虽然促存活蛋白BIP表达水平上调,但是无法逆转热打击整体对细胞的促凋亡作用。利用内质网应激抑制剂4-PBA预处理后,细胞凋亡蛋白Cleaved-caspase3表达水平显著降低,再次说明了内质网应激通路参与了热打击致SHSY5Y细胞的凋亡。以上结果说明,内质网应激通路参与中暑小鼠下丘脑神经细胞的凋亡。
综上所述,本研究首次提出并发现了热打击能够通过促进内质网应激和钙离子稳态失衡诱导神经细胞凋亡,未来还需要进一步通过在体向实验来验证现有结论,从而为中暑脑损伤的机制研究和救治提供科学依据。
