华支睾吸虫来源的分子伴侣rCsHscB对小鼠慢性溃疡性结肠炎有治疗作用
2021-06-16张雨钊张蓓蓓李向阳郑葵阳
华 慧,董 昕,张雨钊,方 凡,张蓓蓓,李向阳,于 倩,郑葵阳,颜 超
徐州医科大学病原生物学与免疫学教研室,江苏省免疫与代谢重点实验室,徐州市感染与免疫重点实验室,江苏徐州221004
溃疡性结肠炎(UC)是炎症性肠病的一种,在我国已经成为一种常见的肠道疾病[1-2],其病因复杂,一般认为与遗传、感染、环境、免疫平衡失调等因素有关[3-5]。近年研究表明蠕虫感染可有效防治炎症性肠病[6-7],因此蠕虫来源的相关蛋白引起广泛关注[8-9]。
华支睾吸虫是蠕虫的一种,华支睾吸虫来源的分子伴侣CsHscB经生物信息学分析发现是共-分子伴侣家族成员,与其他来源的同家族成员相比,均含有高度保守的DnaJ和共-分子伴侣HscB结构域,作为共-分子伴侣Hsc20家族成员之一,提示CsHscB可能具有分子伴侣的一般功能[10-11],但其具体研究目前未见报道。本课题组于体外重组合成rCsHscB,前期研究证实rCsHscB作为热休克蛋白家族成员之一,能够显著上调IL-10 的含量,诱导宿主负向免疫调控[12],但其对慢性溃疡性结肠炎作用未知。为此,本研究在成功构建DSS诱导的慢性溃疡性结肠炎小鼠模型基础上,进一步研究华支睾吸虫来源的rCsHscB蛋白对慢性溃疡性结肠炎的作用,并探讨其可能机制。
1 材料和方法
1.1 实验动物
50只6~8周(约20 g)清洁级雄性C57BL/6小鼠购自北京维通利华公司,饲养于徐州医科大学实验动物中心SPF级动物房。本研究已获徐州医科大学实验动物伦理委员会批准。
1.2 rCsHscB蛋白制备[12]
将PET-28a-CsHscB 质粒转化至E.coliBL21(DE3)中,用1 mmol/L异丙基-β-D-硫代吡喃半乳糖苷(IPTG)进行诱导表达,HisTrap FF 柱纯化,使用高效内毒素清除剂去除内毒素,经十二烷基硫酸钠⁃聚丙烯酰胺凝胶电泳(SDS⁃PAGE)电泳鉴定,BCA法测定蛋白浓度后于-80 ℃保存备用。
1.3 主要试剂及仪器
重组蛋白rCsHscB由本课题组前期重组合成,保存于-80 ℃冰箱。DSS(相对分子质量36 000~50 000)(MP Biomedicals);CD4/CD8 流式抗体(Biolegend);ELISA试剂盒(eBioscience);HE染色试剂盒(碧云天);Masson染色试剂盒(南京建成)。Anti-ERK1/2、Anti-p-ERK1/2 等抗体(CST)。流式细胞仪(FACS Canto II)(BD),全波长酶标仪(Synergy 2)(Bio-Tek)。
1.4 分组及造模
50只小鼠适应性饲养1 周后,按随机数字表法分为4 组:其中NC 组和rCsHscB 组每组10 只、DSS 组和DSS+rCsHscB组每组15只。NC组和rCsHscB组给予正常饮用水,DSS 组以及DSS+rCsHscB 组给予含有2%DSS的饮用水7 d,再给予正常饮水2周,此3周为1个循环,共进行4个循环;rCsHscB组和DSS+rCsHscB组每只小鼠在给予DSS 同一周的第4、7 天腹腔注射125 μg/mL rCsHscB(25 μg rCsHscB蛋白溶于200 μL无内毒素PBS),NC组和DSS组腹腔注射200 μL无内毒素PBS。实验期间密切观察小鼠体质量、精神状况及大便性状,于实验第84天处死全部小鼠。
1.5 样品采集
眼球采血,取全血行后续流式细胞实验;颈椎脱臼处死小鼠,分离全结肠,纵行切开并清除肠内容物,留取标本行组织病理学及蛋白检测;取全部小肠以备后续实验。
1.6 小肠固有层淋巴细胞(LPL)制备
将小肠浸泡于预冷的RPMI 1640培养基中,剥离肠系膜,去除派氏集合淋巴结,延纵轴剪开并冲洗干净,剪成1~1.5 cm 的组织块,置于含有DTT、DNAseI 和Liberase TL 的消化液中,37 ℃,190 r/min 震荡消化20 min,不锈钢滤网过滤,回收残余组织重复洗涤3次,用剪刀充分剪碎,置于含有PS,HEPES,Liberase TL和DNAseI的消化液中,37 ℃,190 r/min 震荡消化30 min,70 μm的细胞滤网收集细胞悬液,离心弃上清,用10 mL 47%的percoll重悬,4 ℃,1500 r/min,离心10 min,收集细胞沉淀,即为LPL,洗涤重悬后调整细胞浓度备用。
1.7 HE和Masson染色
取1 cm远端结肠,通过固定、脱水、透明后、进行石蜡包埋,切5 μm 厚度组织片,分别常规进行HE 和Masson染色,显微镜下观察。其中HE染色从炎症程度、隐窝损伤、隐窝脓肿、中性粒细胞和淋巴细胞浸润、粘膜下层水肿、上皮细胞增生和杯状细胞丢失6个方面进行评分[13-14]。Masson染色通过计算积分光密度,也就是胶原纤维占整个组织面积的比率即胶原纤维的面积百分比(%)来进行评价。
1.8 流式细胞术
取外周血细胞(先裂红)和LPL,分别加入antimouse CD4 FITC 和anti-mouse CD8 PE 抗体各1 μL,4 ℃避光孵育30 min,洗涤,上机检测,Flowjo软件分析数据。
1.9 ELISA检测细胞因子
称取100 mg结肠组织,加入600 μL细胞裂解液,充分匀浆,4 ℃,12 000 r/min,离心15 min,收集上清液,采用ELISA测定上清液中IL-6,MCP-1和IL-10的含量,具体操作严格按照试剂盒说明书进行。剩余上清使用BCA法检测蛋白浓度,行Western blot实验。
1.10 Western blot检测
将结肠组织匀浆上清加入5×loading buffer,混匀煮沸制成蛋电泳样品,每组各取30 μg蛋白进行SDSDAGE,常规转膜,BSA封闭,加入ERK1/2、p-ERK1/2、JNK、p-JNK,P38,p-P38和GAPDH抗体(分别按说明书稀释),4°C孵育过夜,加入二抗(1∶2000),室温孵育2 h,洗膜后加入ECL发光液显色,凝胶成像仪成像,使用Image J 软件对条带进行灰度值分析,计算磷酸化蛋白与总蛋白的比值。
1.11 统计方法
采用SPSS16.0软件进行统计分析,计量资料数据用均数±标准差表示,资料符合正态分布,多组间比较采用单因素方差分析,两两比较采用LSD检验;否则采用非参数检验。P<0.05为差异有统计学意义。
2 结果
2.1 rCsHscB对DSS诱导的慢性结肠炎小鼠一般状态及结肠长度的影响
实验期间,NC组和rCsHscB组小鼠精神状态良好,活动如常,饮食正常,皮毛光滑有光泽,体质量增加,两组小鼠结肠长度基本一致,差异无统计学意义;DSS组小鼠精神萎靡,活动欠佳,进食量减少,毛色欠光泽,体质量增加不明显,大多数小鼠出现腹泻、黏液脓血便,与NC 组相比,结肠长度明显缩短(P<0.001)。DSS+rCsHscB组较DSS组上述症状有所缓解,结肠长度明显变长,差异有统计学意义(P<0.001,图1)。

图1 各组小鼠体质量及结肠变化情况Fig.1 Changes in body weight (A) and colon length (B,C) of the mice in each group.**P<0.01,***P<0.001 vs the NC group,#P<0.05,###P<0.001 vs the DSS group.
2.2 rCsHscB减缓DSS诱导的小鼠慢性结肠炎病理损伤
rCsHscB组与NC组类似,小鼠结肠黏膜上皮结构完整,腺体排列规则,黏膜固有层内血管和纤维间质正常,无炎性细胞浸润,肌层无异常,评分无差异。DSS组小鼠结肠组织大量上皮细胞脱落,腺体隐窝结构破坏严重,黏膜及黏膜下层有大量炎性细胞浸润并伴明显组织水肿,评分显著增加(P=0.001)。DSS+rCsHscB组小鼠上皮结构相对较完整,腺体隐窝排列较整齐、炎性细胞浸润减少,与DSS组相比,评分显著下降(P=0.001,图2)。

图2 结肠组织HE染色及评分Fig.2 HE staining(A)and scoring(B)of the colon tissue(Original magnification:×10).**P<0.01 vs the NC group,##P<0.01 vs the DSS group.
2.3 rCsHscB改善DSS诱导的小鼠慢性结肠炎中胶原纤维沉积
与NC组相比,DSS组可见大量蓝染的胶原纤维沉积于黏膜层和粘膜下层,胶原纤维所占比例显著增加(P=0.006);DSS+rCsHscB组也可见一定量散在的胶原纤维沉积在上述区域,但相对于DSS组明显减少,差异有统计学意义(P=0.001);而rCsHscB组小鼠未见上述现象(图3)。

图3 结肠组织Masson染色及结果分析Fig.3 Masson staining(A)and scoring(B)of the colon tissue(×10).**P<0.01 vs NC group,##P<0.01 vs DSS group.
2.4 rCsHscB 对DSS 诱导的慢性结肠炎小鼠血清中CD4+T、CD8+T细胞比例影响
与NC组相比,rCsHscB组CD4+T细胞、CD8+T细胞及CD4+T/CD8+T细胞均没有明显变化;DSS组CD4+T细胞比例增多(P=0.03),CD4+T/CD8+T细胞比值升高(P=0.03),差异具有统计学意义;与DSS组相比,DSS+rCsHscB 组CD4+T 细胞比例降低(P=0.02),CD4+T/CD8+T细胞比值降低(P=0.04,图4)。

图4 各组小鼠外周血中CD4+T、CD8+T细胞表达水平变化Fig.4 Levels of CD4+T and CD8+T cells in the peripheral blood of the mice in each group.*P<0.05 vs the NC group,#P<0.05 vs the DSS group.
2.5 rCsHscB 对DSS 诱导的慢性结肠炎小鼠LPL 中CD4+T、CD8+T细胞影响
与NC 组相比,rCsHscB 组LPL 中CD4+T 细胞,CD8+T细胞及CD4+T/CD8+T细胞比值没有明显变化,DSS组CD4+T细胞比例增多(P=0.008),CD8+T细胞比例虽有降低,但无显著性差异(P=0.08),CD4+T/CD8+T细胞比值升高,差异具有统计学意义(P=0.002)。与DSS 组相比,DSS+rCsHscB 组CD4+T 细胞比例降低(P=0.02),CD8+T细胞比例升高,但差异无统计学意义(P=0.20),CD4+T/CD8+T细胞比值降低(P=0.03,图5)。

图5 各组小鼠LPL中CD4+T和CD8+T细胞表达水平变化Fig.5 Levels of CD4+T and CD8+T cells in lamina propria gastric lymphocytes(LPL) of the mice in each group.**P<0.01 vs NC group,#P<0.05 vs DSS group.
2.6 rCsHscB对DSS诱导的慢性结肠炎小鼠结肠匀浆上清中细胞因子的影响
ELISA结果显示,rCsHscB组与NC组相比,IL-6、MCP-1和IL-10均无明显变化;DSS组与NC组相比,IL-6(P<0.001)和MCP-1(P=0.002)含量明显升高,差异具有统计学意义,IL-10变化无显著性差异(P=0.11);与DSS组相比,DSS+rCsHscB组IL-6(P<0.001)和MCP-1(P=0.005)含量明显降低,IL-10 含量明显上升(P=0.003,图6)。

图6 各组小鼠结肠组织匀浆上清中细胞因子表达变化Fig.6 Levels of cytokines in the colon homogenate of the mice in each group.**P<0.01,***P<0.001 vs NC group,##P<0.01,###P<0.001 vs DSS group.
2.7 rCsHscB对DSS诱导的慢性结肠炎小鼠结肠组织中MAPK信号通路的影响
与NC组相比,rCsHscB组ERK1/2、JNK、P38的磷酸化水平并未升高;而DSS组小鼠ERK1/2(P=0.006)、JNK(P<0.001)、P38(P<0.001)的磷酸化水平显著升高,与NC 组相比有显著性差异;与DSS 组相比,DSS+rCsHscB 组ERK1/2(P=0.02)、JNK(P=0.001)、P38(P=0.002)的磷酸化水平显著降低(图7)。
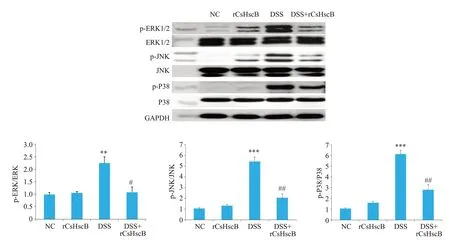
图7 各组小鼠结肠组织中MAPK信号通路蛋白表达情况Fig.7 Expression of the proteins in the MAPK signal pathway in the colon tissue of the mice in each group.**P<0.01,***P<0.001 vs NC group,#P<0.05,##P<0.01 vs DSS group.
3 讨论
DSS诱导的慢性结肠炎模型持续时间长,伴有急性向慢性转化的动态过程,是研究肠道慢性炎症较为理想的动物模型[15-16]。本实验为模拟慢性结肠炎的发生和发病过程,采用了4个周期的DSS诱导小鼠的慢性结肠炎模型,通过小鼠一般状态、结肠组织病理学(HE染色)及胶原纤维检测(Masson染色)等指标,表明本研究使用的模型构建成功。模型小鼠腹腔注射rCsHscB后,精神状态、体质量下降、腹泻便血、结肠长度、结肠组织病理学及肠道纤维化等出现明显改善,表明华支睾吸虫rCsHscB对DSS诱导的慢性结肠炎具有明显的预防改善作用;而正常小鼠腹腔注射rCsHscB后,并未出现炎症性病变及其他相关症状,可认为rCsHscB对小鼠不会造成不良作用。
在人体正常的炎性反应中,免疫细胞会选择性地激活CD8+T细胞,而对于UC患者而言,在整个免疫过程中会选择性地激活CD4+T细胞,处于活动期的UC患者CD8+T细胞数量明显下降,最终导致CD4+T/CD8+T细胞比值升高[17-18]。而T细胞的异常活化及比例失衡会过度释放具有多种致病作用的细胞因子和趋化因子,从而造成肠道组织损伤或炎症持久存在,这也是UC发病及病情活动的机制之一[19-22]。基于此,本研究分别采用流式细胞术和ELISA检测了T细胞的比例和细胞因子及趋化因子的分泌情况,结果显示,DSS 组小鼠无论是LPL,还是外周血之中,CD4+T比例升高,CD4+T/CD8+T细胞比值升高,结肠组织匀浆上清中细胞因子IL-6和MCP-1分泌水平明显升高,这可能是由于CD4+T细胞功能增强,CD8+T细胞活性受到抑制,大量促炎因子和趋化因子释放,促进B细胞分泌活跃,产生抗体,体液免疫反应亢进,进而激发补体系统,从而引发炎症反应[23-24]。rCsHscB 治疗后,这种比例失衡能够得到很大改善,CD4+T/CD8+T细胞比值明显降低,促炎因子IL-6及趋化因子MCP-1分泌明显减少,说明rCsHscB在一定剂量和疗程下能够调节DSS小鼠T细胞亚群的平衡,抑制促炎因子和趋化因子的表达,同时能够促进抑炎因子IL-10的释放,从而降低免疫反应程度,促进肠道黏膜修复,改善结肠炎症。
研究表明,细胞应激和大量炎性因子的释放能够激活胞内的MAPK家族信号通路,引发一系列的生物学改变,促使胶原蛋白表达增加,从而导致组织的纤维化[25-26];同时,MAPK通路可通过磷酸化级联反应激活下游的转录因子来调节细胞因子的分泌,进而参与炎症反应[27-28]。因此,本研究运用Western blot检测了ERK、JNK和P38蛋白,发现与DSS组相比,rCsHscB干预后ERK1/2、JNK 和P38 的磷酸化水平显著降低(P<0.05)。提示rCsHscB可能是通过抑制MAPK通路的激活减轻结肠组织的纤维化,同时下调促炎细胞因子的生成。有研究表明,山竺提取物(α-mangostin)能够通过抑制MAPK缓解DSS诱导的肠炎[29],同样,绿原酸也可通过MAPK/ERK信号通路抑制炎症因子产生从而改善DSS 诱导的急性溃疡性结肠炎[30-31]。上述研究表明MAPK在机体产生炎症反应中其重要的调节作用,可作为急、慢性结肠炎潜在治疗靶点。
综上所述,rCsHscB对DSS导致的小鼠慢性溃疡性结肠炎具有较好的改善作用,可能通过MAPK抑制促炎因子产生并调控CD4+T/CD8+T细胞平衡来发挥作用的,但其作用机制仍需要继续深入研究,以期为其进入临床实验提供相应依据。