含碘离子的氮杂环卡宾-二茂铁吡嗪环钯化合物的合成、表征及其催化合成联芳基邻二胺
2021-06-16丁丹丽李红梅蔡星伟
丁丹丽,徐 晨,李红梅,蔡星伟*
(1.江苏科技大学 环境与化学工程学院,镇江 212100) (2.江苏科技大学 国资处,镇江 212100)
芳基邻二胺类化合物是一类重要的化工原料,广泛用于氮杂环化合物合成、药物化学、染料、助剂等方面[1-2].例如,苯并咪唑类化合物的经典合成方法就是采用邻苯二胺与羰基衍生物的缩合反应[3-4],许多苯并咪唑类药物中间体为提高活性在苯环上引入芳基,因此就需要使用联芳基邻二胺类化合物.目前邻芳基二胺的种类虽然很多,但联芳基二胺还很少见,仅有一篇文献报道通过邻硝基苯胺卤代物的Suzuki反应和还原反应,两步制备4-联苯邻二胺[5].因为溴代芳基邻二胺是便宜易得的原料,文中设计通过钯催化芳基硼酸与其直接Suzuki反应,一步得到4-联芳基邻二胺,省去硝基还原步骤,有效降低原料成本和污染物排放,为合成联芳基邻二胺提供了一个高效实用的方法.
自文献[6]首次报道NHCs钯化合物及其催化反应以来,各种各样的NHCs配体及其金属络合物被合成,并作为催化剂广泛应用于有机合成中[7-9].这些新催化剂的不断出现,使Suzuki反应取得长足发展,现已成为碳碳键形成的重要合成手段.其中,环钯化合物是一类重要的催化剂,具有稳定,易于制备、修饰、催化活性高等优点[10].例如,环钯二聚体可以通过解聚反应引入NHCs配体生成高活性的NHCs-环钯合物[11-13].一般认为这类环钯化合物的催化活性主要受引入的配体和环钯配体的影响[14],而阴离子X对催化活性的影响研究很少.基于以上考虑,文中通过含氯离子的NHCs-二茂铁吡嗪环钯化合物2-3的离子交换反应,合成出两个新的对应含碘离子的钯化合物4-5(图 1),比较了它们在Suzuki反应中的催化活性.环钯化合物5是溴代邻芳基二胺与芳基硼酸Suzuki反应的高效催化剂,合成出一系列联芳基邻二胺类化合物.
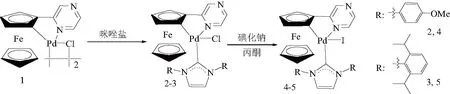
图1 化合物4-5的合成
1 实验
1.1 试剂和仪器
二茂铁吡嗪环钯化合物1-3按文献[15]报道的方法合成,其他所用化学试剂均为市售商品.所用仪器:Nicolet-560型红外光谱仪、Bruker Avance 400MHz核磁共振谱仪、电喷雾质谱Agilent LC/MSD Trap XCT质谱仪.Bruker SMART 1000 CCD单晶衍射仪,采用石墨单色化的Mo Kα(λ=0.710 73 Å)辐射,结构分析程序为SHELXL-97.化合物4和5的CCDC号分别是1938187和1965013.
1.2 化合物4和5的合成和表征
向单口烧瓶中加入化合物2或3(0.1 mmol)和碘化钠(0.2 mmol),然后加丙酮(10 ml),室温搅拌1 h.蒸除溶剂,洗涤,干燥即得产物4或5.4为红色固体,产率96%, IR (KBr, cm-1): 3 053, 2 928, 2 316, 2 048, 1 731, 1 589, 1 510, 1 440, 1 372, 1 318, 1 246, 1 169, 1 140, 1 030, 910, 832, 691, 642, 537. MS (EI, 70 eV)m/z= 649.1 (M-I)+.1H NMR (400 MHz, CDCl3): δ8.97 (s, 1H, Ar-H), 8.38 (s, 1H), 8.29-8.34 (m, 3H), 7.79 (d, 2H), 7.42 (s, 1H), 7.36 (s, 1H), 7.13 (d, 2H), 6.85 (d, 2H), 4.53 (s, 1H), 4.23 (s, 1H), 3.81 (s, 3H), 3.74 (s, 3H), 3.51 (s, 5H), 3.42 (s, 1H). 5为红色固体, 产率93%, IR (KBr, cm-1): 2 959, 2 923, 2 866, 1 733, 1 693, 1 589, 1 506, 1 460, 1 382, 1 324, 1 238, 1 141, 1 119, 1 106, 1 035, 936, 800, 756, 731, 698, 658, 607, 550. MS (EI, 70 eV)m/z= 757.2 (M-I)+.1H NMR (400 MHz, CDCl3): δ 9.59 (s, 1H), 8.36 (s, 1H), 8.08 (s, 1H), 7.47-7.49 (d, 2H), 7.19-7.35 (d, 6H), 4.57 (d, 1H), 4.32 (s, 1H), 3.97 (s, 1H), 3.39 (s, 5H), 2.93-2.96 (m, 4H), 0.54-1.70 (m, 24H).
1.3 催化反应合成联芳基邻二胺
氮气气氛下向Schlenk试管中加入溴代芳基邻二胺 (0.5 mmol)、芳基硼酸 (0.6 mmol) 、碱 (0.75 mmol) 和对应的催化剂,继续加入溶剂3 ml.油浴加热到110oC,12 h后冷却反应液,加水萃灭反应,用二氯甲烷萃取3次,合并有机层,旋转蒸发除去溶剂.以二氯甲烷/石油醚(1/1)作为洗脱剂,残留物通过硅胶薄层色谱提纯,收集第三带,得到偶联产物.产物6是已知化合物[5],其他产物是新化合物,表征数据如下:
化合物7: Anal Calcd for C14H16N2: C, 79.2; H, 7.6; N, 13.2. Found: C, 79.5; H, 7.2; N, 13.5. MS (EI, 70 eV)m/z= 213.1 (M+H)+.1H NMR (400 MHz, CDCl3): δ 7.75 (d, 1H), 7.62 (d, 1H), 7.45 (d, 2H), 7.42 (m, 1H), 7.25 (d, 2H), 6.31 (br, 4H), 2.65 (q, 2H), 1.26 (t, 3H).
化合物8: Anal Calcd for C14H16N2: C, 79.2; H, 7.6; N, 13.2. Found: C, 79.6; H, 7.3; N, 13.4. MS (EI, 70 eV)m/z= 213.1 (M+H)+.1H NMR (400 MHz, CDCl3): δ 7.42 (s, 1H), 7.21 (s, 1H), 6.86 (s, 1H), 6.82 (m, 1H), 6.77 (s, 1H), 6.55 (d, 1H), 5.65 (br, 4H), 2.32 (s, 6H).d
化合物9: Anal Calcd for C13H14N2O: C, 72.9; H, 6.6; N, 13.1. Found: C, 72.6; H, 6.4; N, 13.5. MS (EI, 70 eV)m/z= 215.1 (M+H)+.1H NMR (400 MHz, CDCl3): δ 7.23 (m, 1H), 7.10 (m, 1H), 7.05 (s, 1H), 6.87 (d, 1H), 6.78 (d, 2H), 6.57 (d, 1H), 4.82 (br, 4H), 3.80 (s, 3H).
化合物10: Anal Calcd for C12H11N3O2: C, 62.9; H, 4.8; N, 18.3. Found: C, 62.6; H, 4.6; N, 18.5. MS (EI, 70 eV)m/z= 230.1 (M+H)+.1H NMR (400 MHz, CDCl3): δ 8.46 (s, 1H), 8.17 (d, 1H), 7.94 (d, 1H), 7.76 (s, 1H), 7.62 (m, 2H), 7.48 (d, 1H), 3.68 (br, 4H).
化合物11: Anal Calcd for C11H11N3: C, 71.3; H, 6.0; N, 22.7. Found: C, 71.1; H, 5.8; N, 23.2. MS (EI, 70 eV)m/z= 186.1 (M+H)+.1H NMR (400 MHz, CDCl3): δ 7.67 (s, 1H), 7.62 (m,2H), 7.59 (s, 1H), 7.46 (m, 2H), 7.37 (s, 1H), 4.63 (br, 4H).
化合物12: Anal Calcd for C13H15N3: C, 73.2; H, 7.1; N, 19.7. Found: C, 73.5; H, 7.3; N, 19.5. MS (EI, 70 eV)m/z= 214.1 (M+H)+.1H NMR (400 MHz, CDCl3): δ 7.87 (s, 1H), 7.40 (m, 2H), 7.26 (m, 2H), 7.10 (s, 1H), 3.65 (br, 2H), 2.67 (q, 2H), 1.25 (t, 3H).
化合物13: Anal Calcd for C13H15N3: C, 73.2; H, 7.1; N, 19.7. Found: C, 72.0; H, 7.5; N, 19.9. MS (EI, 70 eV)m/z= 214.1 (M+H)+.1H NMR (400 MHz, CDCl3): δ 7.88 (s, 1H), 7.11 (s, 3H), 6.96 (s, 1H), 4.36 (br, 4H), 2.36 (s,6H).
化合物14: Anal Calcd for C12H13N3O: C, 67.0; H, 6.1; N, 19.5. Found: C, 67.3; H, 5.9; N, 19.3. MS (EI, 70 eV)m/z= 216.1 (M+H)+.1H NMR (400 MHz, CDCl3): δ 7.89 (s, 1H), 7.29 (d, 1H), 7.09 (m, 2H), 7.00 (s, 1H), 6.86 (d, 1H), 4.50 (br, 4H), 3.85 (s, 3H).
化合物15: Anal Calcd for C11H10N4O2: C, 57.4; H, 4.4; N, 24.3. Found: C, 57.7; H, 4.2; N, 24.6. MS (EI, 70 eV)m/z= 231.1 (M+H)+.1H NMR (400 MHz, CDCl3): δ 8.35 (s, 1H), 8.15 (d, 1H), 7.94 (d, 1H), 7.83 (d, 1H), 7.57(d , 1H), 7.16 (s, 1H), 4.40 (br, 4H).
化合物16: Anal Calcd for C12H13N3: C, 72.3; H, 6.6; N, 21.1. Found: C, 72.5; H, 6.2; N, 21.4. MS (EI, 70 eV)m/z= 200.1 (M+H)+.1H NMR (400 MHz, CDCl3): δ 7.44 (s, 2H), 7.22 (s, 4H), 6.86 (s, 1H), 3.99 (br, 4H), 2.27 (s, 3H).
2 结果与讨论
2.1 化合物4和5的结构表征
含碘离子的NHCs-二茂铁吡嗪环钯化合物4和5性质稳定,对空气和水汽不敏感.它们易溶于二氯甲烷、乙酸乙酯等常见溶剂,不溶于石油醚、正己烷.它们的氢谱与结构一致,质谱的分子离子峰以(M-I)+的形式出现.为准确确定它们的详细结构,对其进行单晶X-衍射测定.化合物4和5的晶体结构如图2,3,化合物4主要的键长(Å)和键角(°)如下:Pd(1)-C(1) 1.917(11), Pd(1)-C(19) 1.983(10), Pd(1)-N(3) 2.117(8), Pd(1)-I(1) 2.663 0(12) 和 C(19)-Pd(1)-C(1) 92.5(15), C(1)- Pd(1)-I(1) 90.3(3), I(1)-Pd(1)-N(3) 95.8(2), N3(1)-Pd(1)-C(19) 81.5(4),化合物5主要的键长(Å)和键角(°)如下:Pd(1)-C(68) 1.977(13), Pd(1)-C(48) 1.977(16), Pd(1)-N(1) 2.161(12), Pd(1)-I(2) 2.691(2) 和 C(68)-Pd(1)-C(48) 90.9(6), C(48)- Pd(1)-N(1) 80.0(6), N(1)-Pd(1)-I(2) 91.4(4), I(2)-Pd(1)-Cl(68) 97.3(4),每个晶胞有两个独立分子,为简洁清晰,仅保留一个独立分子.两个环钯化合物中的钯都是四配位,钯处于平行四边形的配位环境中心[12-16],NHCs中配位的C对应于环钯配体吡嗪配位的N,都是trans型环钯化合物.环钯五元环与相邻二茂铁环和吡嗪环是近似共面的,而NHCs的咪唑环是近似垂直于环钯平面.
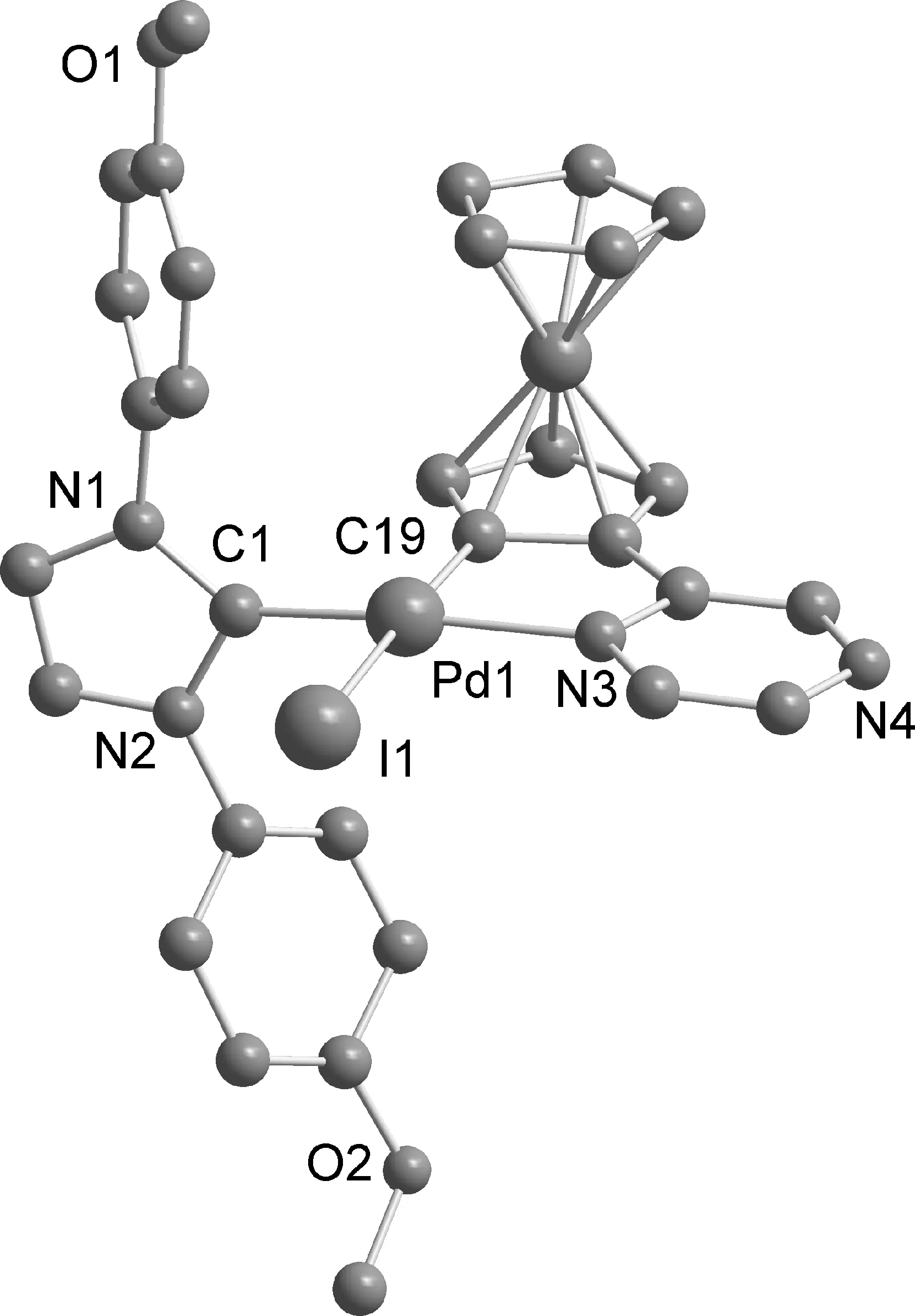
图2 化合物4的晶体结构
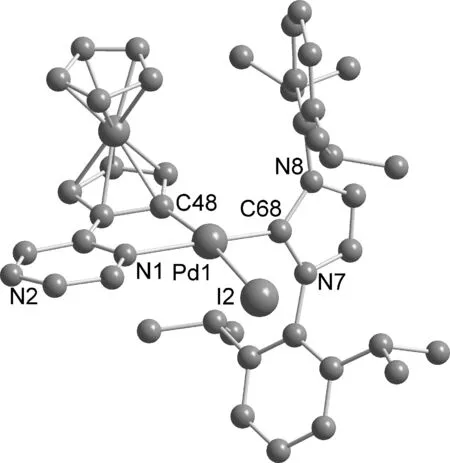
图3 化合物5的晶体结构
化合物5中的Pd(1)-C(68)键长[1.977(13) Å]明显长于化合物4中的Pd(1)-C(1)的键长 [1.917(11) Å],这是化合物5中NHC配体的位阻大造成的[13,15].化合物4的晶体中,碘离子与相邻分子中的茂环和吡嗪环上的氢形成分子间C-H…I氢键[17-18],键长分别是2.963 Å 和3.042 Å,呈一维链状结构(图4),而化合物5中的碘离子没有形成氢键.
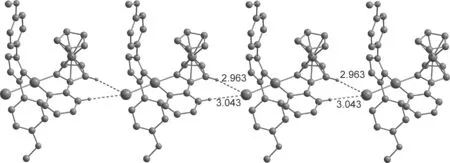
图4 化合物4通过C-H…I氢键形成的一维链状结构
2.2 催化反应
Suzuki反应能兼容很多官能团,一般卤代芳烃含致钝基团有利于反应,含致活基团不利于反应[17].含强致活基团氨基的卤代芳烃的Suzuki反应虽有报道[19-20],但含两个邻位氨基的卤代芳烃的Suzuki反应还未见报道.鉴于NHCs-环钯化合物在偶联反应中的广泛应用,合成NHCs-二茂铁吡嗪环钯化合物4和5,以期实现溴代芳基邻二胺与芳基硼酸的Suzuki反应.
首先选择4-溴邻苯二胺与苯基硼酸的反应作为模板反应,基于以前的相关工作基础,以甲苯为溶剂,K2CO3为碱的条件下考察环钯化合物1-5的催化活性.在110oC下反应12 h,催化剂用量0.5 mol %,反应结果列于表1.可以看出环钯二聚体1对反应基本没有活性,化合物2和4对反应活性很低,只有化合物3和5能较好的催化反应,偶联产物6的产率分别是72%和77%(编号3和5).此外,还考察用钯源/咪唑盐的催化体系,在相同的反应条件下,钯和咪唑盐配体的催化剂用量分别是1 mol%和2 mol%,Pd(OAc)2体系的产率较低,化合物1催化的体系能达到中等的产率,这说明环钯二聚体1是一个很好的钯源,化合物3和5中含有的对应大位阻卡宾配体是催化剂关键的配体.接着选择Cs2CO3为碱,考察化合物3和5在甲苯和二氧六环溶剂中催化上述模板反应,结果都显示含碘离子的NHCs-二茂铁吡嗪环钯化合物5的催化活性稍高于对应的含氯离子的环钯化合物3,其中以Cs2CO3为碱和甲苯为溶剂的效果最好(编号9).
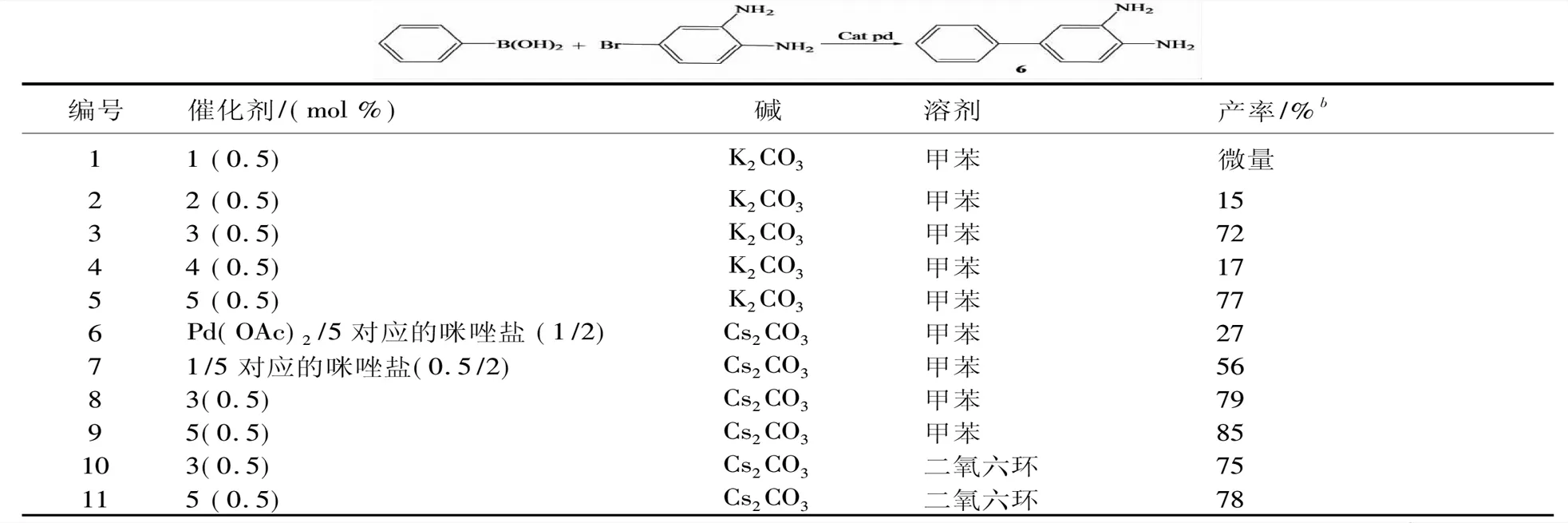
表1 4-溴邻苯二胺与苯基硼酸Suzuki反应条件的优化a
在优化条件[Cs2CO3,甲苯,110oC,5]下,扩展反应底物,其结果列于表2.此条件下,4-溴邻苯二胺与芳基硼酸都能以较高产率生成对应的联芳基邻二胺产物.例如,带致活基团的对乙基苯硼酸、3,5-二甲基苯硼酸和3-甲氧基苯硼酸为底物,偶联产物7-9的产率分别是89%、88%和86%.带致钝基团的对硝基苯硼酸,产物10的产率(62%)明显减低,这表明芳基硼酸上取代基的电子效应对反应有影响,带致活基团的底物的产率要高于致钝基团的.接着扩展卤代芳烃为卤代氮杂环,测试溴代吡啶二胺与芳基硼酸的反应,与4-溴邻苯二胺相比,反应的产率都有所提高,产物11-15产率分别是87%、92%、90%、89%和67%,这说明溴代吡啶二胺的反应活性大于对应溴代邻苯二胺,有利于反应进行.最后也考察了位阻效应对反应的影响,溴代吡啶二胺与邻甲基苯硼酸反应(产物16)的产率降至71%,这说明位阻效应不利于反应.

表2 化合物5催化芳基硼酸与溴代芳基邻二胺的Suzuki反应a
3 结论
(1)通过离子交换反应,可便捷合成含碘离子的NHCs-二茂铁吡嗪环钯化合物4和5,经单晶X-衍射发现,化合物4的I离子形成氢键,而化合物5的碘离子没有形成氢键.
(2)反应结果表明,大位阻NHCs-二茂铁吡嗪环钯化合物3和5的催化活性最好,其中含碘离子的环钯化合物5催化活性稍高于对应的氯离子的环钯化合物3.
(3)以甲苯为溶剂、Cs2CO3为碱、110oC下,化合物5能高效催化溴代芳基邻二胺与芳基硼酸的Suzuki反应,合成出一系列联芳基邻二胺类化合物,其中溴代吡啶二胺是好的反应底物,芳基硼酸带致活基团有利于反应.该反应体系提供了一个有效合成联芳基邻二胺的方法.
