坏死性凋亡在细菌与宿主相互作用中的机制研究进展
2021-06-16董科迪朱渊邓奇峰吴淑燕黄瑞
董科迪,朱渊,邓奇峰,吴淑燕,黄瑞
苏州大学医学部基础医学与生物科学学院,江苏苏州 215123
细胞死亡是机体在生理环境下胚胎发育和组织更新过程中的正常现象,但当受到一些外界刺激后也是应对损伤的一种病理反应。细胞死亡可分为意外细胞死亡(accidental cell death,ACD)和调节性细胞死亡(regulated cell death,RCD),其中发生在生理条件下的RCD也被称为程序性细胞死亡(programmed cell death,PCD)。ACD是一种极端的物理、化学或机械因素引起细胞质膜破裂,几乎是瞬间发生的不可逆细胞死亡形式;RCD则是涉及多种效应分子参与的可调控信号级联反应。细胞凋亡(apoptosis)是为维持内环境稳定,由基因控制的细胞自主死亡。早期研究认为只有凋亡才受到特定程序调控,将细胞凋亡的概念错误地等同于PCD,以区分于当时细胞坏死的概念,即ACD[1-2]。然而,后续研究发现并定义了多种呈现坏死形态的RCD,如焦亡、坏死性凋亡、多聚腺苷二磷酸核糖聚合酶-1(poly(ADP-ribose)polymerase-1,PARP-1)依赖性程序性细胞死亡和铁死亡等[3]。
坏死性凋亡的发现可以追溯到1988年,Laster等[4]发现肿瘤坏死因子(tumor necrosis factor,TNF)不仅可以诱导细胞凋亡还可以导致细胞发生坏死。此后其他研究者经过大量筛选成功地用小分子化合物干预了TNF诱导的细胞坏死,表明这种细胞死亡方式是可以被诱导和调控的,曾用“programmed necrosis”(程序性凋亡)描述这种细胞死亡方式[5]。2012年细胞死亡命名委员会(Nomenclature Committee on Cell Death,NCCD)将其正式命名为necroptosis(坏死性凋亡)[6]。目前研究表明,坏死性凋亡在生理和病理条件下均可发生,如胚胎发育、急性肾损伤、心脏缺血/再灌注、中枢神经系统疾病和微生物感染等[7-8]。随着细胞死亡研究的深入,揭示了细菌侵入机体后引起的组织损伤和细胞坏死这一过程有多种RCD的参与。细胞的生死结局受到细菌和宿主两者相互作用的调控,决定感染进程和感染性疾病的结局。坏死性凋亡作为新发现的RCD之一,其在细菌感染领域的作用正逐步被揭开。本综述针对该方面的研究进展进行总结,期望为该领域的研究者提供参考资料。
1 坏死性凋亡(necroptosis)
坏死性凋亡是由丝氨酸-苏氨酸蛋白激酶受体相互作用蛋白(receptor interacting protein/receptor-interacting protein kinase,RIP/RIPK)调控的RCD。凋亡作为最早被发现和定义的RCD,其形态学特征是细胞皱缩,核染色质浓缩边集,膜起泡并形成凋亡小体。而发生坏死性凋亡的细胞具有类似坏死细胞的形态,如细胞体积增大、细胞器肿胀和细胞膜穿孔,最后细胞崩解[9]。细胞崩解释放胞浆内容物,引起损伤相关分子模式(damage associated molecular patterns,DAMPs)——白介素1α(interleukin-1α,IL-1α)、亲环蛋白A(cyclophilin A,CypA)、高迁移率族蛋白1(high-mobility group protein B1,HMGB1)、组蛋白、尿酸、ATP和线粒体DNA等释放[10]。在DAMPs中,由于CypA在较早阶段释放,HMGB1在后期释放,两者常分别用作坏死性凋亡早期和晚期检测的生物标记物[11]。DAMPs导致局部炎症细胞募集,表现为大量炎症细胞的浸润和激活,因此坏死性凋亡通常被认为是一种炎性的细胞死亡方式[12]。相比之下,凋亡由于膜结构相对完整而不引起机体显著的炎症反应,是一种免疫沉默形式的细胞死亡[13]。但也有研究发现,坏死性凋亡的后果不一定总是促炎的,也可通过消除产生细胞因子和炎性产物的细胞从而抑制炎症反应[14-15]。坏死性凋亡的启动是在RIPK1和不依赖RIPK1的其他因素刺激下,通过激活RIPK3继而由混合系列激酶结构域样蛋白(mixed lineage kinase domain-like,MLKL)参与的有序激活反应。坏死性凋亡分为依赖RIPK1的经典途径和不依赖RIPK1的非经典途径,可由TNF、FasL、干扰素(interferons,IFNs) 等细胞因子以及脂多糖(lipopolysaccharide,LPS)和双链RNA(double-stranded RNA,dsRNA)等病原微生物成分触发相关信号传导级联反应。
1.1 依赖RIPK1的经典途径
凋亡是依赖于半胱氨酸天冬氨酸蛋白酶(cysteinyl aspartate specific proteinase,caspase)家族介导的级联反应。caspase-8作为一个分子开关调控凋亡和坏死性凋亡等细胞死亡之间的平衡,其酶活性和蛋白支架功能决定着细胞执行死亡的方式[16]。TNF引起的肿瘤坏死因子受体1(tumor necrosis factor receptor 1,TNFR1)信号转导途径与细胞凋亡相关;但在caspase-8酶活性受抑制时也可诱导依赖RIPK1的坏死性凋亡[17]。经典的坏死性凋亡途径是RIPK1磷酸化后通过其RIP同型相互作用基序(RIP homotypic interaction motif,RHIM)与RIPK3作用,随后由RIPK3自磷酸化和激活,与RIPK1实现稳定的寡聚形成坏死小体(necrosome)[18]。活化后的RIPK3通过募集并磷酸化MLKL使其发生构象改变。MLKL寡聚化后被转移至质膜上形成孔道致膜破裂,最终引发细胞死亡。除较早发现的TNFR1受体外,其他同属于TNFR超家族的死亡受体,如TNF相关的凋亡诱导配体受体(TNF-related apoptosis-inducing ligand receptor,TRAILR)和Fas等也可引起经典途径的坏死性凋亡[19]。
1.2 不依赖RIPK1的非经典途径
非经典途径是指在不依赖RIPK1的其他因素刺激下引发的坏死性凋亡。除RIPK1外其他含有RHIM的分子,包括干扰素TIR结构域衔接蛋白(TIR domain-containing adaptor-inducing IFN-β,TRIF)和DNA依赖性干扰素调节因子激活剂(DNA-dependent activator of IFN-regulatory factors,DAI),它们也可通过其结构域与RIPK3相互作用引发下游事件,最终导致细胞发生坏死性凋亡。DAI也称为Z-DNA结合蛋白1 (Z-DNA binding protein 1,ZBP1),在干扰素受体(interferon receptor,IFNR)信号、病毒和细胞内源性左旋形态的核酸(Z-nucleic-acid)刺激下,可直接激活RIPK3触发DAI-RIPK3-MLKL介导的坏死性凋亡[20-22]。Toll样受体(Toll-like receptor,TLR)可以诱导TRIF-RIPK3-MLKL介导的坏死性凋亡,如细菌LPS和内体(endosome)中的dsRNA分别激活TLR3和TLR4后,通过TRIF进行RHIM依赖性相互作用激活RIPK3[23]。
依赖RIPK1和不依赖RIPK1的坏死性凋亡途径如图1所示。
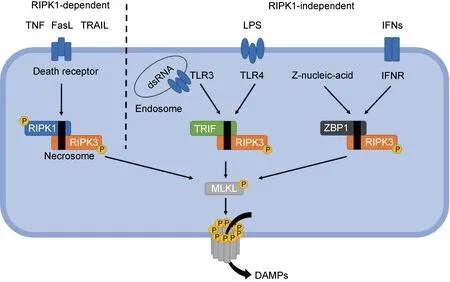
图1 依赖RIPK1和不依赖RIPK1的坏死性凋亡途径
2 细菌感染与细胞坏死性凋亡
细菌与宿主的相互作用,以及感染与机体抗感染免疫的相生相克,处于不断发生动态变化和平衡的状态。一方面细菌侵入机体后引起宿主组织和细胞的损伤,通过操纵细胞生死促进自身播散及免疫逃逸;另一方面宿主通过调节自身细胞死亡来清除受感染的细胞和触发抗感染免疫。病原微生物感染过程中存在多种细胞死亡方式,其中之一是坏死性凋亡。敲除坏死性凋亡的关键执行蛋白RIPK3或MLKL基因的小鼠在生理条件下均未见病理改变,但在感染过程中有不同于野生型小鼠的表型,如存活率、组织病变程度和细菌载量等[24]。
2.1 耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)
MRSA是临床上常见的毒性较强的化脓性细菌,主要通过接触传播引起皮肤感染,在某些情况下通过血流扩散至其他组织和脏器引起脓毒血症。MRSA入侵宿主后,中性粒细胞作为重要的固有免疫细胞最早吞噬病原菌。2014年Greenlee-Wacker等[25]首次报道了吞噬体内的MRSA诱发中性粒细胞坏死性凋亡。研究发现在小鼠模型中外毒素,如α溶血素(α-hemolysin,Hla)、多种白细胞毒素——LukAB与 PSMα等均可引起坏死性凋亡,是肺部炎症性坏死的主要因素。在体外巨噬细胞感染模型中,证实通过抑制RIPK1或MLKL信号传导及应用毒素突变株感染均可减少细胞死亡[26]。金黄色葡菌球菌染色体上编码的附属基因调节子(accessory gene regulator,agr)系统参与多种毒力因子的表达调控,包括Hla、LukAB和 PSMα等外毒素。2018年Zhou等[27]以毒力因子调控系统为靶点,通过使用agr抑制剂减轻了MRSA感染过程中坏死性凋亡所致的小鼠肺炎。然而,在感染过程中坏死性凋亡对宿主组织器官造成损伤的同时也可减轻病原菌引起的病理性炎症反应。在皮肤感染和败血症模型中,Kitur等[28]观察到Mlkl基因敲除小鼠和使用RIPK1或RIPK3抑制剂干预的小鼠体内细菌负荷增加,进一步研究发现坏死性凋亡通过限制MRSA诱导的过度炎症从而有利于机体维持对病原菌的清除功能。
2.2 结核分枝杆菌(Mycobacterium tuberculosis,Mtb)
Mtb是引起人类结核病的病原体,主要通过飞沫传播,以肺部感染多见,也可侵犯全身各器官系统。Mtb具有逃逸宿主免疫反应并在健康个体中持续存在的能力。Mtb能抑制巨噬细胞凋亡同时引发细胞坏死,以延迟由凋亡触发的适应性免疫和通过使巨噬细胞坏死以逃避固有免疫[29]。Lalita课题组在斑马鱼感染模型中发现,感染的巨噬细胞TNF信号被激活,产生活性氧(reactive oxygen species, ROS)介导对病原菌的抗性[30];但增强巨噬细胞杀伤活性的同时,过量的TNF会使巨噬细胞发生经典途径的坏死性凋亡,并将细菌释放到胞外有利于其生长的环境中[31]。Mtb感染也可引起人或小鼠巨噬细胞死亡,但与之前斑马鱼模型中Mtb引起坏死性凋亡有所不同,这一过程仅依赖RIPK3介导的线粒体功能障碍触发细胞坏死,而与RIPK1无关[32]。Stutz等[33]发现的结果与此相符,他们通过敲除MLKL的基因或使用RIPK1抑制剂,未能对感染的人或小鼠巨噬细胞死亡产生影响;经移植人的胚胎胸腺和造血干细胞后,具有人类固有免疫和适应性免疫系统的小鼠——免疫系统人源化小鼠感染结局也未发生改变。表明Mtb感染过程中坏死性凋亡信号传导被阻断,对宿主而言有利于减轻坏死性凋亡在结核病中引发的病理性损伤。
2.3 非伤寒沙门菌(non-typhoidal Salmonella,NTS)
NTS是主要的引起食源性腹泻的革兰阴性兼性胞内菌,引起人类和动物的沙门菌病。人感染后可发生急性胃肠炎,在免疫功能低下人群中还可导致肠道外侵袭性感染。机体的消化道肠上皮细胞作为肠黏膜屏障的重要组成部分,是抵抗病原菌侵入的门户。有研究表明,在鼠伤寒沙门菌引起肠炎过程中,坏死性凋亡抑制蛋白caspase-8可以防止肠上皮细胞坏死性凋亡发生,维持肠屏障功能以抵御病原菌入侵[34]。另外Hu等[35]发现,鼠伤寒沙门菌分泌蛋白B(Salmonellaouter protein B,SopB)通过调控肠上皮细胞坏死性凋亡有助于细菌从胞内释放并播散。沙门菌突破肠黏膜上皮屏障后主要遭遇巨噬细胞的吞噬和杀伤。有研究发现,与野生型小鼠相比,I型干扰素(type Ⅰ interferon,IFN-Ⅰ)受体缺陷小鼠感染鼠伤寒沙门菌后存活率更高,细菌利用宿主IFN-Ⅰ诱导巨噬细胞发生坏死性凋亡,从而逃避固有免疫反应[36-37]。另外,Young-Tae等[38]在巨噬细胞模型中发现,沙门菌感染过程中microRNA-155上调,靶向RIPK1和RIPK3促进巨噬细胞发生坏死性凋亡。由此可见肠上皮细胞和巨噬细胞发生坏死性凋亡有助于沙门菌播散和免疫逃逸。
2.4 单核细胞增生李斯特菌(Listeria monocytogenes,Lm)
Lm是一种自然界广泛分布的食源性致病革兰阳性菌。该菌可耐低温生长繁殖,常存在于冷藏食品中威胁人类健康。细菌通过机体消化道穿过肠屏障,经血到达肝脾乃至中枢神经系统和胎盘,引起败血症、急性肝损伤、脑膜炎和胎儿死亡等。体外巨噬细胞感染模型发现,李斯特菌成孔毒素(listeriolysin-O,LLO)可导致细胞发生坏死性凋亡[39]。小鼠感染模型发现,Lm可引起肝脏枯否细胞(Kupffer cells,KCs)发生坏死性凋亡,KCs的死亡随即招募单核细胞增殖分化为新的KCs替代死亡细胞和引发抗菌炎症反应[40]。虽然宿主可通过坏死性凋亡触发自我修复和抗菌反应,但这种死亡方式也导致肝损伤。Qian等[41]发现,Ripk1基因敲除小鼠可以通过减轻肝组织细胞坏死性凋亡、炎症和线粒体功能障碍等,从而缓解Lm引起的肝损伤。最近还有研究者发现,坏死性凋亡执行蛋白MLKL激活后不引起细胞坏死性凋亡,而是直接结合胞内Lm对其杀伤,说明在某些情况下宿主具有非依赖细胞死亡杀伤机制,是抵御外来病原菌的另一种防御策略[42]。
2.5 鼠疫耶尔森菌(Yersinia pestis,Yp)
Yp是烈性传染病鼠疫的病原菌,曾引起中世纪欧洲的“黑死病”,人与啮齿类感染动物接触或通过鼠蚤感染。细菌侵入机体后被巨噬细胞吞噬,在细胞内繁殖并沿淋巴管到达局部淋巴结,引起出血坏死性淋巴结炎,继而引发败血症。RIPK1作为激酶活化后可诱导细胞凋亡或坏死性凋亡[43]。Dan等[44]报道Yp可通过RIPK1、caspase-8和RIPK3导致凋亡和坏死性凋亡两种巨噬细胞死亡方式。在耶尔森菌感染过程中,依赖RIPK1的巨噬细胞凋亡促进细胞因子产生和抗菌反应从而有利于宿主抵抗病原菌[45]。坏死性凋亡的作用与凋亡相反,研究报道Yp外膜蛋白(Yersiniaouter protein J,YopJ)引起的巨噬细胞死亡可促进邻近细胞感染,同时检测到坏死小体形成以及磷酸化MLKL上调,证实了巨噬细胞发生坏死性凋亡。通过小鼠感染模型发现,巨噬细胞坏死性凋亡有利于Yp从胞内释放并在腹股沟淋巴结中播散[46]。
3 结语
坏死性凋亡对机体而言是一把“双刃剑”,既作为一种细胞死亡方式,又是宿主免疫防御的重要组成部分;对病原菌而言,其作用随感染的种类、入侵途径、菌量和时相等多种因素而异。坏死性凋亡的双重机制在抗感染时具有不同效应:一方面影响细菌引起的炎症、触发宿主自我修复和抗菌反应以清除病原菌;另一方面加重感染导致的病理性损伤和促进胞内菌释放播散。进一步探索坏死性凋亡机制及其相关蛋白的功能,以及与各种细胞死亡方式之间的关系,对认识和揭示感染性疾病的发生发展具有重要意义。
