一种非洲猪瘟病毒假病毒细胞感染模型的建立及应用
2021-06-16唐嘉怡蔡艳星王欣玲姜世勃陆路
唐嘉怡,蔡艳星,王欣玲,姜世勃,陆路
复旦大学基础医学院教育部/卫健委/医科院医学分子病毒学重点实验室,上海 200032
非洲猪瘟病毒(African swine fever, ASFV)是一种具有包膜结构的核质大DNA病毒(nucleocytoplasmic large DNA virus, NCLDV),隶属于非洲猪瘟病毒科(Asfarviridae),是该病毒家族的唯一成员,也是迄今为止发现仅有的虫媒DNA病毒[1]。ASFV可以通过直接接触、粪-口途径或者是天然宿主蜱虫在家猪或野猪之间快速传播[2-3],部分家猪感染后会出现出血热等症状,甚至引发急性死亡[4],此病原体引发的疾病被称为非洲猪瘟(African swine fever, ASF)。该动物疾病传染性极强,家猪或野猪感染烈性毒株后的死亡率接近100%[5-6],因此被世界动物卫生组织(World Organization for Animal Health, OIE)列为法定报告动物疫病(www.oie.int/),也是我国重点防范的动物疫情之一(http://www.moa.gov.cn/)。
2018年,中国出现了第一例非洲猪瘟病毒感染家猪的病例[7]。由于缺乏疫苗和抗病毒药物,能够控制疫情的方式主要是对疫区进行封锁,对疫区内的生猪进行扑杀[8]。此次的非洲猪瘟疫情对我国的国民生活质量、食品安全以及农业产业经济发展都造成了较大的危害。因此,开展对ASFV的感染机制、疫苗和抗病毒药物等研究具有重要意义。
ASFV能够在被污染的猪肉以及富含营养的环境中长久存在,具有极强的传播性[9],因此在我国对于ASFV活病毒的研究主要在生物安全三级(biosafety level 3,BSL-3)或四级(biosafety level 4,BSL-4)实验室中进行(http://www.moa.gov.cn/)。这在一定程度上限制了对于ASFV的研究,包括中和抗体等病毒入侵抑制剂的筛选。对于需要在BSL-3或BSL-4实验室中进行活病毒研究的病原体,如H7N9亚型禽流感病毒、尼帕病毒和中东呼吸综合征冠状病毒等,均已建立了成熟的假病毒(pseudovirus)细胞感染模型[10-12]。使用假病毒细胞感染模型可在生物安全等级较低的实验室中开展一些研究工作[13],包括病毒的进入机制、中和抗体评价以及入侵抑制剂的活性检测等[14-17]。而目前对于ASFV假病毒细胞感染模型的相关研究极少。
假病毒是一种重组的病毒颗粒,其核心骨架和包膜蛋白来源于不同的病毒[18]。通常会对假病毒的核心骨架基因进行突变或修饰,这种改变使得假病毒无法产生包膜或表面蛋白,须加入另外的可表达病毒包膜蛋白或表面蛋白(可介导病毒进入靶细胞的功能蛋白)的质粒,从而产生只可单轮感染的假病毒[19]。
目前常用的假病毒包装体系主要包括:I型人类免疫缺陷病毒(human immunodeficiency virus, HIV-1)包装体系、猴免疫缺陷病毒(simian immunodeficiency virus, SIV)包装体系和水疱口炎病毒(vesicular stomatitis virus, VSV)包装体系等[20]。假病毒包装系统中的核心骨架通常带有报告基因,如荧光素酶报告基因或荧光蛋白基因,假病毒感染细胞的程度与所带的报告基因表达成正比,因此相较于对真病毒(authentic virus),假病毒的感染定量分析更加简单、易于操作[21]。基于上述原理,假病毒细胞感染模型被广泛用于病毒的细胞嗜性[22]、进入机制、受体的发现以及中和抗体等入侵抑制剂的评价等研究。
为了能够包装获得可高效感染的ASFV假病毒细胞感染模型,本研究选取多种ASFV的包膜蛋白,包括p12、CD2v、p30、p54和pE248R,用于假病毒的包装及感染模型的建立。基于这5种包膜蛋白在病毒感染过程中的关键作用,构建表达5种包膜蛋白的真核表达质粒,应用较为广泛和高效的HIV-1包装体系和VSV假病毒包装体系尝试制备多种ASFV假病毒。通过假病毒感染细胞能力的检测,在VSV包装体系上获得1种感染能力较强的ASFV假病毒。以此为基础,建立能够稳定感染部分敏感细胞的ASFV假病毒细胞感染模型,并且用已报道[23]的能够在ASFV进入阶段发挥抗病毒作用的芫花素(Genkwanin)验证此假病毒细胞感染模型的可靠性。该模型有望用于通过检测所携带荧光基因的表达程度筛选药物对ASFV假病毒感染的抑制活性,为在安全级别要求较低的实验室中开展对ASFV生命周期中进入阶段的研究以及病毒入侵抑制剂研发提供候选模型。
1 材料与方法
1.1 实验材料
1.1.1 细胞系HEK 293T细胞(人源胚胎肾细胞)、Huh7细胞(人肝癌细胞系)、MDCK细胞(犬肾脏细胞系)均购买于中国科学院细胞库,Vero细胞(非洲绿猴肾细胞)和BHK21细胞(仓鼠肾细胞)购于American type culture collection(ATCC),RD细胞(人横纹肌瘤细胞)由上海市公共卫生临床中心提供。以上细胞均使用含10%(体积分数)胎牛血清(fetal bovine serum, FBS)的DMEM培养基(Dulbecco’s modified eagle medium)培养。
1.1.2 质粒真核表达非洲猪瘟包膜蛋白p30、CD2v、pE248R、p54、p12的质粒pcDNA3.1-p30、pcDNA3.1-CD2v、pcDNA3.1-pE248R、pcDNA3.1-p54、pcDNA3.1-p12购买于南京金斯瑞生物科技有限公司(所选取包膜蛋白来源毒株African swine fever virus isolate Pig/HLJ/2018,GENBANK NO. MK333180),质粒pNL4-3.Luc.R-E-[货号pNL4-3-Luc-R-E-(HIV-Luc)]购于ATCC,质粒pVKD-NA和pVKDA-HA由上海市金山公共卫生临床中心提供。
1.1.3 菌株与假病毒Top10感受态细胞由本实验室保存,Stable 3感受态细胞购自北京全式金生物技术有限公司,VSV-ΔG rLuc假病毒颗粒由Professor Benhur Lee惠赠。
1.2 实验方法
1.2.1 HIV-1包装体系制备非洲猪瘟病毒假病毒HIV-1包装体系常用于制备包膜病毒的假病毒。参考流感病毒、冠状病毒等假病毒的制备方式[10,12],在六孔板中使用含10%(体积分数)FBS的DMEM培养293T(3×105个/孔)细胞,待细胞生长密度达到60%时进行转染。使用不同的包膜蛋白质粒和pNL4-3.Luc.R-E-骨架质粒共同转染细胞,8 h后更换DMEM,细胞在37 ℃,5%(体积分数) CO2条件下继续培养48 h。收集上清液,并使用0.45 μm过滤膜(购买于Millipore)过滤,将假病毒分装于1.5 mL EP管中,-80 ℃条件保存。
1.2.2 VSV包装体系制备非洲猪瘟病毒假病毒参考尼帕病毒的假病毒制备方式[24-25],利用VSV体系包装ASFV假病毒。在六孔板中接种293T细胞(3×105个/孔),使用10%(体积分数)FBS的DMEM过夜培养。使用不同包膜蛋白质粒转染细胞,继续培养6 h。加入含有VSV包膜蛋白G蛋白的VSV-△G rLuc假病毒感染细胞,2 h后使用磷酸盐缓冲液(phosphate buffered saline,PBS)润洗细胞3次,弃去PBS加入10% FBS的DMEM培养基,继续培养48 h。收集假病毒后,-80 ℃保藏。
1.2.3 荧光素酶检测(luciferase assay)检测假病毒感染水平制备假病毒所使用的HIV-1骨架质粒pNL4-3.Luc.R-E-含有萤火虫荧光素酶报告基因,VSV-△G rLuc假病毒中含有海肾荧光素酶报告基因。感染细胞后,使用荧光素酶检测试剂盒(luciferase assay system,购自美国Promega)或海肾荧光素酶检测试剂盒(Renilla luciferase assay system,购自美国Promega)评价假病毒的感染水平。提前12~16 h在96孔板中培养Vero细胞或BHK21细胞(1×104个/孔),将保藏于-80 ℃冰箱中ASFV假病毒取出融化,震荡混匀。向细胞中加入100 μL假病毒液,37 ℃培养12 h。弃去上清液,每孔加入含体积分数1% FBS的DMEM培养基,继续培养48 h。根据荧光素酶检测试剂盒的说明书要求,检测相对发光单位(relative light unit,RLU)值。
1.2.4 ASFV假病毒抑制实验药物对于ASFV假病毒抑制活性的检测参考某些假病毒的抑制实验[17]。在96孔板上过夜培养Vero细胞(1×104个/孔)备用,将药物进行倍比稀释,并加入等体积的ASFV假病毒,37 ℃条件下共同孵育30 min。将药物与假病毒的混合液加入细胞中,将该孔记为药物孔,继续培养12 h。同时,将只加入等体积假病毒的孔,记为病毒孔;只含有细胞的孔记为细胞孔。弃去所有上清液,更换为含1% (体积分数)FBS的DMEM培养基,继续在37 ℃,5%(体积分数)CO2条件下培养48 h。利用luciferase assay检测病毒感染情况(RLU值),并计算药物的抑制率。计算公式:药物抑制率RDI(%)=(RLU病毒孔-RLU药物孔)/(RLU病毒孔-RLU细胞孔)×100%。在GraphPad Prism 6.0中通过不同浓度下药物抑制率生成函数曲线,并计算药物半数抑制浓度(half maximal inhibitory concentration, IC50)。
1.2.5 统计学方法所有结果均进行3次重复独立实验验证。数据分析使用GraphPad Prism 6.0,双总体t检验,P<0.05表明差异具有统计学意义。
2 结果
2.1 HIV-1包装体系制备ASFV假病毒
为了制备ASFV假病毒,本研究选取应用较为成熟和广泛的HIV-1包装体系,进行尝试。假病毒的制备方法,参考中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus, MERS-CoV)的假病毒包装方式[12]。首先,尝试使用不同的包膜蛋白质粒pcDNA3.1-p30、pcDNA3.1-CD2v、pcDNA3.1-pE248R、pcDNA3.1-p54以及pcDNA3.1-p12分别与HIV骨架质粒共同转染293T细胞,在已报道的可以被ASFV活病毒感染的Vero细胞上检测假病毒的感染能力。如图1A所示,使用不同包膜蛋白质粒制备的ASFV假病毒与细胞本底的荧光强度接近,而作为阳性对照的H7N9假病毒能够高效地感染靶细胞,表明所使用的HIV-1包装体系稳定,所制备的ASFV假病毒在所测条件下未表现显著的感染能力。提示使用单个包膜蛋白质粒和HIV-1包装体系较难制备出能够高效感染的ASFV假病毒。
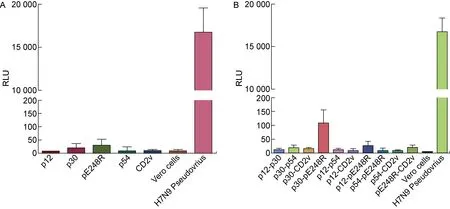
A: The HIV-1 packaging system with single plasmid encoding envelope protein for generating ASFV pseudovirus. To produce ASFV pseudovirus, single plasmid encoding different envelope proteins was transferred into 293T cells with pNL4-3.Luc.R-E-. The RLU corresponding to the infectivity of ASFV pseudovirus in Vero cells was measured. B: The HIV-1 packaging system with double plasmids encoding envelope protein for generating ASFV pseudovirus. To produce ASFV pseudovirus, dual plasmids encoding different envelope proteins was transferred into 293T cells with pNL4-3.Luc.R-E-. The RLU corresponding to the infectivity of ASFV pseudovirus in vero cells was measured.
随后,参考H7N9亚型禽流感病毒(Avian Influenza virus, AIV)的假病毒制备方式,尝试使用2种包膜蛋白质粒的不同组合与HIV-1骨架质粒共同转染293T细胞,从而产生ASFV假病毒。如图1B所示,使用表达p30和pE248R包膜蛋白的质粒所制备的ASFV假病毒的荧光强度虽略高于其余质粒组合所制备的假病毒,但在统计学上并没有显著差异,并且感染水平远低于H7N9假病毒(RLU>10 000)。现有的假病毒细胞感染模型中,RLU值大多能达到103以上[12,26],故使用以上方法制备的ASFV假病毒滴度较低,用于细胞感染或病毒抑制实验等可能出现不稳定的情况。然而,这个结果提示ASFV的包膜蛋白p30以及pE248R可能在ASFV感染Vero细胞过程中发挥着一定的作用。
2.2 VSV包装体系制备ASFV假病毒
VSV包装体系是最常见的假病毒体系之一,如尼帕病毒(Nipah virus, NiV)、埃博拉病毒(Ebola virus, EBOV)等可以在VSV包装体系上制备假病毒[11,27]。本研究参考NiV的假病毒包装方式[24-25],分别使用以上5种ASFV包膜蛋白质粒制备假病毒。含有VSV包膜蛋白G蛋白的VSV-△G rLuc感染细胞后,可能会掺入收获的假病毒中,在检测所制备的ASFV假病毒荧光强度时可能出现假阳性。因此,在转染细胞时设置转染空载质粒(pcDNA3.1)的阴性对照。如图2A所示,使用p30、pE248R和p54包膜蛋白分别转染细胞所获得的ASFV假病毒荧光强度略高于阴性对照,但与该背景RLU值差距不足3倍。在以前的研究中,使用VSV假病毒包装体系制备不同病毒的假病毒时,对照组与产生的假病毒RLU值相差均大于3倍[28],因此使用这3种包膜蛋白质粒单独包装的ASFV假病毒也难以感染细胞。此外,p12和CD2v两种包膜蛋白质粒分别制备的ASFV假病毒的荧光强度与阴性对照接近,可能是残留的VSV-△G rLuc假病毒所造成的假阳性。随后,选取5种包膜蛋白质粒中的2种进行组合,共同转染293T细胞以获得ASFV假病毒。如图2B所示,其中利用p30-p54、p30-pE248R和p54-pE248R这3种组合制备的假病毒感染Vero细胞后的RLU值均达到104以上。其中,p30和pE248R包膜蛋白质粒组合包装的假病毒在Vero细胞上的感染水平高于其他2组(P<0.001),表明利用此种方法可能获得更高效感染细胞的ASFV假病毒,可在此假病毒的基础上建立较为高效的ASFV细胞感染模型。随后,基于p30和pE248R质粒组合进行优化, 通过增加不同的包膜蛋白质粒共同转染细胞,尝试获得更高滴度的ASFV假病毒。如图2 C所示,使用3种包膜蛋白质粒制备的ASFV假病毒,滴度反而低于原先制备的ASFV假病毒(P<0.01或P<0.000 1)。以上结果显示,使用VSV包装体系以及p30、pE248R包膜蛋白质粒的组合制备方法,所包装出的假病毒可能具有较优的感染活性,适合用于建立细胞感染模型。
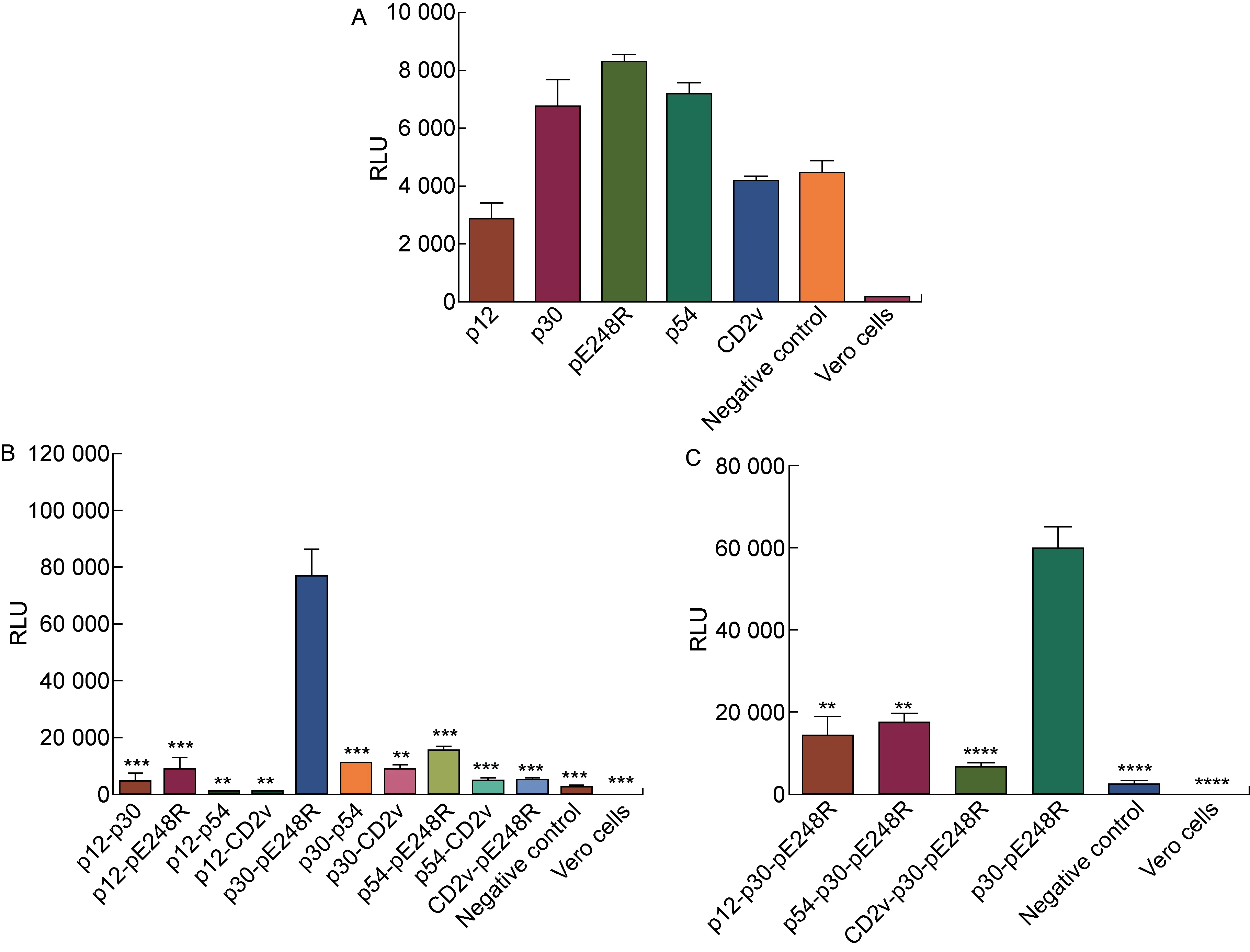
A: The VSV packaging system with single plasmid encoding envelope protein for generating ASFV pseudovirus. To produce ASFV pseudovirus, single plasmid encoding different envelope proteins was transferred into 293T cells, followed by the infection of VSV-G rLuc. The RLU corresponding to the infectivity of ASFV pseudovirus in Vero cells was detected. B: The VSV packaging system with double plasmids encoding envelope protein for generating ASFV pseudovirus. To produce ASFV pseudovirus, dual plasmids encoding different envelope proteins was transferred into 293T cells, followed by the infection of VSV-G rLuc. The RLU corresponding to the infectivity of ASFV pseudovirus in Vero cells was detected. C: The VSV packaging system with triple plasmids encoding envelope protein for generating ASFV pseudovirus. To produce ASFV pseudovirus, triple plasmids encoding different envelope proteins was transferred into 293T cells, followed by the infection of VSV-G rLuc. The RLU corresponding to the infectivity of ASFV pseudovirus in Vero cells was detected.
2.3 验证包膜蛋白在所制备ASFV假病毒上的表达
为验证所制备的ASFV假病毒是否能够表达包膜蛋白,选择其中1个包膜蛋白为代表,使用western blot(WB)检测其在假病毒上的表达情况。构建编码pE248R蛋白全长基因和His标签的质粒pcDNA3.1-pE248R-His。使用该质粒替代原有的pE248R包膜蛋白质粒,和p30包膜蛋白质粒共同转染细胞,在VSV包装体系上制备带有His标签的ASFV假病毒,并进行WB检测。如图3所示,使用抗His标签的抗体,在生成的ASFV假病毒中出现了对应pE248R蛋白的清晰条带。相反,在作为阴性对照的VSV-G 假病毒中未检测到pE248R蛋白的表达。这些结果提示,ASFV的包膜蛋白pE248R被有效整合到VSV-ΔG rLuc颗粒中,并包装出ASFV假病毒。
2.4 ASFV假病毒细胞感染模型的特异性
为进一步验证,所制备的ASFV假病毒(p30-pE248R-ASFV-PsV)可用于细胞感染模型的建立。在不同的细胞系上检测了该假病毒的感染水平,其中包括已报道[29-32]能被ASFV感染的细胞系:Vero细胞和BHK21细胞。如图4A所示, 在VSV包装体系上使用p30和pE248R包膜蛋白质粒所制备的p30-pE248R-ASFV-PsV能够感染已报道的非洲猪瘟敏感细胞系Vero细胞和BHK21细胞,且不感染RD细胞,具有一定的感染特异性(P<0.01或P<0.001)。如图4B所示,作为阳性对照的VSV-G假病毒能够感染所有用于检测的细胞系。此外,只转染了pcDNA3.1空载的阴性对照在感染不同细胞系后只有微弱的荧光素酶表达(见图4C),排除了多余的VSV-G假病毒对实验结果造成的影响。
MW: Relative molecular weight.
2.5 ASFV假病毒细胞感染模型用于药物抗病毒活性的评价
为了进一步验证该假病毒细胞感染模型是否可用于筛选具有抗ASFV活性的病毒入侵抑制剂,选择已报道[23]的阳性药物——芫花素(Genkwanin,该药物能够在非洲猪瘟活病毒感染Vero细胞的早期发挥抑制作用),检测其对所建立的ASFV假病毒(p30-pE248R-ASFV-PsV)的抑制活性。结果如图5所示,芫花素能够浓度依赖性地抑制ASFV假病毒感染Vero细胞,其半数抑制浓度(half maximal inhibitory concentration, IC50)为4.05±0.88 μmol/L。设置VSV-G假病毒作为阴性对照,芫花素无法抑制VSV-G假病毒感染Vero细胞,也反映出该ASFV假病毒细胞感染模型在ASFV入侵抑制剂活性评价和筛选中的可行性。
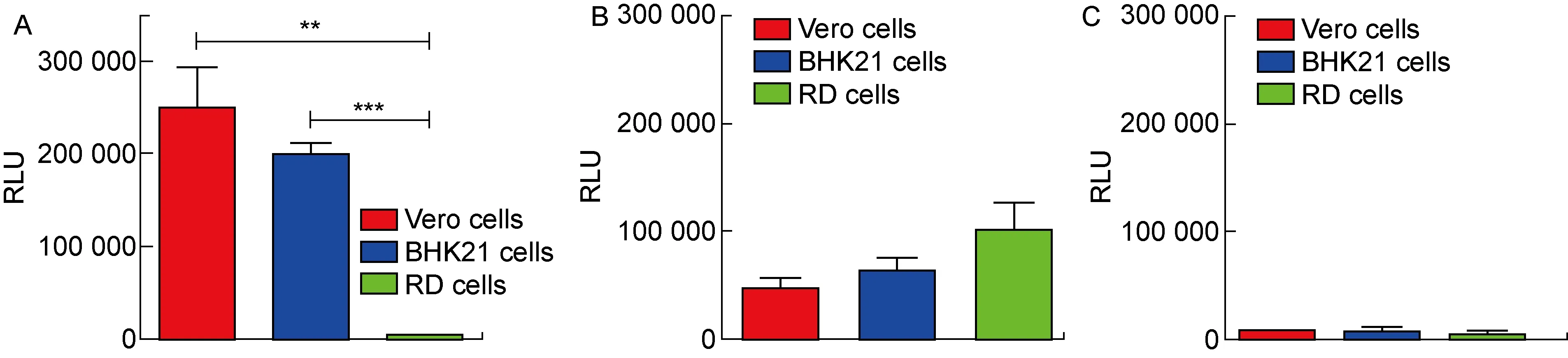
A: The ability of p30-pE248R-ASFV-PsV to infect different cell lines were determined. B: The ability of VSV-G pseudovirus to infect different cell lines. Different cell lines were infected by VSV-G as the positive control. C: The ability of negative control to infect different cell lines. Different cell lines were infected by the negative control which were generated by pcDNA3.1 and VSV packaging system. The difference between the ability of p30-pE248R-ASFV-PsV and other pseudoviruses to infect different cell lines was statistically analyzed by two-tailed unpaired Student’s t-test using GraphPad Prism, version 6.0. *** and ** mean P<0.001 and P<0.01, respectively. Values with P<0.05 was considered statistically significant.
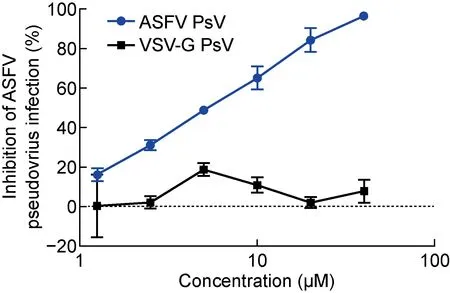
图5 芫花素对ASFV假病毒感染的抑制活性检测
3 讨论
自2018年亚洲地区暴发非洲猪瘟疫情,我国持续有疫情感染的病例报道(1)非洲猪瘟疫情通报在中华人民共和国农业农村部官网http://www.moa.gov.cn/。。迄今为止,全球没有获批的非洲猪瘟疫苗上市;我国也未有针对ASFV的预防或治疗药物获得批准。当前,从事ASFV活病毒的研究有严格的生物安全要求,须在生物安全三级及以上实验室中进行。因此,疫苗和药物的开发在一定程度上受到了限制。为了获得可在低安全级别实验室开展ASFV入侵机制和入侵抑制剂等药物研究的模型,本研究选取多种ASFV的包膜蛋白,包括 p12、CD2v、p30、p54和pE248R,用于假病毒的包装及感染模型的建立。这些蛋白在ASFV进入细胞的过程中发挥重要作用,例如位于外包膜上的p12蛋白能够与靶细胞Vero细胞的细胞膜结合[33-34],而同样位于外包膜上的CD2v蛋白能够与红细胞上的CD受体结合,从而完成病毒的吸附过程,并且增强ASFV在细胞间感染[35]。在研发非洲猪瘟疫苗的过程中发现,位于内包膜上的p30和p54蛋白能够刺激机体产生体液免疫和细胞免疫,具有良好的抗原性[36-37]。同时,有文献报道这两种蛋白能够与猪肺泡巨噬细胞结合,从而介导病毒的内化,因此推测p30和p54蛋白对于ASFV的感染可能是必须的[38]。ASFV使用内吞途径进入细胞,随后需要在内吞泡中完成病毒膜与内吞泡膜的融合,从而介导病毒的遗传物质释放于胞浆中,开启复制过程[39]。近期一项研究证明,位于内包膜上的pE248R是介导病毒内包膜与内吞泡膜融合的关键因子,pE248R缺失的重组病毒无法完成感染过程以及启动后续的基因组复制[40]。基于这5种包膜蛋白在病毒感染过程中的关键作用,本研究构建表达了包膜蛋白的真核表达质粒。利用ASFV的包膜蛋白质粒pcDNA3.1-p30、pcDNA3.1-pE248R和VSV包装体系成功制备ASFV假病毒,并初步建立细胞感染模型,此细胞感染模型或可进行病毒入侵抑制剂的筛选和活性评价。
本研究在尝试制备假病毒的过程中发现,使用HIV-1包装体系较难产生具有高感染力的ASFV假病毒。此前尝试制备汉坦病毒假病毒的研究中也出现类似现象:使用VSV包装体系能够产生较难通过HIV-1体系制备的汉坦病毒假病毒[41]。另外,在制备拉沙病毒假病毒的实验中也发现,使用VSV包装体系所产生的假病毒滴度高于HIV-1包装体系[42]。因此,推测本研究使用的VSV包装体系的包装效率高于HIV-1包装体系,这可能与HIV-1体系对包膜蛋白有较严格的选择性有关[20]。不过,VSV体系包装出的假病毒也不能认为可用于完全模拟活病毒的感染过程。有文献报道,骨架病毒的形状可能会影响构建相对应假病毒的适用性[41,43],VSV颗粒呈子弹状,与ASFV并不相似,假病毒糖蛋白的构象和分布可能无法模拟野生型活病毒的天然状态。因此,本研究中所制备的ASFV假病毒和细胞感染模型也可能具有局限性。与ASFV的其他包膜蛋白质粒相比,包膜蛋白质粒p30和pE248R可包装出滴度较高的ASFV假病毒。既有研究已证明p30蛋白是ASFV内化所必需的[38],而pE248R蛋白介导病毒膜与内吞泡膜的融合[39]。因此,本文推测病毒的内化和膜融合对于ASFV的感染十分关键,而p30和pE248R蛋白在其中扮演着重要的角色,这也提示在对ASFV进入机制研究时应关注这两个蛋白。
同时也发现,本研究所制备的假病毒对不同细胞系的感染能力存在差异。ASFV假病毒(p30-pE248R-ASFV-PsV)感染后,在Vero细胞上的荧光强度高于BHK21细胞。由于目前尚不清楚ASFV的细胞受体,无法确定该假病毒对于不同细胞系感染差异的原因。若能够深入探究2种细胞系之间的差异,或许能够为ASFV细胞受体的解析提供新思路。但是,本研究中所获得的ASFV假病毒是否可对原代细胞产生有效感染,以及其感染特征是否与ASFV活病毒相似,这些受限于伦理及BSL-3实验室等未开展研究。今后应做进一步研究,以明确该假病毒模型的局限性。
本研究对所建立的ASFV假病毒细胞感染模型,还检测了芫花素的抑制活性,其IC50为4.05±0.88 μmol/L,这与文献报道的芫花素对非洲猪瘟活病毒感染Vero细胞的抑制活性(IC50为2.9 μmol/L)相似[23]。这提示该ASFV假病毒细胞感染模型用于病毒入侵抑制剂抗ASFV活性的评价具有一定的可行性。但是否可用于抗ASFV药物的高通量筛选,以及与活病毒感染模型相比是否具有较高的一致性,还需要进一步的研究。
