抗原抗体复合物型治疗性疫苗(乙克)临床研究中患者血清乙型肝炎病毒表面抗原下降的分析与启示
2021-06-16宋洁玉单璞李树香仇超徐静汪萱怡闻玉梅
宋洁玉,单璞,李树香,仇超,徐静,汪萱怡, 3,闻玉梅
1. 复旦大学生物医学研究院暨教育部/卫生部医学分子病毒学重点实验室,上海 200032; 2. 国药中生生物技术研究院有限公司,北京 101111;3. 复旦大学附属儿科医院,上海 201102
乙型肝炎病毒(hepatitis B virus,HBV)感染所导致的慢性乙型肝炎(chronic hepatitis B, CHB)是一个全球性公共卫生问题, 多年来一直严重影响我国人民健康。自1985年血源预防性HBV疫苗进入中国,其后酵母重组HBV疫苗被引进,经过30年的努力,到2014年我国15岁以下人群中HBV表面抗原(HBV surface antigen,HBsAg)流行率从10%下降到<1%[1],一般人群中乙型肝炎流行率约为5%,由此推算慢性HBV感染者约有 7 000 万例,其中CHB患者高达2 000~3 000 万例[2],因此我国实现消除乙型肝炎的目标依然任重道远。
HBV感染人体后,在其生命周期中形成共价闭合环状DNA(covalently closed circular DNA,cccDNA),是高度稳定的病毒复制模板。目前临床使用的抗病毒药物,无论是核苷(酸)类似物还是聚乙二醇干扰素α(polyethylene glycol interferon α,Peg-IFN-α)均无法有效清除cccDNA。近年来,继实现长期抑制HBV复制和HBV e抗原(HBV e antigen,HBeAg)血清学转换后,全球各CHB防治指南均提出“功能性治愈”(functional cure)的概念,即经过治疗达到血清HBsAg消失。遗憾的是,现有抗病毒治疗长期使用后仅极少数患者(5%~13%)能实现HBsAg转阴[3]。因此,目标HBV生命周期的多个靶点的新药,特别是特异性清除HBV的治疗性疫苗研究备受瞩目。本研究通过数据挖掘,对既往临床试验中经抗原抗体复合物型治疗性HBV疫苗(乙克)治疗后的 CHB患者HBsAg水平下降情况进行归纳分析。
1 材料与方法
1.1 研究对象与方法
目前临床重视乙型肝炎的“功能性治愈”,因此本研究对乙克临床试验中患者血清HBsAg变化数据进行了分析。自2005年始,乙克在HBeAg阳性的初治CHB患者中开展了多项Ⅱ期与Ⅲ期临床试验,本研究选择研究方案相同的Ⅱb[4]与Ⅲb期临床试验中单用60 μg乙克或单用氢氧化铝佐剂的受试者作为研究对象。
受试者均为未经抗病毒药物治疗的CHB患者,需满足以下条件:① HBsAg阳性持续6个月以上;② HBeAg阳性且乙型肝炎e抗体(hepatitis B e antibody,HBeAb) 阴性;③ HBV DNA≥105copies/mL;④血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)是正常值上限的2~10倍。将以上患者按1∶1比例随机分配至乙克治疗组或氢氧化铝佐剂组,分别在第0(基线期)、4、8、12、16、20周时在上臂三角肌注射1剂试验药物,共计注射6剂,随访24周。在第0、4、8、12、16、20、24、32、44周采集血标本,检测肝功能(ALT),血清送中心实验室,用Abbott EIA AxSYM分析仪(Abbott,Abbott Park,IL,USA)检测HBsAg(定量)、HBeAg及HBeAb,用荧光定量聚合酶链反应(polymerase chain reaction,PCR)仪定量检测HBV DNA (PiJi,Shenzhen Co.;检测下限为500 copies/mL)。
1.2 统计学分析
采用符合方案集(per protocol set,PPS),定义为受试者符合入选和排除标准,完成至少5剂研究药物注射,以及第0、4、8、12、16、20、44周的随访。HBeAg血清学转换定义为血清HBeAg由阳性转为阴性并出现HBeAb,ALT骤升(ALT flare)定义为ALT>400 IU/mL。
首先,比较Ⅱb和Ⅲb期临床试验数据合并后乙克治疗组与氢氧化铝佐剂组受试者的基线均衡性;然后,以HBsAg下降均值、HBsAg下降>0.5log10IU/mL及HBsAg下降>1.0log10IU/mL三个指标比较乙克治疗组与氢氧化铝佐剂组之间第44周HBsAg的下降情况,并按HBeAg血清学转换进一步分层分析;最后,分析ALT flare与HBsAg下降的相关性。通过单因素分析和多因素Logistic回归模型,分析可能影响第44周HBsAg下降的基线因素,并计算比值比(odds ratio,OR)及其95%置信区间(confidence interval,CI)。使用SAS统计软件(SAS Institute Inc.,NC,USA),分类变量的分析采用卡方检验或Fisher精确法检验,连续型变量的分析采用t检验,对HBV DNA、HBsAg定量及HBeAg半定量数据在分析前进行对数转换,P<0.05为有统计学差异。
2 结果
2.1 研究对象的组成与基线均衡性
Ⅱb期临床试验中,60 μg乙克组与氢氧化铝佐剂组各入组78例CHB患者,评估后符合方案者均为70例(89.7%)(P>0.05);Ⅲb期临床试验中,60 μg乙克组与氢氧化铝佐剂组分别入组140例与137例CHB患者,其中符合方案者分别为106例(75.7%)与112例(81.8%)(P>0.05)。Ⅱb和Ⅲb期临床试验数据合并后,乙克组与氢氧化铝佐剂组之间患者年龄、性别、传播途径、HBV基因型,以及基线ALT、HBsAg、HBV DNA和HBeAg水平均无统计学差异,均衡性较好(见表1)。
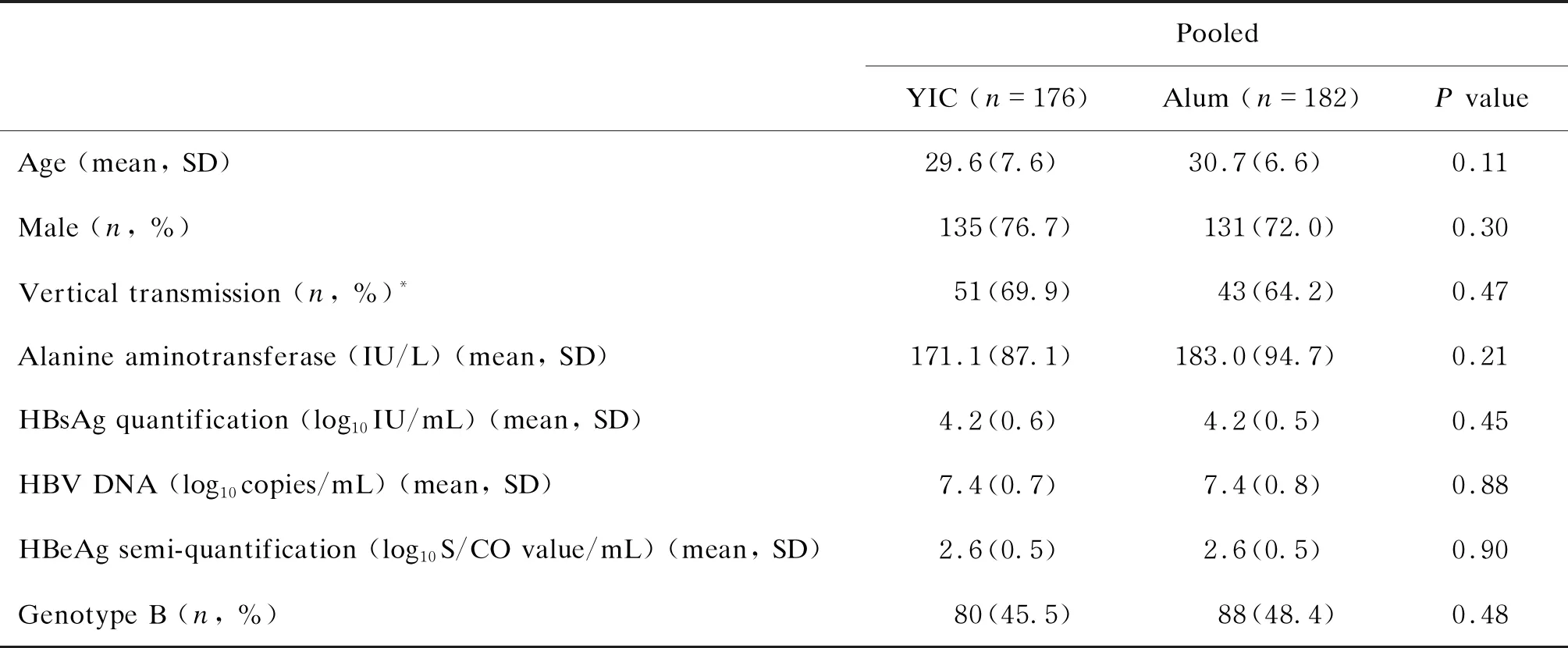
表1 Ⅱb期与Ⅲb期临床试验中慢性乙型肝炎受试者的基线特征
Ⅱb与Ⅲb期临床试验的主要疗效终点均为HBeAg血清学转换,其中Ⅱb期乙克治疗后24.3%患者(17例)达到终点,氢氧化铝佐剂组为11.4%(8例)(P<0.05);Ⅲb期乙克治疗后13.2%患者(14例)达到终点,氢氧化铝佐剂组为13.4%(15例)(P>0.05);Ⅱb和Ⅲb期临床试验数据合并后乙克治疗组有17.6%患者(31例)达到终点,氢氧化铝佐剂组为12.6%(23例)(P>0.05)。
2.2 随访结束时HBsAg下降情况
治疗结束后随访6个月至随访结束(第44周),乙克组与氢氧化铝佐剂组HBsAg下降幅度相当,约为0.4log10IU/mL(P=0.40)。然而,乙克组中达到HBeAg血清学转换者HBsAg下降十分明显,为0.95log10IU/mL,显著高于未达到HBeAg血清学转换者(0.32log10IU/mL)(P<0.01);氢氧化铝佐剂组中达到与未达到HBeAg血清学转换者HBsAg分别下降0.49log10IU/mL与0.36log10IU/mL(P=0.34)。进一步分析HBsAg下降>1.0log10IU/mL的受试者,乙克组达到HBeAg血清学转换者中有38.71%(12/31)患者HBsAg下降达到这一幅度,最大者下降4.98log10IU/mL,从而实现了HBsAg清除,而氢氧化铝组仅13.04%(3/23)患者HBsAg下降达到这一幅度(P=0.03)(见表2)。
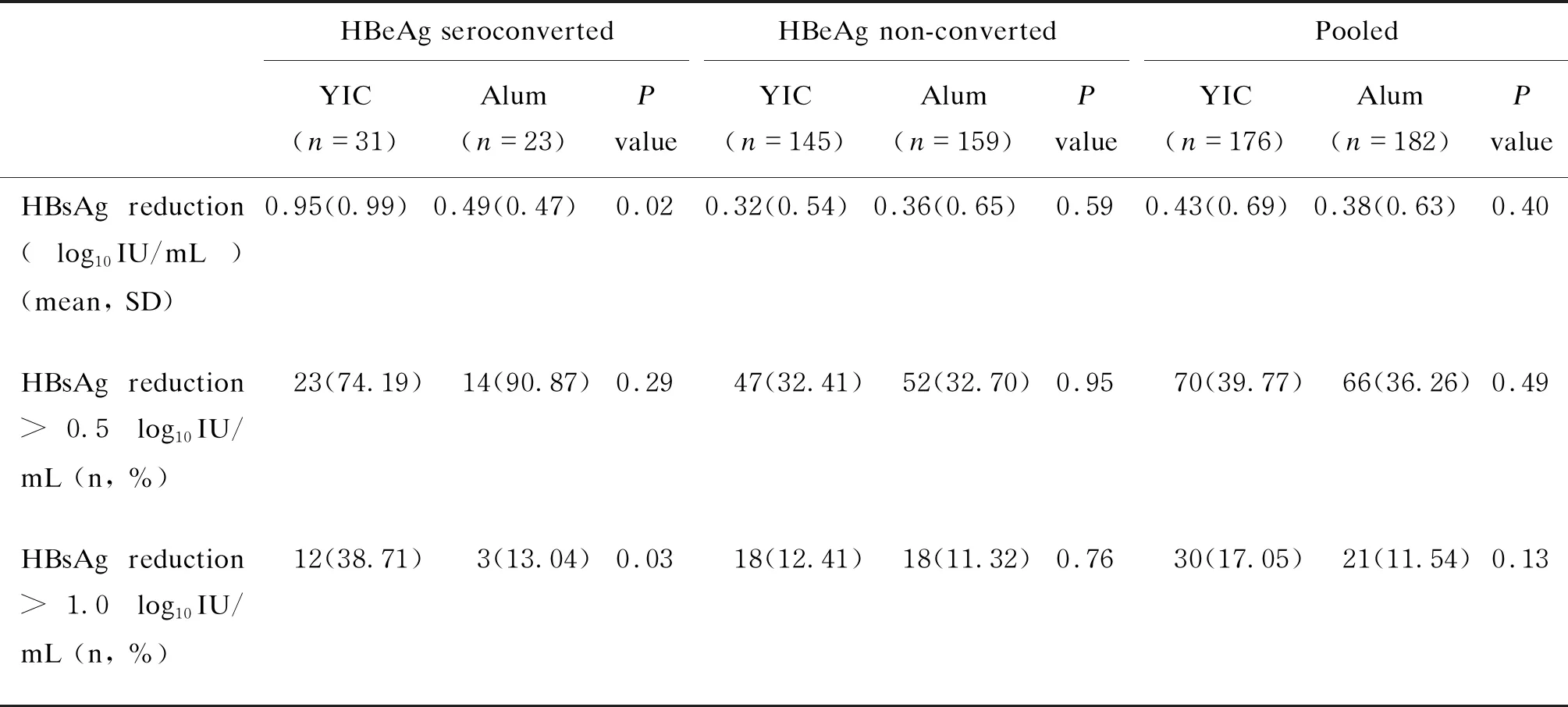
表2 随访结束时HBsAg下降情况
2.3 治疗与随访期间ALT flare与HBsAg下降情况
在治疗与随访期间,分别有80例(22.3%)与23例(6.4%)受试者发生了ALT flare(P<0.000 1)。无论是治疗期[乙克组42例(23.9%),氢氧化铝组38例(20.9%)(P=0.49)]还是随访期[乙克组11例(6.3%),氢氧化铝组12例(6.6%)(P=0.89)],乙克组与氢氧化铝组的ALT flare发生率相仿。乙克组在第44周HBsAg下降>1.0log10IU/mL的受试者中,约半数(14/30,46.7%)在治疗期间发生了ALT flare;而HBsAg下降≤1.0log10IU/mL的受试者中,仅19.2%(28/146)发生了ALT flare(P=0.001 3)。氢氧化铝组中,第44周HBsAg下降>1.0log10IU/mL者与HBsAg下降≤1.0log10IU/mL者之间ALT flare发生率无统计学差异(5/21,23.8%;33/161,20.5%;P=0.73)(见表3)。
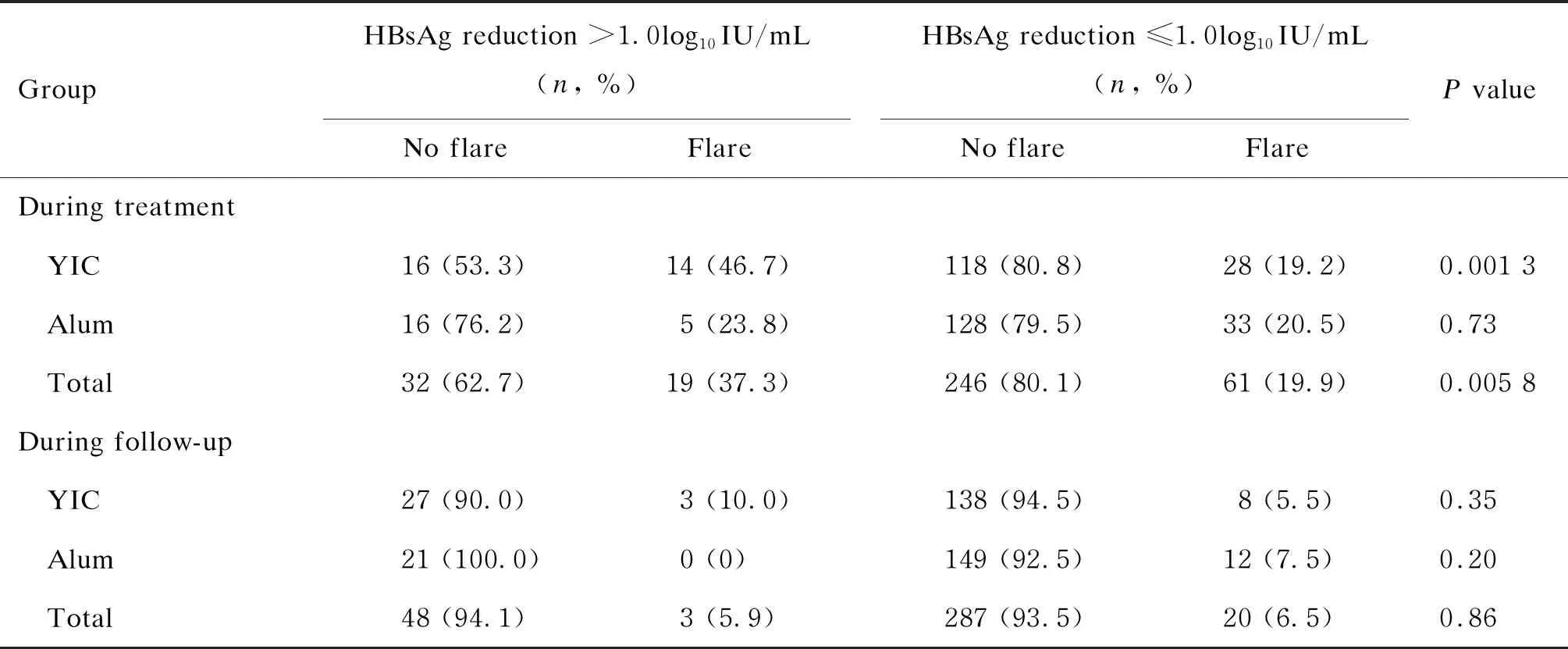
表3 治疗期与随访期ALT骤升与HBsAg下降的关系
2.4 影响HBsAg下降的因素
将受试者的年龄、性别、感染的HBV基因型,基线ALT、HBeAg、HBsAg、HBV DNA水平,以及治疗与随访期间ALT flare发生与否均纳入Logistic回归模型,变量纳入与剔除均以0.15为检验水准。结果显示,影响患者第44周HBsAg下降是否>1.0log10IU/mL的因素依次为基线HBsAg水平、第44周HBeAg血清学转换、治疗期间发生ALT flare及HBV基因型(见表4)。其中,除HBV基因型对HBsAg下降的影响接近统计学显著水平,其余三项的影响均十分显著。
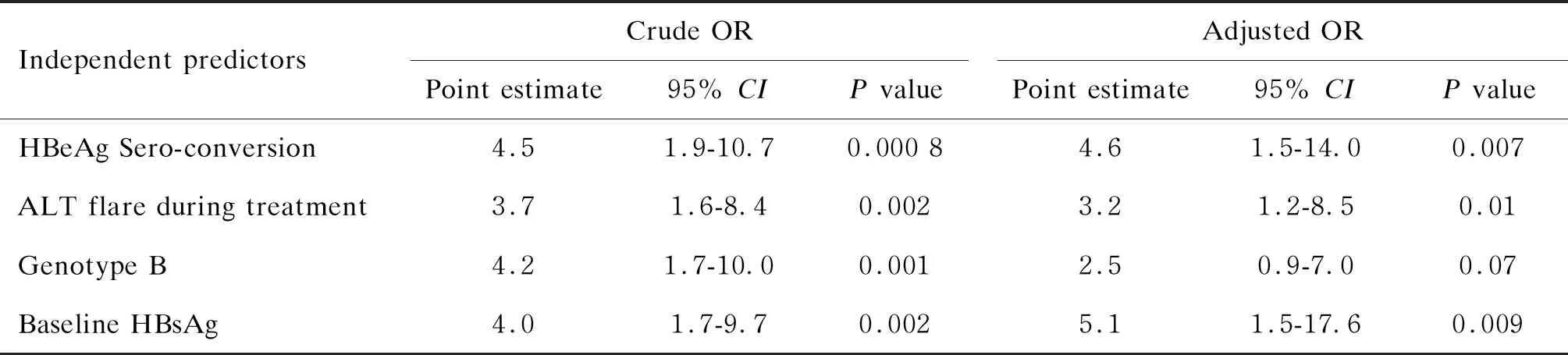
表4 随访结束时HBsAg下降的影响因素
3 讨论
目前,对CHB患者采用抗病毒治疗以延缓或减少肝硬化、肝细胞癌的发生,改善生活质量和延长生存时间已成为乙型肝炎防治共识。患者接受抗病毒治疗的比例从2005年首版《慢性乙型肝炎防治指南》制订时的19%逐渐上升到如今的几乎100%。同时,抗病毒治疗的疗效终点也从HBV DNA的抑制发展为HBeAg血清学转换,再发展到“在部分适合条件的患者中追求临床治愈”,即以HBsAg转阴为特征的治疗终点[5-7]。然而,采用现有核苷(酸)类似物治疗CHB对患者血清HBsAg下降的作用甚微,血清HBsAg年转阴率约为1.0% (95% CI:0.8~1.3)[8]。一般认为,核苷(酸)类似物治疗1年,HBsAg转阴率仅为0~3%,其中替诺福韦疗效相对为佳,清除率可达3%。即便是具有免疫调节作用的长效干扰素,其治疗1年的HBsAg清除率亦仅为3%[8-9]。近期有研究报道,患者经干扰素治疗达到HBsAg转阴停药后,继续随访26、52、78、104和597周,病毒学复发率分别为0.84%、6.29%、6.88%、8.18%和9.66%[10]。香港一项队列研究表明,用恩替卡韦治疗初治乙型肝炎患者5年,血清HBsAg平均年下降0.125log10IU/mL[11]。本研究对乙克的临床研究资料进行回顾性分析,发现CHB患者经乙克治疗5个月,随访6个月后其血清HBsAg下降达0.43log10IU/mL,明显高于香港恩替卡韦治疗队列中的HBsAg年下降量。本研究中,经乙克治疗达到HBeAg血清学转换者的HBsAg下降更是高达0.95log10IU/mL。比较乙克组与氢氧化铝组中达到HBeAg血清学转换者,乙克组出现了明显的血清HBsAg下降(乙克组0.95log10IU/mL,氢氧化铝组0.49log10IU/mL),提示患者经乙克治疗后血清HBsAg下降是特异性免疫治疗的结果。乙克组治疗过程中ALT flare在HBsAg下降>1.0log10IU/mL者中较多见,随访期间较少见(3/30,10.0%),而氢氧化铝组未观察到此现象。CHB患者尤其是HBeAg阳性患者(治疗或未经治疗)会发生ALT突发升高,这种突发升高往往是人类白细胞抗原1(human leukocyte antigen 1,HLA-1)限制性细胞毒性T细胞(cytotoxic T lymphocyte,CTL)介导的针对HBV特异性免疫反应的结果,而ALT水平通常反映免疫反应程度,因此更高的ALT水平代表对HBV更强的免疫清除,往往随之发生HBeAg血清学转换及HBV DNA清除[12-14]。
本研究将乙克Ⅱb和Ⅲb期临床试验数据进行了合并分析,发现与核苷(酸)类似物及干扰素类药物治疗后血清HBsAg下降的影响因素相似[11,15-16],使用乙克治疗后影响HBsAg下降的因素包括患者出现HBeAg血清学转换、感染的HBV为B基因型、治疗过程中ALT出现10倍增高,以及基线血清HBsAg为高水平。
本研究结果显示,乙克的特异性免疫对降低CHB患者血清HBsAg有一定效果,提示今后治疗CHB除采用抗病毒核苷(酸)类药物作为基础用药外,可有计划地应用乙克激活特异免疫,或采用“抗病毒药物治疗+针对HBsAg的中和性抗体被动免疫+乙克主动免疫”的“三明治”治疗策略[17],可能会更快达到“功能性治愈”的目的。
