细胞外基质的机械性质对肝癌发展的影响
2021-06-15刘紫欣袁宏博陈娅斐安海龙
刘紫欣 袁宏博 陈娅斐 安海龙


摘要 生物组织中的细胞处于充满细胞外基质(ECM)的三维环境中,ECM不仅为细胞提供物理支架,还产生有关肿瘤细胞生物学功能的生化或生物物理信号。在许多模拟体内细胞—基质相互作用的方法中,利用水凝胶进行细胞培养已经揭示了一些基质机械性质协调细胞行为的基本现象。肝细胞癌(HCC)是最常见的原发性恶性肿瘤之一,其发展与组织硬度密切相关:正常的肝脏组织在受到刺激损伤后发生炎症,随后转化为肝纤维化,然后恶化为肝硬化,最终发展为肝细胞癌。随着这个过程的发展,肝组織的硬度不断增加,而增加的基质硬度又促进肝癌细胞的增殖、迁移、上皮细胞—间充质转化和耐药性,促进了HCC的发展。表明了基质机械性质在促进肝癌恶化进程中的重要作用。本文综述了细胞外基质的机械性质对肝癌发展的影响,并展望了基于力学微环境揭示肝癌病理机理的重要意义。
关 键 词 细胞外基质;肝细胞癌;硬度;水凝胶;肿瘤微环境
中图分类号 Q6 文献标志码 A
Abstract Cells are living in a three-dimensional environment filled with extracellular matrix (ECM). ECM not only provides cells with a physical scaffold, but also generates biochemical and biophysical signals related to many biological processes. Among various approaches to mimic cell-matrix interactions in vivo, cell culture using hydrogels has revealed many basic phenomena that coordinate cell behavior. Hepatocellular carcinoma (HCC) is one of the most common primary malignancies, and its development is closely related to tissue stiffness: normal liver tissues become irritated after being stimulated and damaged, and then develop to fibrotic liver followed by cirrhosis, and transform into hepatocellular carcinoma eventually. The stiffness of liver tissues increases significantly with the development of HCC. As a reciprocity, the increased matrix stiffness further promotes the proliferation, migration, epithelial-mesenchymal transition and drug resistance of liver cancer cells. It shows that the mechanical property of matrix play an important role in HCC development. Here, we review the impact of the mechanical properties of extracellular matrix on the development of liver cancer, and predict the significance of revealing the pathological mechanism of liver cancer based on the mechanical microenvironment.
Key words extracellular matrix; hepatocellular carcinoma; stiffness; hydrogels; tumor microenvironment
0 引言
生物组织中的细胞处于充满细胞外基质(ECM)的三维环境中,以ECM作为支架实现了细胞与细胞之间、细胞与环境之间的物质和能量交换,通过信号转导系统影响细胞的形态、代谢、功能、迁移、增殖和分化等行为。除生物化学因子外,ECM为细胞的生存和功能提供了适宜的机械力学环境,包括基底刚度、流体静压、剪切应力、应变、压力和张力等物理信号。这些力学因素在调控细胞的正常生理功能、疾病的发生中同样起着重要作用。例如,在胚胎发育阶段,细胞外基质的硬度参与了胚胎干细胞向不同类型细胞的分化过程;同一器官的健康状态和疾病状态之间表现出显著的机械性能差异[1]。在某些癌变组织中,由于细胞的无限增殖,血管的高渗透性,淋巴引流不足以及细胞外基质沉积的增加,导致实体肿瘤组织与未转化的正常组织相比硬度显著增加。值得注意的是,细胞机械微环境的改变又反作用于细胞本身,进一步调控细胞增殖、侵袭、凋亡、抗药性、血管生成、代谢和促进生长的信号通路,从而导致肿瘤恶性化进程[2-5]。越来越多的证据表明,物理机械环境是调控肿瘤发展的关键因素。
肝细胞癌(HCC)是最常见的原发性恶性肿瘤之一,是一个连续的、多步骤进展的癌变病理过程,且绝大多数发生在肝纤维化和肝硬化的基础上,复发频率高且预后差。目前,通过医学影像对肝脏硬度的检测已经成为诊断癌前病变与 HCC的重要手段。肝纤维化、硬化结节病变过程导致肝细胞生长的微环境改变,包括生化因素和生物力学因素[6],而这些改变反过来促进HCC的发展,提高了肝癌细胞的增殖活性和侵袭性。2011年Schrader 等[7]发现增加基质硬度可促进肝癌细胞增殖和对化疗的耐药性,而软基质环境可诱导HCC中可逆性细胞休眠和干细胞特征。2019年Gao等[6]研究发现机械适应赋予肝癌细胞运动性和对索拉非尼的耐药性增加,且肝硬化硬度影响肌动蛋白的组织和肝癌细胞迁移,增加患者的临床预后风险。此外,机械力学微环境对肝细胞的癌变、形态、增殖、代谢以及迁移等细胞活性有着重要作用。基于此,本文总结了肝硬化与肝癌的发展过程、细胞外基质的作用及体外模拟,以及细胞外基质硬度对肝癌发展的影响,并展望了基于力学微环境揭示肝癌病理机理的重要意义。
1 肝硬化与肝癌的发展过程
肝脏负责营养素的代谢、合成、储存和再分配,并且在体内平衡中起着核心作用。肝细胞癌形式的原发性肝癌是全球第五大常见的癌症,是男性中第五常见的恶性肿瘤,在女性最常见的恶性肿瘤中排第九[8],并且是第二大最常见的癌症死亡原因[9],主要治疗手段是切除手术和移植手术[10]。我国是原发性肝细胞肝癌的高发国家,HCC是肝癌最主要的病理类型,占90%以上,具有侵袭性、转移及复发率高等特点[11]。HCC是一个连续的、多步骤进展的癌变病理过程,且绝大多数发生在肝硬化的基础上,如图1[12]所示正常的肝脏组织在病毒、酒精、活性氧等刺激损伤后发生炎症,随后转化为肝纤维化(Stage 1),然后恶化为肝硬化(Stage 2),最终发展为肝细胞癌(Stage 3)(HCV:丙型肝炎病毒; HBV:乙型肝炎病毒;NAFLD:非酒精性脂肪肝疾病;NASH:非酒精性脂肪性肝炎)。
1.1 正常肝到肝纤维化(Stage 1)
毒素、病毒、胆汁淤积、应力、活性氧、自身免疫性损伤、代谢产物等刺激可引起慢性肝脏疾病,当这些刺激对肝脏重复损伤或长期持续时,肝再生就会失败,这将导致胶原ECM(主要是I型胶原)的过度积累——称为“肝纤维化”。这些损伤通过诱导细胞因子/生长因子和其他激活纤维化的下游效应子——主要是活化的肝星状细胞(HSC)和成肌纤维细胞(MF)以及程度较低的活化的窦状内皮细胞,从而驱动纤维生成(增强的ECM合成)[13-16],导致ECM成分如胶原的沉积增加。同时HSC/MF和各种其他细胞会增加金属蛋白酶的组织抑制剂(TIMP-1)的合成,降低基质金属蛋白酶(MMP)的含量和活性。MMPs在错误的位置或时间发生的失活和活性降低也会促进细胞迁移和增殖,可驱动继发性纤维化反应,最终形成肝纤维化[17]。因此,肝纤维化是所有慢性肝病(CLD)的常见结局[18]。纤维化伴随着免疫细胞组成的改变和血管生成的改变,最终导致严重的结构改变,损害器官功能[19]。
1.2 纤维化发展为肝硬化(Stage2)
肝纤维化的终末期不可逆转的结果是大量的发病和死亡,其特征是形成被纤维化隔膜包围并分隔的实质的再生结节。全世界有1.7亿患者患有慢性肝病,其中25%至30%会发展为明显的纤维化并最终发展为肝硬化[18]。如果损伤因素长期不能去除,纤维化的过程长期持续就会发展成肝硬化。在慢性肝病末期观察到的一组形态学改变,以肝实质的血管结构紊乱为特征,肝脏逐渐变形、变硬而被称为“肝硬化”[20]。肝硬化肝细胞的特征在于波形蛋白和I型胶原蛋白的表达增加,表明上皮-间充质转化(EMT)的开始,即上皮细胞失去表型特征并获得间充质细胞特征的过程[21]。此外肝硬化伴随肝细胞增殖减少,表明肝脏的再生能力用尽,并导致纤维组织增加和肝细胞破坏,最终可能导致癌性结节的发展[22]。
1.3 肝细胞癌合并肝硬化(Stage3)
肝硬化患者的5年累积肝细胞肝癌发生率为 5%~30%[23],但由于大多数肝硬化患者无症状,因此很难诊断出早期肝癌[24],所以有肝症状和肝癌的患者通常被认为已经患有晚期肝癌。临床数据表明,80%以上的HCC患者具有肝硬化或重度肝纤维化,几乎所有患有肝细胞癌的患者都患有肝硬化[25-26],而且肝硬化常阻碍对 HCC的有效治疗。在一些发达国家,与肝硬化相关的HCC死亡率不断上升,而非肝硬化为并发症的肝癌死亡率则下降或保持稳定。研究表明,肝癌目前是代偿性肝硬化患者与肝相关死亡的主要原因[23]。
2 细胞外基质的作用及体外模拟
2.1 细胞外基质参与调节细胞生理过程
所有组织和器官都包含细胞和非细胞成分,由细胞分泌到细胞外的大分子物质,如胶原蛋白、层黏连蛋白、蛋白聚糖等,形成了良好的组织网络,称为细胞外基质(ECM)。ECM不仅为细胞提供物理支架,还含有大量的信号分子,积极参与许多细胞过程,包括生长、迁移、分化、存活、体内稳态和形态变化等。ECM可为细胞提供结构支持和锚定位点,并赋予部分组织的生物力学特性[27-28]。ECM蛋白也可以直接通过它们的受体(如整联蛋白)或通过调节生长因子将信号转导给细胞[29]。ECM引导信号转导并调节基因转录,从而指导必要的组织形态和生理功能。ECM在生理、发育和衰老中起着关键作用[30]。越来越多的报道揭示ECM的机械性质在细胞功能调节中起着至关重要的作用[31-32]。ECM的生物化学、生物力学、组织特性和保护性在不同组织之间,甚至在一个组织从一种生理状态到另一种生理状态(正常与癌变)之间,都可能有很大差异[33]。
2.2 基质硬化与肿瘤发展
目前,ECM对肿瘤细胞侵袭和转移的生化作用已有较多的文献记载[34],但对它们的生物物理信号作用的研究相对较少。Ulrich等[35]发现随着ECM硬度降低到与正常脑组织相当的值,肿瘤细胞变得圆润并且无法有效迁移。此外,细胞增殖受ECM硬度的调节也较为明显,与软的ECM相比,较硬的ECM能促进细胞的分裂。基质硬化是实体瘤最显著的机械和物理特征,主要是由于细胞外基质蛋白过度沉积和交联所致[36]。癌细胞与癌症相关的成纤维细胞和巨噬细胞协同工作,通过一些活动调节ECM:一些沉积结构成分的增多(如例如胶原蛋白I[37],胶原蛋白II,III,V,IX[38]);各种生长因子和细胞因子的分泌(如IGF1,EGF,TGFβ,VEGF[39],赖氨酰氧化酶[40])。在这些活动增多的情况下,癌细胞募集并转化基质细胞,继而协调基质的拓扑结构重构,机械刚度增加。而机械刚度增加可能会破坏细胞表面力的平衡,促进整联蛋白聚集和粘着斑形成,从而将外源基质产生的力信号传递到细胞中,并最终影响它们的生物学表型和特性,例如细胞的形态、生长、分化,以及蛋白质、细胞因子的合成分泌和代谢[41-42],還通过细胞骨架重塑来调节细胞迁移。癌症转移需要肿瘤细胞侵入基质,并使肿瘤细胞通过基质直接向脉管系统和淋巴系统迁移,之后扩散和定殖次级器官。在原发性肿瘤组织内形成的物理和生化梯度会促进肿瘤细胞的侵袭,并推动肿瘤细胞向血管和淋巴管的持续迁移,从而促进肿瘤细胞的扩散[43]。基质与癌细胞之间这种复杂的相互作用形成了基于生物化学和生物物理信号作为调节因素的动态前馈/反馈回路。因此,生物物理信号逐渐成为人们研究癌症转移的关键切入点[44]。
2.3 体外模拟细胞外基质的常用材料
水凝胶是一种亲水性的三维网络高分子材料,具有良好的生物相容性,根据来源可分为天然水凝胶和合成水凝胶。常用的天然水凝胶主要有胶原蛋白、透明质酸和海藻酸;常用的合成水凝胶主要包括聚丙烯酰胺、聚乙二醇等。通过选择适当材料和化学成分,合理设计水凝胶的相关关键特性,例如机械刚度、弹性、含水量、生物活性、孔隙度和降解性[45],从而模拟天然ECM相似的生物学和物理学特性。水凝胶化学的主要目的是构建用作3D离体组织模型的水凝胶,从而能够通过复制组织的动态和非线性物理特性来探索细胞生物学中的基本问题。将水凝胶作为离体组织模型进行细胞3D培养已经揭示了一些协调细胞行为和组织的基本现象[46]。水凝胶已成为体外模拟构建生物体内环境的一种重要材料。
3 基质硬度对肝癌发展的影响研究现状
3.1 肿瘤微环境在肝癌进展中的作用
体内肿瘤细胞在原发肿瘤部位和远处转移部位均存在各种类型的微环境。了解这些微环境的各种机械特性如何在肿瘤发展过程中影响肿瘤细胞的生物学特征,对于确定癌症治疗的分子靶标至关重要[41],因此肿瘤微环境(TME)在癌症进展中的作用正受到广泛关注。TME具有明显的异质性,并参与肿瘤的生长、转移和耐药性。模仿这种多样化的微环境对于理解肿瘤的生长和转移具有重要意义[47]。细胞外基质蛋白作为肿瘤微环境中最丰富的非细胞固态成分,不仅维持肿瘤细胞/组织的三维形态结构,而且还产生有关肿瘤细胞生物学功能的生化或生物物理信号[36]。肝脏中的TME在原发性和转移性肝肿瘤的形成、生长中起着重要作用。TME的细胞和非细胞成分会显著影响肿瘤的发展、生長、转移、扩散、抗肿瘤免疫力以及对肿瘤治疗的反应[48]。越来越多的数据表明,肿瘤与其微环境的相互作用在HCC发病机理中起着重要作用:TME积极参与肝纤维化、肝癌发生、EMT、转移和侵袭的调节[49]。
3.2 肝脏硬度随肝癌发展的变化
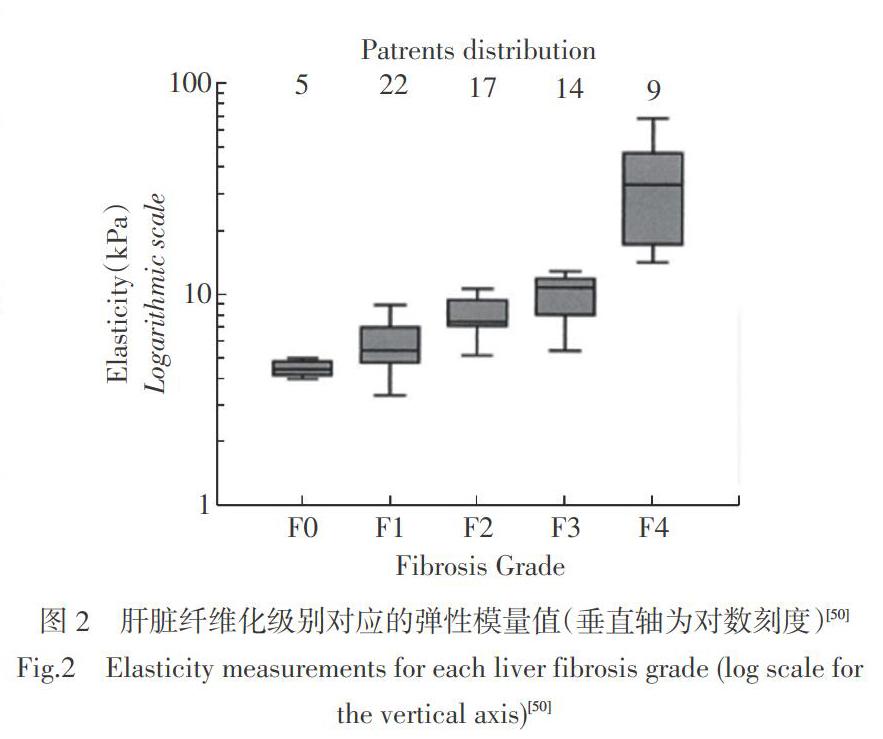
肝脏硬度被视为与纤维化相关,并且随着纤维化程度的加深肝脏硬度增加[18]。2003年Sandrin等[50]引入基于超声的瞬时弹性成像技术(目前在临床上广泛应用于测量肝脏硬度),他们对多期肝纤维化的肝脏硬度进行了测量(如图2[50]所示)。纤维化的等级范围从F0到F4(F0:无纤维化,F1:无隔垫的门脉纤维化,F2:少隔,F3:无肝硬化的隔垫,F4:肝硬化),结果显示随着纤维化的发生,肝脏硬度从正常状态的2.5 kPa增加为肝硬化状态的75.5 kPa。2016年Perepelyuk等[51]为了更好地了解正常和纤维化肝脏的力学特征,使用平行平板流变仪进行了一系列研究,测量了对压缩、拉伸和剪切应变的响应。研究表明,大鼠肝脏中随着进行性纤维化的增加,剪切储能模量[(G′)]、损失模量[(G″)]和杨氏模量显著增加,并且随着压缩力的施加,剪切模量显著增加。说明晚期纤维化肝组织与早期纤维化肝组织或正常肝相比,晚期纤维化肝组织具有较高的压力抵抗能力。
此外,已有广泛报道称肝脏是粘弹性组织,具有非线性的机械性质,其弹性和粘滞性能随时间和形变而变化[51]。肝细胞外基质在纤维化过程中发生质和量的变化,其中纤维状胶原蛋白显著增加。这些机械性质相关的ECM蛋白和多糖变化,可能有助于并改变细胞行为,并且对组织的非线性力学具有重大影响。
3.3 基质硬度对肝癌发展的影响
基底硬度影响肝癌细胞的细胞形态和增殖:2011年Schrader等[7]为明确基质硬度的变化是否调节HCC细胞增殖和化疗反应,在不同硬度聚丙烯酰胺(PA)凝胶表面培养肝癌细胞系HuH-7和HepG2。结果表明,柔软(1 kPa)的凝胶上的肝癌细胞形态较小且呈现圆形,而在硬(12 kPa)凝胶上则为更加伸展且扁平形态的细胞(图3a)[7])。此外,增加基质硬度可促进HCC增殖,基质硬度对G1期的细胞周期调节因子的表达具有相应的作用;基质硬度可调节化疗后HCC细胞凋亡和克隆形成能力:顺铂治疗后,在较硬的凝胶上培养的细胞凋亡减少,软凝胶上的细胞克隆形成能力增强。证明机械因素能够调节HCC细胞的形态、增殖和化学治疗反应。这对原发性HCC的治疗和预防播散性肿瘤细胞生长具有重要意义。
基底硬度影响肝癌细胞的迁移性:2020年Liu等[52]为了研究ECM刚度对HCC细胞的迁移的作用,制备了具有3种刚度(6,25和54 kPa,匹配正常肝,肝硬化和肝癌组织的生理硬度)的聚丙烯酰胺水凝胶,通过划痕法和transwell法测定HCC细胞的迁移能力。结果表明,HepG2和MHCC97L细胞的迁移能力均随水凝胶刚度的增加而显著增加(图3b)[52]),较硬的基质通过上调需氧糖酵解来促进HCC细胞的迁移。而YAP作为细胞微环境机械力学的传感器,它的活性和亚细胞定位也受ECM刚度调节:YAP定位在细胞核中的量随基质刚度的增加而增加。ECM刚度通过丝裂原活化蛋白激酶(MAPK)信号通路诱导YAP激活来调节HCC细胞的迁移。确定了涉及YAP的MAPK依赖性调节网络。揭示了受ECM力学调节的HCC细胞迁移机制,使我们更好地了解了机械力学环境对肝癌发生发展的影响。
基底硬度调控肝癌细胞的上皮细胞-间充质转化:2019年Dong等[36]建立具有不同肝硬度背景的布法罗大鼠HCC模型和具有可调硬度的体外Col I涂层培养细胞来研究基质硬度对上皮细胞-间充质转化(EMT)发生的影响及其潜在的分子机制。结果表明在较高硬度的肝脏中生长的HCC异体移植物表现出较差的恶性表型和较高的肺转移率,较高的肝脏硬度会促进HCC的侵袭和转移。体外细胞实验表明,较高的基质硬度能够显著增强恶性表型并独立诱导HCC细胞中的EMT发生,并且存在于Snail表达的3个信号通路参与了刚度介导的EMT发生,包括整合素介导的S100A11膜易位,eIF4E 磷酸化和TGFβ1自分泌(图3c)[36])。此外,刚度诱导的EMT所需的关键分子在肝硬度较高的HCC患者的肿瘤组织中高表达,并且与较少的肿瘤分化和更高的复发率相关。突出表明了生物力学信号在触发EMT和促进HCC侵袭和转移中的重要作用。
基底硬度参与肝癌细胞的耐药性发展:2019年Gao等[6]的研究诱导了HCC细胞中的索拉非尼耐药细胞系,观察发现索拉非尼耐药细胞的细胞形态、细胞骨架结构和细胞刚度发生了变化,类似于生长于较硬基底上的细胞。为了研究机械因素在HCC细胞生长和耐药性中的作用,他们使用了一种硬度可调的体外细胞培养系统,模拟正常和肝硬化的肝组织,发现在较硬基底的肝癌细胞运动性增加,索拉非尼耐药性增加(图3d)[6]),还具有更大的侵袭潜力。通过小干扰RNA沉默YAP基因,消除了基质硬度对肝癌细胞的索拉非尼耐药性影响,证明YAP介导了HCC细胞中机械适应诱导的索拉非尼耐药性。因此,通过调控机械微环境及其所介导的YAP信号通路对克服肝癌细胞的耐药性具有重要意义。
水凝胶调控HCC发展的研究现状小结:现在关于基质硬度调节HCC发展的研究多使用合成水凝胶——聚丙烯酰胺凝胶[6-8,36,52-54]作为“机械可调”基质涂层,设计不同硬度来模拟正常和纤维化肝脏中遇到的值,在凝胶表面培养肝癌细胞:发现增加基质硬度改变HCC细胞形态[7],促进HCC增殖[7]、迁移[52]、EMT[36],增强耐药性[6],抑制凋亡[53]。但是聚丙烯酰胺凝胶不具备生物组织常有的非线性力学性质,而且多数工作是将细胞培养在水凝胶表面,并未将细胞包裹在水凝胶内部,不能充分地模拟肝癌组织的三维动态环境和非线性物理特性。这些研究结果启发我们设计并使用更具仿生特点的水凝胶来研究三维环境对HCC发展的影响,从而更好地探索肝癌发展中的基本问题。
4 结语与展望
肿瘤生物物理学为理解癌症和发现新疗法提供了新的思路。通过对基质力学性质与癌癥发生、发展关系的不断深入研究,调控细胞外基质的机械性质可成为癌症治疗和预后的新靶标。ECM的硬度对肝癌细胞行为有相当大的影响,并且在癌细胞转移过程中起着非常重要的作用。肝硬度的增加在驱动HCC恶化和进展中起有害作用,并表现出高风险的不良后果,已成为肝癌的一个重要的临床病理参数并表示肝癌的病理分级[55]。随着正常肝向肝纤维化、肝硬化、肝癌的发展,肝脏组织的硬度不断增加,而增加的肝脏硬度又促进肝癌细胞生长、增殖、迁移、侵袭、EMT和耐药性,促进了HCC恶化和发展。肝基质硬度可能充当改变肿瘤行为和进展的关键调节剂。
开发在离体仿生3D平台研究细胞—基质相互作用可以帮助我们更好地了解物理因素如何影响化学信号,从而影响肝癌的发展恶化。目前大多数工作是基于天然水凝胶或合成水凝胶来模拟肝癌发展中ECM的不同硬度。但生物组织的机械性质除硬度不同外,还具有粘弹性、可塑性、应力刚化等非线性力学性质。然而,大部分合成水凝胶不具有天然ECM的非线性力学特点,不能够很好的模拟天然ECM。因此,很少有适合的材料能够用来研究基质非线性机械性质对细胞功能的调控。2013年,Rowan&Kouwer课题组设计、开发了一种具有机械响应性能的仿生水凝胶——螺旋聚异腈多肽(Polyisocyanopeptide,PIC[56])。PIC水凝胶在生物的硬度范围内展示出超强的力学响应能力,即应力刚化的性质,随着外界应力的增加PIC水凝胶的强度增强。该性质一般主要存在于胶原蛋白、中间纤维等天然生物凝胶中,在人工合成的水凝胶中很少被观察到。基于其仿生的应力刚化性质,PIC水凝胶已成功用于调控干细胞的诱导分化[57]。由于PIC高度的仿生特性,并且可以通过链长、浓度等参数设计调整PIC水凝胶的机械性质,从而可以很好的模拟肿瘤的硬度和其他非线性力学特性,以便研究这些特性对肿瘤侵袭性和转移潜力等的影响。因此,未来基于仿生水凝胶的非线性力学性质研究其对肝癌细胞的功能调控,对进一步理解肝癌微环境如何通过复杂机械信号调控肝癌的发展具有重要意义。
参考文献:
[1] CHEN X,WANGGOU S Y,BODALIA A,et al. A feedforward mechanism mediated by mechanosensitive ion channel PIEZO1 and tissue mechanics promotes glioma aggression[J]. Neuron,2018,100(4):799-815.
[2] KAI F,LAKLAI H,WEAVER V M. Force matters: biomechanical regulation of cell invasion and migration in disease[J]. Trends in Cell Biology,2016,26(7):486-497.
[3] NORTHEY J J,PRZYBYLA L,WEAVER V M. Tissue force programs cell fate and tumor aggression[J]. Cancer Discovery,2017,7(11):1224-1237.
[4] OUDIN M J,WEAVER V M.Physical and chemical gradients in the tumor microenvironment regulate tumor cell invasion,migration,and metastasis[J].Cold Spring Harbor Symposia on Quantitative Biology,2016,81:189-205.
[5] PRZYBYLA L,MUNCIE J M,WEAVER V M. Mechanical control of epithelial-to-mesenchymal transitions in development and cancer[J]. Annual Review of Cell and Developmental Biology,2016,32:527-554.
[6] GAO J,RONG Y,HUANG Y,et al. Cirrhotic stiffness affects the migration of hepatocellular carcinoma cells and induces sorafenib resistance through YAP[J]. Journal of Cellular Physiology,2019,234(3):2639-2648.
[7] SCHRADER J,GORDON-WALKER T T,AUCOTT R L,et al. Matrix stiffness modulates proliferation,chemotherapeutic response,and dormancy in hepatocellular carcinoma cells[J]. Hepatology,2011,53(4):1192-1205.
[8] YOU Y,ZHENG Q,DONG Y,et al. Matrix stiffness-mediated effects on stemness characteristics occurring in HCC cells[J]. Oncotarget,2016,7(22):32221-32231.
[9] KANDA T,GOTO T,HIROTSU Y,et al. Molecular mechanisms driving progression of liver cirrhosis towards hepatocellular carcinoma in chronic hepatitis B and C infections: a review[J]. International Journal of Molecular Sciences,2019,20(6). DOI:10.3390/ijms20061358.
[10] BHARDWAJ N,PERERA M T,SILVA M A. Current treatment approaches to HCC with a special consideration to transplantation[J]. J Transplant,2016,2016:7926264.
[11] 杜葉晖. 钾离子通道KCa3.1在肝细胞肝癌中的表达及作用机制研究[D]. 杭州:浙江大学,2017.
[12] MACEK JILKOVA Z,KURMA K,DECAENS T. Animal models of hepatocellular carcinoma: the role of immune system and tumor microenvironment[J]. Cancers,2019,11(10). DOI:10.3390/cancers11101487.
[13] TOROK N J,DRANOFF J A,SCHUPPAN D,et al. Strategies and endpoints of antifibrotic drug trials:Summary and recommendations from the AASLD Emerging Trends Conference,Chicago,June 2014[J]. Hepatology,2015,62(2):627-634.
[14] SCHUPPAN D,MEHAL W. Antifibrotic therapies in the liver[J]. Seminars in Liver Disease,2015,35(2):184-198.
[15] TRAUTWEIN C,FRIEDMAN S L,SCHUPPAN D,et al. Hepatic fibrosis:Concept to treatment[J]. Journal of Hepatology,2015,62(1):S15-S24.
[16] SCHUPPAN D,SURABATTULA R,WANG X Y. Determinants of fibrosis progression and regression in NASH[J]. Journal of Hepatology,2018,68(2):238-250.
[17] SCHUPPAN D,ASHFAQ-KHAN M,YANG A T,et al. Liver fibrosis:Direct antifibrotic agents and targeted therapies[J]. Matrix Biology,2018,68/69:435-451.
[18] SANEYASU T,AKHTAR R,SAKAI T. Molecular cues guiding matrix stiffness in liver fibrosis[J]. BioMed Research International,2016,2016:2646212.
[19] ROCKEY D C,BELL D,HILL J A. Fibrosis:a common pathway to organ injury and failure[J]. The New England Journal of Medicine,2015,372:1138-1149.
[20] SAFFIOTI F,PINZANI M. Development and regression of cirrhosis[J]. Digestive Diseases,2016,34(4):374-381.
[21] NITTA T,KIM J S,MOHUCZY D,et al. Murine cirrhosis induces hepatocyte epithelial mesenchymal transition and alterations in survival signaling pathways[J]. Hepatology,2008,48(3):909-919.
[22] SANYAL A J,YOON S K,LENCIONI R. The etiology of hepatocellular carcinoma and consequences for treatment[J]. The Oncologist,2010,15(Suppl 4):14-22.
[23] FATTOVICH G,STROFFOLINI T,ZAGNI I,et al. Hepatocellular carcinoma in cirrhosis: Incidence and risk factors[J]. Gastroenterology,2004,127(5):S35-S50.
[24] BRUIX J,REIG M,SHERMAN M. Evidence-based diagnosis,staging,and treatment of patients with hepatocellular carcinoma[J]. Gastroenterology,2016,150(4):835-853.
[25] ZHU X D,ZHANG W H,LI C L,et al. New serum biomarkers for detection of HBV-induced liver cirrhosis using SELDI protein chip technology[J].World J Gastroenterol,2004,10(16):2327-2329.
[26] GAO J,XIE L,YANG W S,et al. Risk factors of hepatocellular carcinoma: current status and perspectives[J]. Asian Pacific Journal of Cancer Prevention,2012,13(3):743-752.
[27] HYNES R O,NABA A. Overview of the matrisome: an inventory of extracellular matrix constituents and functions[J]. Cold Spring Harb Perspect Biol,2012,4(1):a004903.
[28] MOUW J K,OU G Q,WEAVER V M. Extracellular matrix assembly:a multiscale deconstruction[J].Nature Reviews Molecular Cell Biology,2014,15(12):771-785.
[29] HYNES R O. The extracellular matrix: not just pretty fibrils[J]. Science,2009,326(5957): 1216-1219.
[30] BONNANS C,CHOU J,WERB Z.Remodelling the extracellular matrix in development and disease[J].Nature Reviews Molecular Cell Biology,2014,15(12):786-801.
[31] HUMPHREY J D,DUFRESNE E R,SCHWARTZ M A.Mechanotransduction and extracellular matrix homeostasis[J].Nature Reviews Molecular Cell Biology,2014,15(12):802-812.
[32] VINING K H,MOONEY D J.Mechanical forces direct stem cell behaviour in development and regeneration[J].Nature Reviews Molecular Cell Biology,2017,18(12):728-742.
[33] FRANTZ C,STEWART K M,WEAVER V M.The extracellular matrix at a glance[J].Journal of Cell Science,2010,123(Pt 24):4195-4200.
[34] OSKARSSON T.Extracellular matrix components in breast cancer progression and metastasis[J].The Breast,2013,22:S66-S72.
[35] ULRICH T A,DE JUAN PARDO E M,KUMAR S.The mechanical rigidity of the extracellular matrix regulates the structure,motility,and proliferation of glioma cells[J].Cancer Research,2009,69(10):4167-4174.
[36] DONG Y Y,ZHENG Q D,WANG Z M,et al.Higher matrix stiffness as an independent initiator triggers epithelial-mesenchymal transition and facilitates HCC metastasis[J].Journal of Hematology & Oncology,2019,12(1):1-15.
[37] WEI B,ZHOU X,LIANG C,et al.Human colorectal cancer progression correlates with LOX-induced ECM stiffening[J].International Journal of Biological Sciences,2017,13(11):1450-1457.
[38] HANDORF A M,ZHOU Y X,HALANSKI M A,et al.Tissue stiffness dictates development,homeostasis,and disease progression[J].Organogenesis,2015,11(1):1-15.
[39] DE LA MARE J A,JURGENS T,EDKINS A L.Extracellular Hsp90 and TGFβ regulate adhesion,migration and anchorage independent growth in a paired colon cancer cell line model[J].BMC Cancer,2017,17(1):1-16.
[40] WANG T H,HSIA S M,SHIEH T M.Lysyl oxidase and the tumor microenvironment[J].International Journal of Molecular Sciences,2016,18(1):62.
[41] TILGHMAN R W,BLAIS E M,COWAN C R,et al.Matrix rigidity regulates cancer cell growth by modulating cellular metabolism and protein synthesis[J].PLoS One,2012,7(5):e37231.
[42] KSHITIZ K,PARK J,KIM P,et al.Control of stem cell fate and function by engineering physical microenvironments[J].Integrative Biology,2012,4(9):1008-1018.
[43] OUDIN M J,WEAVER V M.Physical and chemical gradients in the tumor microenvironment regulate tumor cell invasion,migration,and metastasis[J].Cold Spring Harbor Symposia on Quantitative Biology,2016,81:189-205.
[44] EMON B,BAUER J,JAIN Y,et al.Biophysics of tumor microenvironment and cancer metastasis-A mini review[J].Computational and Structural Biotechnology Journal,2018,16 279-287.
[45] YANG J Z,ZHANG Y S,YUE K,et al.Cell-laden hydrogels for osteochondral and cartilage tissue engineering[J].Acta Biomaterialia,2017,57:1-25.
[46] FOYT D A,NORMAN M D A,YU T T L,et al.Exploiting advanced hydrogel technologies to address key challenges in regenerative medicine[J].Advanced Healthcare Materials,2018,7(8):e1700939.
[47] CASEY J,YUE X S,NGUYEN T D,et al.3D hydrogel-based microwell arrays as a tumor microenvironment model to study breast cancer growth[J].Biomedical Materials (Bristol,England),2017,12(2):025009.
[48] EGGERT T,GRETEN T F.Tumor regulation of the tissue environment in the liver[J].Pharmacology & Therapeutics,2017,173:47-57.
[49] NOVIKOVA M V,KHROMOVA N V,KOPNIN P B.Components of the hepatocellular carcinoma microenvironment and their role in tumor progression[J].Biochemistry Biokhimiia,2017,82(8):861-873.
[50] SANDRIN L,FOURQUET B,HASQUENOPH J M,et al.Transient elastography:a new noninvasive method for assessment of hepatic fibrosis[J].Ultrasound in Medicine & Biology,2003,29(12):1705-1713.
[51] PEREPELYUK M,CHIN L,CAO X,et al.Normal and fibrotic rat livers demonstrate shear strain softening and compression stiffening: a model for soft tissue mechanics[J].PLoS One,2016,11(1):e0146588.
[52] LIU Q P,LUO Q,DENG B,et al.Stiffer matrix accelerates migration of hepatocellular carcinoma cells through enhanced aerobic glycolysis via the MAPK-YAP signaling[J].Cancers,2020,12(2):490.
[53] YAO B,NIU Y,LI Y,et al.High-matrix-stiffness induces promotion of hepatocellular carcinoma proliferation and suppression of apoptosis via miR-3682-3p-PHLDA1-FAS pathway[J].Journal of Cancer,2020,11(21):6188-6203.
[54] GAO X Y,QIAO X N,XING X X,et al.Matrix stiffness-upregulated MicroRNA-17-5p attenuates the intervention effects of metformin on HCC invasion and metastasis by targeting the PTEN/PI3K/Akt pathway[J].Frontiers in Oncology,2020,10:1563.
[55] PARK M S,HAN K H,KIM S U.Non-invasive prediction of development of hepatocellular carcinoma using transient elastography in patients with chronic liver disease[J].Expert Review of Gastroenterology & Hepatology,2014,8(5):501-511.
[56] KOUWER P H,KOEPF M,LE SAGE V A,et al.Responsive biomimetic networks from polyisocyanopeptide hydrogels[J].Nature,2013,493(7434):651-655.
[57] DAS R K,GOCHEVA V,HAMMINK R,et al.Stress-stiffening-mediated stem-cell commitment switch in soft responsive hydrogels[J].Nature Materials,2016,15(3):318-325.
