氯化锂对苯并[a]芘暴露致大鼠胚胎海马神经元损伤的改善作用
2021-06-15张楠张英英王鹤霏陈茜白文琳孙谊然张文平
张楠,张英英,王鹤霏,陈茜,白文琳,孙谊然,张文平
山西医科大学公共卫生学院 a.卫生毒理学教研室 b.流行病与卫生统计学教研室 c.儿少卫生与妇幼保健学教研室,山西 太原 030000
苯并[a]芘(benzo[a]pyrene,BaP)属于典型的多环芳烃类物质,广泛存在于化石燃料燃烧,香烟烟雾及汽车尾气中,是一种常见的环境致癌物,可通过呼吸道、消化道等途径进入机体,引起呼吸系统、心脑血管系统及神经系统疾病等,严重威胁人体健康[1]。研究表明BaP 具有较强的脂溶性,易透过胎盘屏障及血脑屏障,引起胎儿出生体重降低,儿童期智力下降及攻击行为增加等问题[2-4]。此外,动物实验研究也发现孕期暴露于BaP 可导致动物胚胎畸形,成年认知功能损伤或神经行为缺陷等现象[5-7]。而目前关于外源化学物对孕期BaP 暴露所致胚胎神经毒性的干预作用的研究鲜有报道。
近年来,随着多哈理论(Developmental Origins of Health and Disease,DOHaD)即健康和疾病的发育起源的流行,越来越多的研究人员关注到孕期宫内环境对胎儿生长及出生后长期发育的影响。目前国内外研究发现,孕期暴露于BaP 可通过诱导神经细胞过度氧化应激,线粒体损伤和神经递质活性下降,细胞凋亡等途径引起神经细胞或突触可塑性损伤,导致出生缺陷或出生后神经系统发育异常[8-9]。Wnt/β-catenin是一条进化上保守的信号通路,对胚胎期和出生后个体生长发育起着至关重要的作用,具体地说,Wnt/β-catenin通路调节神经干细胞的增殖、分化和迁移等关键过程,对神经系统的发育和动态平衡至关重要,它的失调与包括神经退行性疾病在内的各种神经系统疾病密切相关[10]。Marchetti等[11]的研究发现,老年帕金森病患者大脑中的Wnt/β-catenin信号激活可以促进神经再生,有助于恢复脑室下区微环境和增强神经救援。
氯化锂(lithium chloride,LiCl)是临床上广泛使用的情绪稳定剂,已被证明具有神经营养、促进神经干细胞增殖和抑制神经元凋亡的作用[12-13]。LiCl可抑制糖原合酶激酶-3β(glycogen synthasc kinase-3β,GSK-3β)的活性,主要通过GSK-3β 磷酸化失活,释放其下游蛋白β-catenin,使其在细胞核内蓄积,参与DNA 转录、翻译,进而调节下游基因的表达,促进神经元生长[14]。而目前,LiCl 对BaP 暴露所致的胚胎神经毒性是否有改善作用未见报道。因此,本研究拟构建孕期BaP 染毒模型,利用LiCl 进行干预,探讨LiCl 对BaP 暴露所致胚胎神经毒性的改善作用,为研究其具体作用机制提供实验依据。
1 对象与方法
1.1 主要试剂及器材
主要试剂:3,4-benzonpyrene(Sigma-Aldrich,美国),0.9%氯化钠注射液(石家庄四药有限公司,中国),LiCl(上海生工,中国),植物油(金龙鱼公司,新加坡),苏木素-伊红试剂盒、BCA 蛋白定量试剂盒、二抗-羊抗兔(博士德,中国),Anti-beta catenin、Anti-GSK-3β(Abcam,英国),Anti-pGSK-3β(Abclonal,中国)。主要仪器:-80℃超低温冰箱(Thermo,美国),智能化组织脱水机、石蜡包埋机、全自动切片机(Leica,德国),超声波震碎仪(新芝生物公司,中国),高速低温离心机(Eppendorf,德国),酶标仪(Molecular Devices,美国),电泳仪、化学发光凝胶成像仪(Bio-Rad,美国)。
1.2 动物染毒及处理
8 周龄SPF 级SD 大鼠[山西医科大学实验动物中心提供,动物生产许可证号:SCXK(晋)2019-0004],饲养于自然节律采光、环境温度(25±1)℃、湿度50%~60%的清洁级环境中,期间自由饮水和进食。适应性饲养2周后,雌雄(1∶1)于18:00合笼,次日8:00观察到阴栓视为合笼成功,记为妊娠第0 天(GD0 ),35只雌鼠连续合笼两晚,共合笼成功32只,受孕率为91.4%,从中随机选取30只孕鼠分为5 组,每组6只,分别为对照组(Control)、LiCl组(40 mg·kg-1LiCl)[15]、植物油组(soybean oil)、BaP 组(20 mg·kg-1BaP)和LiCl 干预组(20 mg·kg-1BaP+40 mg·kg-1LiCl)。LiCl 溶于生理盐水,BaP 溶于植物油,GD8 开始染毒,每天1 次,连续7 d,以每100 g 体重0.5 mL 体积灌胃的方式给药。LiCl干预处理于BaP 染毒前2 h 给药,对照组和植物油组给予相同体积的生理盐水或植物油。本项实验研究通过山西医科大学动物福利和伦理委员会审查(批准号:2020GLL042)并严格遵循相关规定。
观察孕鼠染毒期间的一般状态、外观体征、行为活动及摄食情况,记录其体重变化。GD14染毒结束后继续饲养,GD18 时对孕鼠麻醉,剖腹取出子宫连胚胎,测量并记录胎鼠总数、体重、身长和尾长,组织保存于-80℃。
1.3 HE染色
取出胚胎后,冰上快速剥离大脑,4%多聚甲醛固定24 h后,脱水,石蜡包埋,冠状切片厚度为5 μm;二甲苯常规脱蜡;梯度乙醇水化;37℃苏木素染色5 min;1%的盐酸酒精分化3 s;37℃伊红染液染色20 s;冲洗、脱水、透明、封片;光学显微镜观察并采图。
1.4 Western blotting检测
取出胚胎后,冰上快速剥离海马,加入适量RIPA裂解液、蛋白酶抑制剂及磷酸酶抑制剂,超声30 s,冰上静止15 min,低温离心取上清,BCA 法进行蛋白定量,调整蛋白浓度到同一水平,4℃孵育一抗过夜(Anti-beta catenin,1∶5 000;Anti-GSK-3β,1∶1 000;Anti-pGSK-3β,1∶2 000),TBST 洗3 次,4℃孵育二抗(1∶5 000)45 min,TBST 洗3 次,Bio-Rad 显影仪显影,Image J 1.46 分析蛋白灰度值。
1.5 统计学分析
应用SPSS 20.0 和GraphPad Prism 7软件对数据进行统计分析。计量资料采用均数±标准差(±s)表示,服从正态分布且满足方差齐性时,多组间比较用单因素方差分析,多个均数之间两两比较采用Turkey’s 检验;孕鼠体重变化采用重复测量方差分析,多个均数之间两两比较采用q检验。双侧检验水准α=0.05。
2 结果
2.1 孕鼠的一般情况及体重变化
染毒期间,各组孕鼠状态良好,外观未见明显异常,被毛光泽。孕鼠体重采用重复测量方差分析,结果如图1所示,各组间孕鼠体重增长不全相同(F时间=92.25,P<0.001;F组间=3.933,P=0.005;F交互=0.477,P=0.924)。GD14 和GD18,组间主效应显示,植物油组和LiCl组孕鼠体重增长与对照组相比差异均无统计学意义(均P>0.05);BaP组孕鼠体重[(323.34±5.71)g、(364.34±10.41)g]均较对照组[(339.17±7.10)g、(390.32±11.35)g]减少,差异有统计学意义(P=0.026,P=0.045);LiCl 干预组孕鼠体重[(345.05±7.72)g、(398.73±12.32)g]较BaP 组增加,差异有统计学意义(P=0.034,P=0.029)。

图1 BaP 暴露对孕鼠体重增长的影响(n=6)Figure 1 Body weight of pregnant rats after BaP exposure (n=6)
2.2 胎鼠发育情况
表1为GD18胎鼠发育指标测量结果。结果显示,5组间胎鼠体重、身长、尾长不全相同,单因素方差分析差异均有统计学意义(F体重=17.60,P<0.001;F身长=8.04,P<0.001;F尾长=3.38,P=0.024);两两比较,LiCl组和植物油组GD18 胎鼠体重、身长、尾长均与对照组差异无统计学意义(均P>0.05),BaP 组胎鼠体重、身长、尾长均下降,差异均有统计学意义(P<0.001,P=0.008,P=0.024),LiCl 干预组胎鼠体重、身长、尾长较BaP 组升高,差异有统计学意义(P<0.001,P<0.001,P=0.022)。
表1 BaP暴露对GD18胎鼠发育指标的影响(±s)Table 1 Development indexes of GD18 fetal rats after BaP exposure (±s)
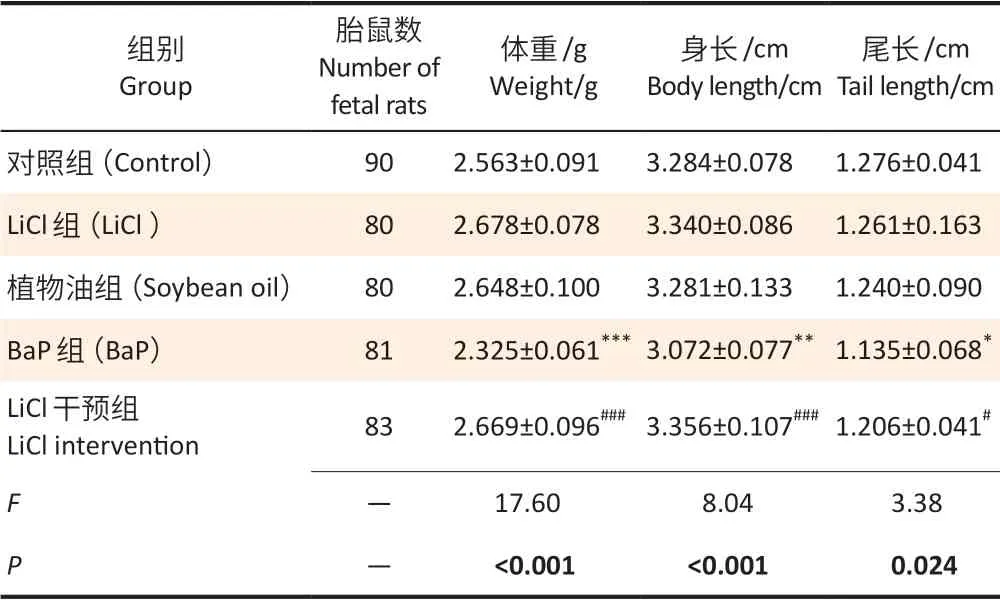
表1 BaP暴露对GD18胎鼠发育指标的影响(±s)Table 1 Development indexes of GD18 fetal rats after BaP exposure (±s)
[注]与对照组相比,*:P<0.05,**:P<0.01,***:P<0.001;与BaP组相比,# :P<0.05,###:P<0.001。[Note]Compared with the control group,*:P<0.05,**:P<0.01,***:P<0.001;Compared with the BaP group,#:P<0.05,###:P<0.001.
组别Group胎鼠数Number of fetal rats体重/g Weight/g身长/cm Body length/cm尾长/cm Tail length/cm对照组(Control) 90 2.563±0.091 3.284±0.078 1.276±0.041 LiCl 组(LiCl ) 80 2.678±0.078 3.340±0.086 1.261±0.163植物油组(Soybean oil) 80 2.648±0.100 3.281±0.133 1.240±0.090 BaP组(BaP) 81 2.325±0.061*** 3.072±0.077** 1.135±0.068*LiCl 干预组LiCl intervention 83 2.669±0.096### 3.356±0.107### 1.206±0.041#― 17.60 8.04 3.38 P―<0.001<0.001 0.024 F
2.3 胎鼠海马组织的形态学改变
光镜下观察,GD18 胎鼠海马组织HE 染色结果如图2所示,对照组、LiCl 组和植物油组海马齿状回(dentate gyrus,DG)区神经元细胞排列整齐,形态正常。BaP 暴露组出现不同程度神经元胞体缩小,核固缩,细胞染色加深,胞核胞质分界不清,数量减少,而LiCl 干预组上述情况有所减轻。

图2 BaP暴露对GD18胎鼠海马神经元病理学形态的影响(HE染色)Figure 2 Morphology of neurons in hippocampus of GD18 fetal rats after BaP exposure (HE staining)
2.4 胎鼠海马组织pGSK-3β、GSK-3β 及β-catenin表达水平
与对照组相比,BaP 暴露致pGSK-3β 表达水平降低(对照组和BaP 组的灰度值比值分别为0.87±0.04、0.50±0.04,F=19.64,P<0.001),GSK-3β表达升高(对照组和BaP组的灰度值比值分别为1.53±0.14、2.09±0.11,F=5.90,P=0.011),β-catenin 表达降低(对照组和BaP组的灰度值比值分别为1.41±0.14、0.90±0.04,F=11.16,P=0.001);LiCl干预可明显逆转由BaP暴露引起的pGSK-3β 表达降低、GSK-3β 表达升高及β-catenin表达降低的现象(其灰度值比值分别为:pGSK-3β,0.69±0.08,P=0.036;GSK-3β,1.59±0.15,P=0.042;β-catenin,1.33±0.08,P=0.006)。LiCl 组和植物油组的pGSK-3β、GSK-3β 及β-catenin 表达水平与对照组相比差异均无统计学意义。见图3。
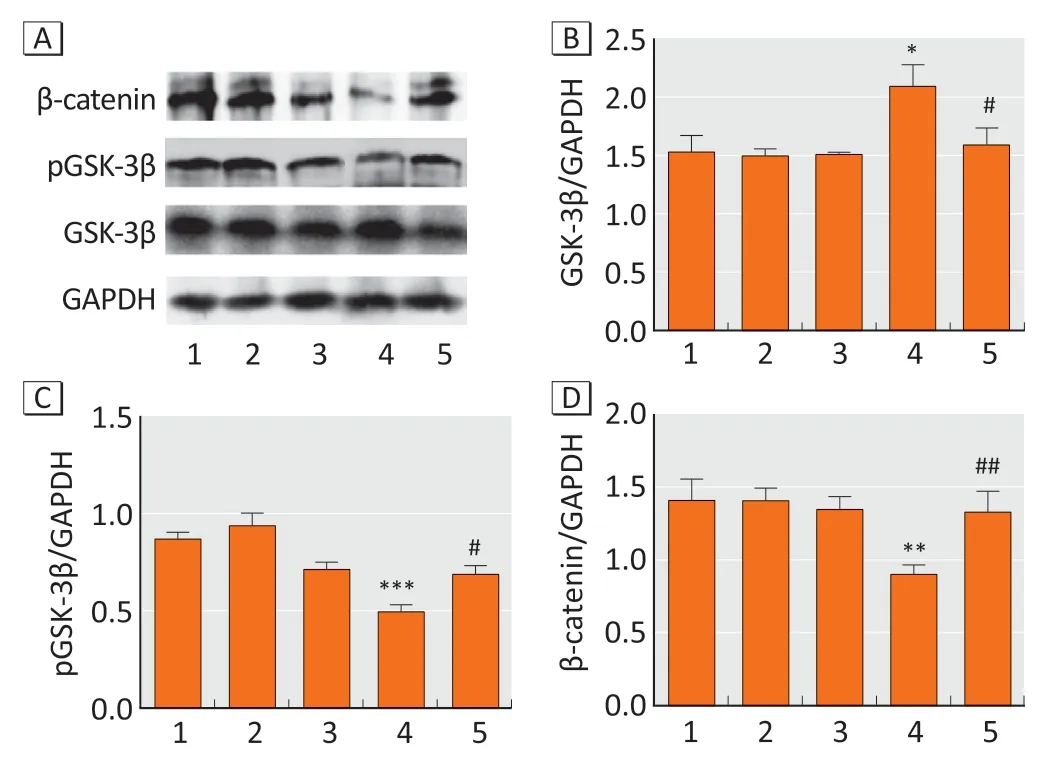
图3 BaP暴露后GD18 胎鼠海马组织β-catenin、pGSK-3β及GSK-3β 表达水平(n=6)Figure 3 Expressions of β-catenin,pGSK-3β,and GSK-3β protein in hippocampus of GD18 fetal rats after exposure to BaP (n=6)
3 讨论
日常生活中,人们可以接触到的多环芳烃类物质多种多样,主要来源于有机物的不完全燃烧,如汽车尾气、主/被动吸烟、熏烤食物等[16]。BaP 作为典型的多环芳烃类物质,其致癌性、致畸性和神经毒性众所周知[17-18]。由于BaP 具有较强的脂溶性,易透过胎盘屏障进入胎儿血液中,随血液循环系统透过血脑屏障,影响胎儿神经系统发育[19-20]。而目前关于外源化合物对BaP 孕期暴露所致胚胎毒性的干预作用的研究较少,寻找其预防药物成为国内外关注热点。LiCl 是临床上广泛应用的情绪稳定剂,在神经营养、神经元的保护及神经干细胞增殖分化上具有很好的疗效[14]。以往有研究表明双向情感障碍患者过量或长期的锂治疗可能会存在锂中毒的风险[21],而细胞实验发现LiCl 对大鼠胚胎中脑神经细胞仅具有细胞毒性,而非致畸物[22],在动物实验中,一定剂量的LiCl 对神经退行性疾病具有改善作用[23]。本研究选取了未对机体产生毒性作用的LiCl 剂量进行干预,探讨其对孕期BaP暴露引起的胚胎毒性的保护作用及分子调控机制。
本研究发现,染毒结束后GD14 和GD18,BaP 组孕鼠体重增长明显下降,表明BaP 暴露能够引起胚胎宫内发育迟缓,GD18 时BaP 组胎儿体重、身长及尾长较对照组减小,证实BaP 暴露能够通过慢性毒性蓄积过程对胚胎后期生长发育产生持续影响。刘维春等[24]在大鼠孕期皮下注射尼古丁GD21 取出胎鼠,其身长和尾长均较对照组减小;伦宗姬等[25]的实验设计了大鼠孕前吸入香烟烟雾3 个月,GD20 麻醉取出胎鼠,发现胎鼠体重、身长、尾长也均较对照组降低。本研究中LiCl 干预能够明显改善BaP 暴露引起的宫内发育迟缓和胎鼠生长受限,说明LiCl 能够缓解BaP 暴露导致的胚胎发育迟缓。
脑组织神经元的正常生长是胚胎神经发育的基础。梁婧等[26]于孕前15 d经口给予大鼠BaP(2 mg·kg-1·d-1),GD9 时取出胚胎观察胚胎形态,发现胚胎内细胞出现异常凋亡结构等胚胎损伤。本实验利用HE 染色技术对海马组织神经元细胞形态进行观察,BaP 组胎鼠海马组织神经元细胞呈现部分胞体缩小,核固缩,细胞染色加深,胞核胞质分界不清,LiCl 干预能明显减少海马组织神经元固缩,表明孕期BaP 暴露可能导致胚胎神经元细胞损伤,而LiCl 干预能发挥一定的保护作用。
研究表明LiCl 能够通过抑制GSK-3β 的活性,进而调控神经干细胞增殖、分化和迁移,增加DG区新生神经元数量[27-28]。为了阐明LiCl 改善BaP 暴露导致胚胎神经毒性的分子调控过程,本实验检测了GD18 胎鼠海马组织中pGSK-3β、GSK-3β 和β-catenin 的蛋白表达水平。结果发现与对照组相比,LiCl 组pGSK-3β、GSK-3β 及β-catenin 表达水平差异无统计学意义,LiCl 干预组较BaP 组pGSK-3β 蛋白表达升高,GSK-3β 蛋白表达降低及β-catenin 蛋白表达升高,提示40 mg·kg-1LiCl 单独作用对GSK-3β 的磷酸化作用不大,但其与BaP 联合作用时,可显著改善BaP 所致的pGSK-3β 表达下降。苗利萍等[29]在LiCl 对异氟醚诱导发育期幼鼠海马毒性的研究中也发现单独LiCl 干预对GSK-3β 的磷酸化作用不大,但其可改善异氟醚诱导的幼鼠海马毒性作用。以上结果提示LiCl 可通过调控GSK-3β/β-catenin 蛋白水平改善BaP 暴露所致胚胎毒性及海马组织神经元损伤。本研究通过构建大鼠孕期BaP 暴露模型,探讨氯化锂对BaP 所致的胚胎神经毒性的改善作用。结果表明,孕期BaP 暴露能够引起胚胎生长发育迟缓及海马神经元病理学改变,LiCl 对上述形态学损伤有一定改善作用,其机制可能与LiCl 抑制GSK-3β 活性进而提高β-catenin 的表达相关。值得深思的是,作为GSK的抑制剂,本研究并没有发现单独LiCl 作用能够引起pGSK-3β 表达的升高,这也正是我们需要进一步通过不同干预剂量孕鼠给药或者胎鼠直接给药,从而进行机制方面的深入研究和探讨的关键所在,以期为寻求适宜的LiCl 作用剂量提供科学依据。
