孕鼠补充N-乙酰半胱氨酸对镉致其雄性子代肾脏结构损害的保护作用
2021-06-15曹学林朱华龙熊永伟刘韦伯易颂佳时雪婷周国祥戴丽敏王华
曹学林,朱华龙,熊永伟,刘韦伯,易颂佳,时雪婷,周国祥,戴丽敏,王华
安徽医科大学 a.公共卫生学院卫生毒理学系 b.环境毒理学安徽普通高校重点实验室,安徽 合肥 230032
镉(cadmium,Cd)作为一种有毒重金属,广泛存在于环境[1]。环境镉主要通过饮水、饮食、呼吸等途径进入机体,进入人体的镉易在肾脏中蓄积并对其产生毒性作用[2]。镉也是一种生殖发育毒物[3]。前期人群调查研究和动物研究显示,孕期母体镉处理诱导胎儿生长受限发生[4-6]。健康与疾病发育起源学说表明,胎儿生长受限是成年期慢性疾病高发的重要原因[7-8]。
慢性肾脏疾病是影响人类健康的重大疾病,其发生率正逐年升高[9]。有研究表明,慢性肾脏疾病的发生可能与高脂饮食、糖尿病、高血压、心血管疾病等因素有关,但是仍有一些慢性肾脏疾病的发生原因不明[10-13]。研究表明,宫内生长受限与出生后慢性肾脏疾病的发生呈现正向关联[14-15]。动物实验发现,孕期母体营养缺乏等不良环境暴露会影响子代肾脏血液供应,最终对肾脏发育产生不利影响[16-18]。有研究表明增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)是一种细胞周期相关蛋白,作为细胞增殖的指标,其与肾脏发育相关疾病密切有关[19]。此外,鲍曼囊腔面积改变可以反映肾脏结构损伤[20-21]。然而,孕期母体镉暴露对子代肾脏发育的影响及其机制尚不清楚。
研究表明,氧化应激是胎源性成年疾病的重要诱发因素[22]。作为烟酰胺腺嘌呤二核苷酸磷酸氧化酶(nicotinamide adenine dinucleotide phosphate oxidase,NOX)家族成员之一,NOX4在肾脏组织表达丰度最高,主要通过促进活性氧生成并对细胞产生损害作用[23-24]。超氧化物歧化酶2(super oxygen dehydrogenises 2,SOD2)是一种抗氧化酶,主要反映机体的抗氧化能力[25-26]。课题组前期研究发现,孕期补充抗氧化剂N-乙酰半胱氨酸(N-acetyl-cysteine,NAC)显著缓解镉激活胎盘氧化应激,逆转镉诱导胎儿生长受限[27]。动物研究证实,成年小鼠镉暴露通过诱发氧化应激导致肾脏损伤[28]。但孕期母体补充NAC 是否缓解镉激活胎肾氧化应激,进而逆转镉所致子代肾脏损伤仍不清楚。本研究主要探讨孕期母体补充NAC 对镉所致子代肾脏发育异常的保护作用及其机制,该研究结果可为今后制定胎源性肾脏疾病临床防治策略提供科学依据。
1 对象与方法
1.1 实验动物与饲养条件
清洁级健康CD-1 小鼠(8 周,50 只雄鼠30~32 g,120 只雌鼠26~28 g)购于北京维通利华实验动物技术有限公司。实验前适应性喂养2周[自由饮食、昼夜均衡,温度20~25℃,湿度(50±5)%]。交配时,按1:2(雄性:雌性)于21:00合笼,次日早晨7:00检查雌鼠阴栓,查到阴栓者定为妊娠第0天(GD0)。部分GD18 孕鼠被剖杀留取雄性胎鼠肾脏并称重;部分孕鼠在妊娠第18天产仔,记为子一代(F1),即出生后第0天(PND0),用普通饲料和反渗透水喂养子一代。所有动物实验均得到安徽医科大学实验动物伦理委员会批准(批准号:LLSC20140045)。
1.2 动物模型构建及分组
将65只孕鼠饲养至GD7,按体重随机分为对照组(12只)、NAC(500 mg·kg-1,13只)组、低浓度镉(LCd,50 mg·L-1CdCl2,12 只)组、高浓度镉(HCd,150 mg·L-1CdCl2,13 只)组、NAC 加高浓度镉(NCd,500 mg·kg-1NAC+150 mg·L-1CdCl2,15只)组。染毒方式为:NAC 组和NCd 组于GD7―GD17,每天给予NAC(500 mg·kg-1)灌胃处理一次;对照组和NAC 组从GD8―GD17,给予自由饮用反渗透水处理;LCd 组、HCd 组和NCd 组孕鼠在GD8―GD17 分别经饮水暴露不同质量浓度氯化镉(CdCl2)溶液(50、150、150 mg·L-1)。将孕鼠分为两批:第一批每组4~5 只孕鼠在GD18 上午摘眼球取血后,以颈椎脱臼法处死后取子宫连胎,随后称量胎鼠体重,取胎鼠肾脏并称重;第二批每组8~11 只孕鼠自然分娩,获得子一代,用生长繁殖饲料和反渗透水适应性喂养,并将雄性子一代分两批于PND35、PND98 取材,摘眼球取血,以颈椎脱臼法处死后,取肾脏,血清、肾脏置于-80℃保存待用。
1.3 主要试剂
CdCl2、NAC(美国Sigma),PCNA 抗体(美国Cell Signaling),SOD2抗体(货号:ab13534)、NOX4抗体(货号:ab133303;英国Abcam),甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(货号:AF7021;美国Affinity Biosciences),肌酐、尿素、尿酸检测试剂盒(中国伊利康),二喹啉甲酸(bicinchoninic acid,BCA)蛋白试剂盒、增强化学发光(enhanced chemiluminescence,ECL)试剂盒(美国Pierce),CS-T300 生化分析仪(中国迪瑞),Bio-Rad ChemiDoc MP 全能型成像系统(美国Bio-Rad)。
1.4 肾组织HE染色
将肾脏组织放入4%多聚甲醛溶液中浸泡24 h后,梯度乙醇脱水、石蜡包埋和组织切片。将准备好的组织切片放入60℃烤箱烘烤30 min,然后将切片放入二甲苯脱蜡30 min,梯度乙醇水化(100%、95%、80%、70%、50%乙醇)各浸泡5 min;蒸馏水冲洗切片数分钟后用苏木素液染核10~15 min,用自来水冲洗片刻后用1%盐酸酒精分化数分钟,用流水冲洗片刻,用碳酸锂饱和水溶液返蓝;待返蓝结束后用自来水冲洗15 min 左右,用伊红水溶液复染;用自来水冲洗后,经梯度乙醇和二甲苯脱水透明后,用中性树胶封片。在光镜下观察并拍照。对肾脏鲍曼囊腔空间区域的形态分析,在400 倍显微镜拍摄每只小鼠各8~12 个肾小球,使用Image J 1.51 软件测量肾小球毛细血管簇面积和鲍曼囊面积,通过将鲍曼囊面积与肾小球毛细血管簇面积相减得到鲍曼囊腔空间面积,测量面积的8~12个值的平均值被认为是每只小鼠平均面积。
1.5 Western blotting法检测PCNA、NOX4、SOD2蛋白表达
取50 mg 肾脏,用500 μL 放射免疫沉淀法(radioimmunoprecipitation assay,RIPA)裂解液在冰上裂解,提取组织总蛋白,将裂解后组织匀浆用12 000×g离心15 min,吸取上清液后用BCA 法定量蛋白,将定量好的蛋白在100℃环境下变性10 min 后,置于-80℃保存待用。然后用Western blotting 方法检测胎鼠肾脏NOX4、SOD2 和不同阶段仔鼠肾脏PCNA 蛋白表达水平。总蛋白通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacryamide gel electropHoresis,SDS-PAGE)电泳分离并转移到聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜上。浸入5%脱脂牛奶中封闭1 h 或者4℃封闭过夜。PVDF 膜分别用PCNA、SOD2、NOX4、GAPDH 一抗(体积比1:1 000)室温孵育1 h。用含有含0.05% Tween20 的三羟甲基氨基甲烷缓冲液(tris buffered saline with Tween 20,TBST)溶液洗涤3 次,每次7~10 min。洗涤后的PVDF 膜用辣根过氧化物酶标记的山羊抗兔或山羊抗鼠IgG 抗体(1:40 000~1:80 000)室温孵育1~2 h,再用TBST 溶液洗涤3 次,每次7~10 min,随后用增强化学发光试剂盒进行发光检测,用天能自动曝光仪进行显色,显影条带采用凝胶图像处理系统Image J 1.51软件分析目标条带的光密度值,用GAPDH作为内参进行定量分析。
1.6 统计学分析
所有数据均用SPSS 16.0 软件处理,定量试验资料均采用均数±标准误(±s)表示,多组间差异采用单因素方差分析。若总体方差齐,采用LSD-t检验进行组间两两比较;若总体方差不齐,则采用Tamhane’s T2>检验。检验水准α=0.05。
2 结果
2.1 孕鼠一般情况
所有实验孕鼠被随机分为五组,孕鼠体重和进食量被记录。检查结果表明,各组间孕鼠净增重差异无统计学意义。
2.2 胎鼠
2.2.1 肾脏质量和增殖如图1A 和图1B 所示,各处理组雄性胎鼠肾脏质量和肾脏系数差异有统计学意义(F=15.71,P<0.01;F=6.24,P<0.01)。LCd 组、HCd组胎鼠肾脏质量和肾脏系数均明显低于对照组(P<0.05),而NCd 组胎鼠肾脏质量和肾脏系数较HCd 组明显升高(均P<0.05)。图1C 和图1D 结果表明,与对照组相比,LCd 组、HCd 组胎鼠肾脏PCNA 蛋白表达分别下调20%和42%(均P<0.05),而NCd 组胎鼠肾脏PCNA蛋白表达较HCd 组上调98%(P=0.043)。

图1 孕期母体补充NAC 对雄性胎鼠肾脏质量和增殖的影响Figure 1 Effects of maternal NAC supplementation during pregnancy on renal weight and proliferation in male fetal mice
2.2.2 胎鼠肾脏的氧化应激指标如图2A 和图2B 所示,LCd 组、HCd 组雄性胎鼠肾脏组织NOX4、SOD2 蛋白表达水平明显高于对照组(均P<0.05)。如图2C 和图2D 所示,NCd 组胎鼠肾脏组织NOX4、SOD2 蛋白表达量明显低于HCd 组(均P<0.05)。
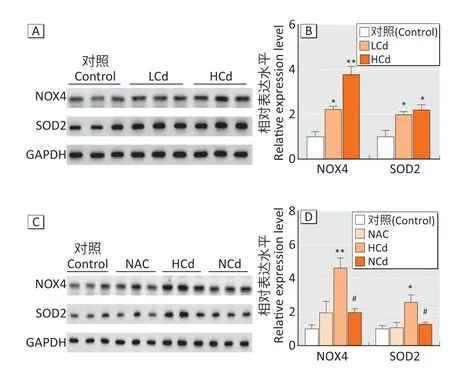
图2 孕期母体补充NAC对镉诱导雄性胎鼠肾氧化应激的影响Figure 2 Effects of maternal NAC supplementation during pregnancy on cadmium-induced oxidative stress in male fetal mice
2.3 青春期小鼠
2.3.1 肾脏质量和增殖如图3A和3B所示,五组青春期雄性仔鼠肾脏质量和肾脏系数差异有统计学意义(F=9.95,P<0.01;F=4.67,P<0.01)。与对照组比较,LCd 组青春期仔鼠肾脏质量明显下降(P=0.028),但肾脏系数差异无统计学意义(P>0.05);HCd 组青春期仔鼠肾脏质量和肾脏系数较对照组均明显下降(P<0.01),而NCd 组青春期仔鼠肾脏质量和肾脏系数均明显高于HCd 处理组(P<0.01)。图3C 和3D 结果表明,与对照组相比,LCd 组、HCd 组青春期仔鼠肾脏PCNA 蛋白表达分别下调56%和49%(均P<0.05),而NCd 组仔鼠肾脏PCNA 蛋白表达较HCd 组上调1.17 倍(P<0.05)。

图3 孕期母体补充NAC 对青春期雄性仔鼠肾脏质量和增殖的影响Figure 3 Effects of maternal NAC supplementation during pregnancy on renal weight and proliferation in male adolescent offspring
2.3.2 肾脏结构和功能如图4A和4B 所示,各组之间青春期雄性仔鼠肾脏鲍曼囊腔的面积差异有统计学意义(F=254.18,P<0.01)。LCd 组、HCd 组中,仔鼠鲍曼囊腔的面积明显低于对照组(P<0.01),而NCd组鲍曼囊腔的面积明显高于HCd组(P<0.01)。如表1所示,五组青春期仔鼠血清肌酐、尿素、尿酸水平差异均没有统计学意义(P>0.05)。
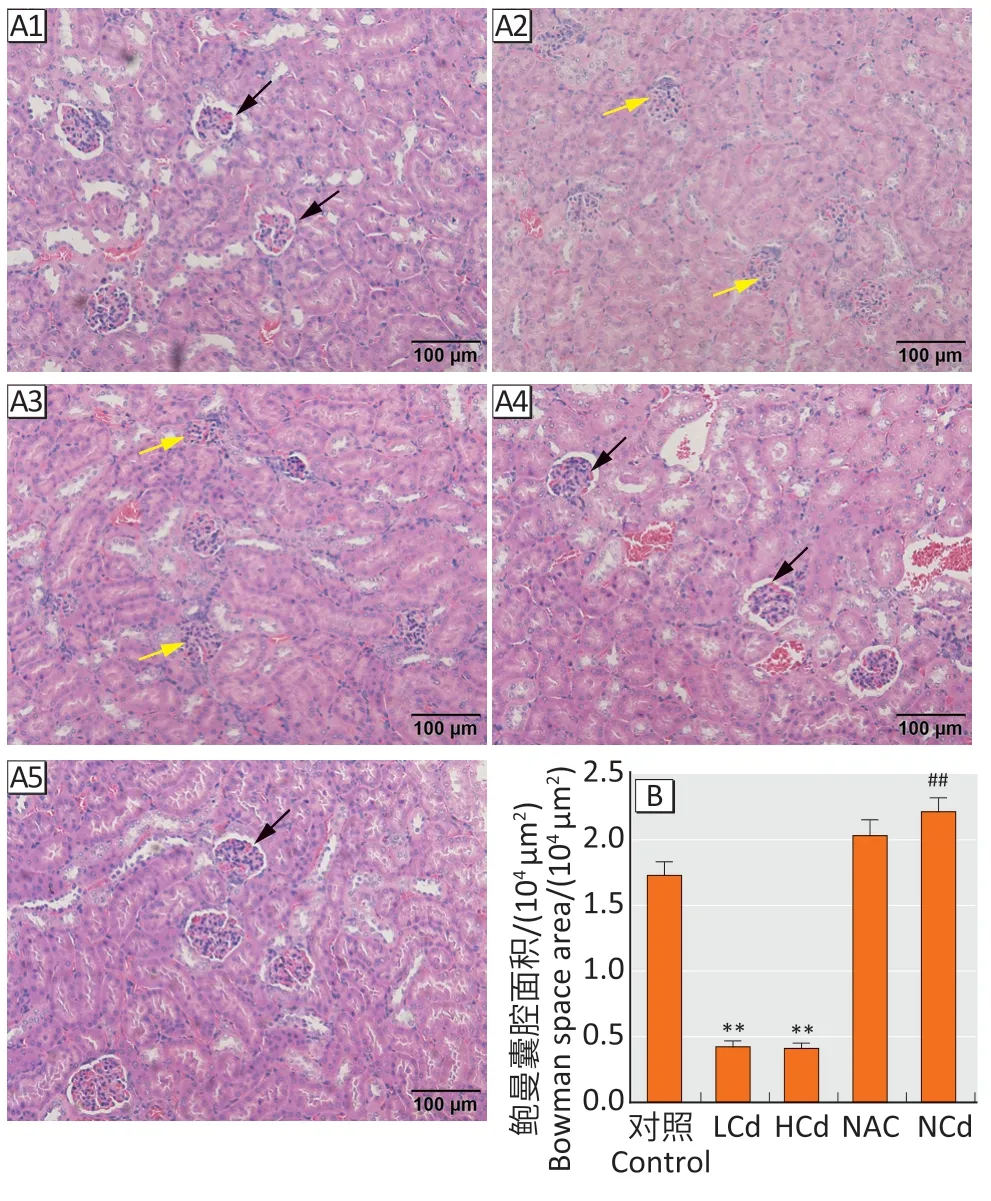
图4 孕期母体补充NAC对镉致青春期雄性仔鼠肾脏结构的影响Figure 4 Effects of maternal NAC supplementation during pregnancy on cadmium-induced renal structure in male adolescent offspring

表1 孕期母体补充NAC对镉致青春期雄性仔鼠肾功能的影响Table 1 Effects of maternal NAC supplementation during pregnancy on cadmium-induced renal function impairment in male adolescent offspring
2.4 成年期小鼠
2.4.1 肾脏质量和增殖如图5A和图5B所示,五组成年期雄性仔鼠肾脏质量、肾脏系数差异无统计学意义(F=2.01,P=0.115;F=0.37,P=0.830)。与对照组比较,LCd 组仔鼠肾脏质量无明显变化(P>0.05),HCd 组明显下降 (P=0.028),NCd组成年期仔鼠肾脏质量较HCd组升高(P=0.038)。如图5C和5D所示,与对照组相比,LCd 组、HCd 组成年期小鼠肾脏PCNA 蛋白表达分别下调65%和85%(均P<0.05),而NCd 组成年期小鼠肾脏PCNA蛋白表达较HCd 组上调1.27倍(P=0.048)。

图5 孕期母体补充NAC对成年期雄性仔鼠肾脏质量和增殖的影响Figure 5 Effects of maternal NAC supplementation during pregnancy on renal weight and proliferation in male adult offspring
2.4.2 肾脏结构和功能如图6A和图6B 所示,各组成年期雄性仔鼠肾脏鲍曼囊腔的面积差异有统计学意义(F=165.28,P<0.01)。LCd 组、HCd 组中,成年期仔鼠鲍曼囊腔的面积明显低于对照组(P<0.01),而NCd组鲍曼囊腔的面积明显高于HCd 组(P<0.01)。如表2中所示,五组成年期仔鼠血清肌酐、尿素、尿酸水平差异均没有统计学意义(P>0.05)。

图6 孕期母体补充NAC对镉致成年期雄性仔鼠肾脏结构的影响Figure 6 Effects of maternal NAC supplementation during pregnancy on cadmium-induced renal structure in male adult offspring

表2 孕期母体补充NAC 对镉致成年期雄性仔鼠肾功能的影响Table 2 Effects of maternal NAC supplementation during pregnancy on cadmium-induced renal function impairment in male adult offspring
3 讨论
以往研究结果表明,孕期母体镉暴露损害胎儿生长并诱发胎儿生长受限[5]。但孕期母体镉暴露对子代发育的远期影响却知之甚少。本研究结果表明,孕鼠镉暴露可导致青春期和成年期雄性仔鼠肾脏质量和肾脏系数下降,以及肾脏组织PCNA 蛋白表达水平降低。鲍曼囊腔的完整性与细胞增殖和肾脏氧化应激有关[20,29-30]。本研究进一步发现抗氧化剂NAC 能够缓解镉致胎鼠肾氧化应激和细胞增殖,拮抗镉降低青春期和成年期仔鼠肾脏鲍曼囊腔面积。上述结果提示,镉降低鲍曼囊腔面积可能与镉激活胎肾氧化应激和抑制细胞增殖有关。本研究通过肾脏组织病理定量分析发现,孕鼠镉暴露可降低青春期和成年期雄性仔鼠肾脏鲍曼囊腔面积。肌酐、尿素、尿酸是反映肾功能的重要指标,但本次实验发现,孕鼠镉暴露对青春期和成年期雄性仔鼠肾功能无影响。这可能与子代小鼠肾脏代偿能力有关,也可能与镉暴露组子代肾功能迟发损害有关。上述结果提示,孕鼠镉暴露对青春期和成年期仔鼠肾脏结构发育产生远期影响,但其诱发机制尚不清楚。
健康与疾病发育起源学说认为,孕期母体暴露不良因素影响胎儿生长发育,进而导致其成年后疾病易感性增加[8]。有研究表明,宫内生长受限导致胎儿出生后或成年慢性肾脏疾病高发[14-15]。人群调查与动物实验结果均表明,孕期母体镉暴露导致胎儿生长受限[5,31-32]。本研究主要探讨孕鼠镉暴露对胎鼠肾脏发育的影响。研究结果表明,孕鼠镉暴露可导致胎鼠肾脏质量和肾脏系数下降,以及胎鼠肾脏组织PCNA 蛋白表达水平降低。上述结果提示,胎鼠肾脏发育异常可能是镉所致青春期和成年期子代小鼠肾脏发育异常的主要原因。
氧化应激损伤是镉引起肾脏毒性机制之一[28]。有研究显示,成年期动物经镉染毒后引起肾脏细胞氧化损伤[33-34]。早期研究表明,孕期毒物暴露可以通过氧化应激引起青春期子代小鼠肝脏损伤[35-36]。但是,氧化应激在镉处理导致胎肾损伤中的作用尚不清楚。NOX4作为NOX家族成员在肾脏组织内表达最多的亚型,其主要通过促进活性氧生成对细胞产生损害作用[23-24];SOD2 是SOD 家族中的一员,属于一种抗氧化酶,主要反映机体的抗氧化能力[25-26]。本研究结果显示,孕鼠镉暴露明显升高胎鼠肾脏组织NOX4 和SOD2 蛋白表达水平。这些结果提示,氧化应激可能在孕期母体镉暴露所致胎肾发育异常中起关键作用。
NAC 是细胞内还原性谷胱甘肽的前体,其分子中含有活性巯基,可拮抗不同原因所致的组织氧化损伤[37];同时NAC 对体内氧自由基具有明显的拮抗作用,是一种强有效抗氧化剂[38]。本课题组前期研究表明,孕期母体NAC 干预明显减轻胎儿生长受限[27]。本研究结果显示,孕鼠补充NAC 可以有效改善镉所致青春期和成年期雄性仔鼠肾脏质量和肾脏系数下降,拮抗镉降低青春期和成年期仔鼠肾脏鲍曼囊腔面积,逆转镉对胎鼠、青春期和成年期仔鼠肾脏PCNA 蛋白表达的下调作用。进一步研究发现,孕鼠补充NAC 明显缓解镉所致胎肾氧化应激反应。这些结果提示,孕期母体补充NAC 缓解镉致子代小鼠肾脏发育异常可能与拮抗胎鼠肾脏氧化应激有关。
目前本研究还存在几点局限性。首先,高剂量的NAC 起到促氧化剂的作用,本研究只设置一种NAC 剂量进行研究,需要额外的工作来探索不同剂量NAC 对镉降低子代肾脏鲍曼囊腔面积保护作用的影响。其次,本研究只探讨了孕中晚期镉暴露对子代仔鼠肾脏鲍曼囊腔结构发育的影响,没有探讨孕早期镉暴露对子代仔鼠肾脏发育的影响。
综上,本研究发现孕鼠补充NAC 可明显缓解镉暴露所致雄性仔鼠肾脏发育异常,与其拮抗胎鼠肾脏氧化应激反应有关,该结果可为今后制定胎源性肾脏疾病的临床防治策略提供科学依据。
